Wnt/β-catenin通路在脉冲强磁场促神经干细胞增殖中的作用初探
2018-09-01龙兴蓝许涛邹丽丽蒋婷彭涛孙衢骎
龙兴蓝,许涛,邹丽丽 ,蒋婷,彭涛,孙衢骎
神经干细胞(neural stem cells,NSCs)是一种可以自我增殖、迁移并且能向神经元、少突胶质细胞、星形胶质细胞定向分化的干细胞[1-2]。NSCs的这种自我增殖及定向分化的特性,使其在神经系统疾病中的应用逐渐增多,特别是在退行性神经系统疾病中,如帕金森病等[3-4]。在疾病的治疗中NSCs的作用主要有两种,一种是替代治疗[5],另一种是基因治疗[6]。上述两种方法都需要将大量的NSCs移植到神经系统的相应部位以发挥作用。然而NSCs为终末分化前体细胞[7],其来源少,生长缓慢,增殖能力较弱,获取、培养与基因修饰都很困难,使大量获取NSCs成为困难,不能满足各种研究对其的需要。在前期实验中我们发现脉冲强磁场作为一种物理方法可以促进NSCs增殖[8-9],在场强4T,频率0.1Hz,刺激次数8次时,此种作用最明显。wnt/β-catenin通路是NSCs增殖与分化过程中的关键环节,在4T、0.1Hz、8次条件下的脉冲强磁场刺激过程中,可以观察到β-catenin的表达增加。虽然脉冲强磁场可以促进NSCs增殖,但是其机制还不明晰,因此我们需要进一步明确wnt/β-catenin通路在脉冲强磁场促NSCs增殖中的作用。
1 材料与方法
1.1 材料 ①实验动物: 出生72h以内新生的SD大鼠,不限雌雄,购买于华中科技大学同济医学院实验动物中心。②实验试剂:DMEM/F12高糖培养基(Hyclone公司),B27(美国nitrogen公司),大鼠碱性成纤维细胞生长因子(basic fibroblastgrowth factor, bFGF) (美国Gibco公司),人表皮生长因子(epidermal growth factor, EGF)(美国Gibco公司),Trizol试剂(美国Invitrogen公司),CCK-8试剂盒(日本同仁化学研究所),逆转录试剂盒和qPcr试剂盒(美国Fermentas公司)。
1.2 方法 ①NSCs的取材和培养:采用断颈法处死出生72h以内的SD大鼠乳鼠,然后浸泡于75%的酒精消毒。剪开乳鼠头皮,打开颅骨,暴露脑组织,随后去除表面的血管和筋膜。然后取出侧脑室部位组织,并再次去除血管和筋膜。将脑组织块剪碎成1mm3大小,并制成单细胞悬液,随后过滤并离心。随后用含2% B27、20ng/ml EGF、20ng/ml bFGF的新鲜培养基重悬沉淀,并接种在50ml培养瓶中。在37℃、5% CO2的培养箱中培养,每3天半量换液,每7天传代。②NSCs免疫组化:使用4%的多聚甲醛固定细胞并自然晾干。滴加3%过氧化氢后在室温下孵育15min,用PBS冲洗3次,然后滴加Nestin抗体4℃孵育过夜。PBS 冲洗3次,滴加聚合物辅助剂, 37℃孵育20min。再用PBS冲洗,然后加辣根过氧化物酶标记二抗IgG多聚体, 37℃孵育20~30min。然后PBS冲洗4次,加DAB显色液,显微镜下观察,阳性信号为棕黄色或棕褐色。最后使用Harris苏木素复染,脱水及封片后在显微镜下拍照。3.RNAi抑制NSCs中β-catenin的表达。③构建β-catenin shRNA 慢病毒载体: 根据Genbank中β-catenin RNA(NM_053357.2,GI:46048608)序列及查阅文献后,选取长度为19nt的干扰序列:β-catenin:5'-AAGATCTGAAGGCAGTCTG-3';分别靶向β-catenin基因的第898~917位碱基。其对应的shRNA序列的DNA序列如下(5'-3'):shRNA:GATCCCAAGATCTGAAGGCAGTCTGTCTTCAAGAGAGACAGACTGCCTTCAGATCTTTTTTTGGAT。并将其制作成能表达绿色荧光的慢病毒载体(由上海吉凯基因公司完成)。慢病毒转染NSCs,并观察不同感染复数(multiplicity of infection,MOI)值时RNAi慢病毒对神经干细胞中β-catenin mRNA的水平的影响: 将第一次传代后并培养4d的104个目的细胞接种于6孔板中;加入助染剂polybrenen,使其终浓度为5μg/ml;以MOI=0、0.1、1、10的浓度,加入慢病毒,并于24h后更换新鲜培养基。在转染后3d在基因水平检测各组细胞β-catenin的表达。用Real Time PCR检测β-catenin和内参基因的cDNA的扩增产物CT值进行相对定量分析。用BioRad IQ5软件制作实时PCR扩增曲线、熔解曲线及数值分析,用GraphPad PRISM 5.0软件制图。并计算不同MOI时,β-catenin的抑制效果。RNAi慢病毒对神经干细胞中β-catenin mRNA的水平的影响:将前面经慢病毒转染后的NSCs,在转染后3d在基因水平检测各组细胞β-catenin的表达。用Real Time PCR检测β-catenin和内参基因的cDNA的扩增产物CT值进行相对定量分析。用BioRad IQ5软件制作实时PCR扩增曲线、熔解曲线及数值分析,用GraphPad PRISM 5.0软件制图。并计算不同MOI时,β-catenin的抑制效果。Real Time PCR过程:使用Trizol法提取脉冲强磁场干预后7d的NSCs的总RNA,并检测器浓度及纯度;根据所测总RNA的浓度,每组分别加入Oligo(dt)及DEPC水并于65℃温度下变性5min。然后加入5×Reaction Buffer、RNA酶抑制剂、dNTP混合物及M-MLV逆转录酶。随后42℃孵育60min,70℃加热5min终止反应;取模版cDNA,分别加入上下游引物、SYBR荧光染料和超纯水,经历预变性、变性、退火/延伸过程;用BioRad IQ5软件制作实时PCR扩增曲线、熔解曲线及数值分析,用GraphPad PRISM 5.0软件制图。RNAi慢病毒对NSCs中β-catenin 蛋白水平的影响: 将前面经慢病毒转染后的NSCs,在转染后3d用Western blot法检测各组细胞β-catenin的表达。各组β-catenin的相对含量用β-catenin与内参的吸光度比值来表示。Western blot过程:电泳,用RIPA裂解液,测蛋白浓度后取50ug总蛋白上样电泳;转膜(湿转法),取出凝胶根据Marker切下目的条带,蒸馏水冲洗后,将甲醇浸泡的PVDF膜和滤纸一同浸泡于电转缓冲液中,然后使用nestin---200mA,60min后,300mA,60min进行转膜;封闭,封闭液浸泡PVDF膜并封闭2h;随后加一抗及辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗;显色曝光,将充分洗涤的PVDF膜滴加ECL底物液,孵育后显影、定影。④脉冲强磁场干预及CCK8检测干预后的NSCs增殖情况:将NSCs分为阴性组(转染无抑制β-catenin表达作用的对照病毒)和实验组(β-catenin shRNA病毒转染组);在转染后4d将NSCs移转移进15ml离心管中,使用条件为4T、0.1Hz、8次的脉冲强磁场干预[10-11];干预完后更换新鲜无血清培养基,随后放入培养箱中培养。④将经过干预后的1d、7d的各组细胞制成单细胞悬液并接种于96孔板中,使每孔细胞悬液的总体积为200μl,并培养数小时;加入CCK8试剂20μl后孵育4h,在酶标仪490nm波长下读取各孔OD值。每组设置6个复孔,实验重复3次,最后计算平均值。
1.3 统计学方法 采用GraphPad PRISM 5.0统计软件分析。其中CCK8检测的计量资料均数采用可重复的双因素方差进行统计学分析,其余结果采用单因素方差进行分析。以P<0.05为差异有统计学意义。
2 结果
2.1 NSCs形态观察及免疫组化染色 取材后在倒置显微镜下可观察到悬浮于培养基中的絮状组织块。取材3d后,在悬浮的组织块周围可观察到聚集生长的NSCs,NSCs胞体呈圆形,透亮,折光性好。取材7d后,可见悬浮生长的NSCs并聚集成球,传代时可见部分神经球融合。见图1,2。采用课题组前期NSCs鉴定方法。取材后一周在光镜下可见大量神经球(图1),对其进行免疫组化染色,可见其中含有大量棕褐色颗粒,说明nestin的阳性表达(图2),染色的部位主要在细胞质内,细胞染色均匀,大小一致,苏木素复染后可看到深染的细胞核[9-14]。
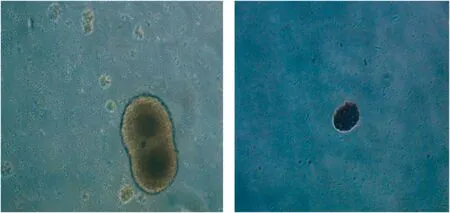
图1培养基中悬浮生长的神经球(×100)图2nestin表达阳性的神经球(×40)
2.2 慢病毒转染NSCs并观察不同MOI值时RNAi慢病毒对NSCs中β-catenin mRNA的水平的影响
2.2.1 Real Time PCR检测结果 转染后3d,在MOI=0、MOI=0.1、MOI=1及MOI=10时,在基因水平使用Real Time PCR检测NSCs mRNA的表达情况,和MOI=0时比较,在MOI=0.1、MOI=1及MOI=10时,均存在显著性差异(均P<0.01)。说明在MOI=0.1、MOI=1及MOI=10时,β-catenin的mRNA表达均减少,在MOI=10时最明显。见图3。
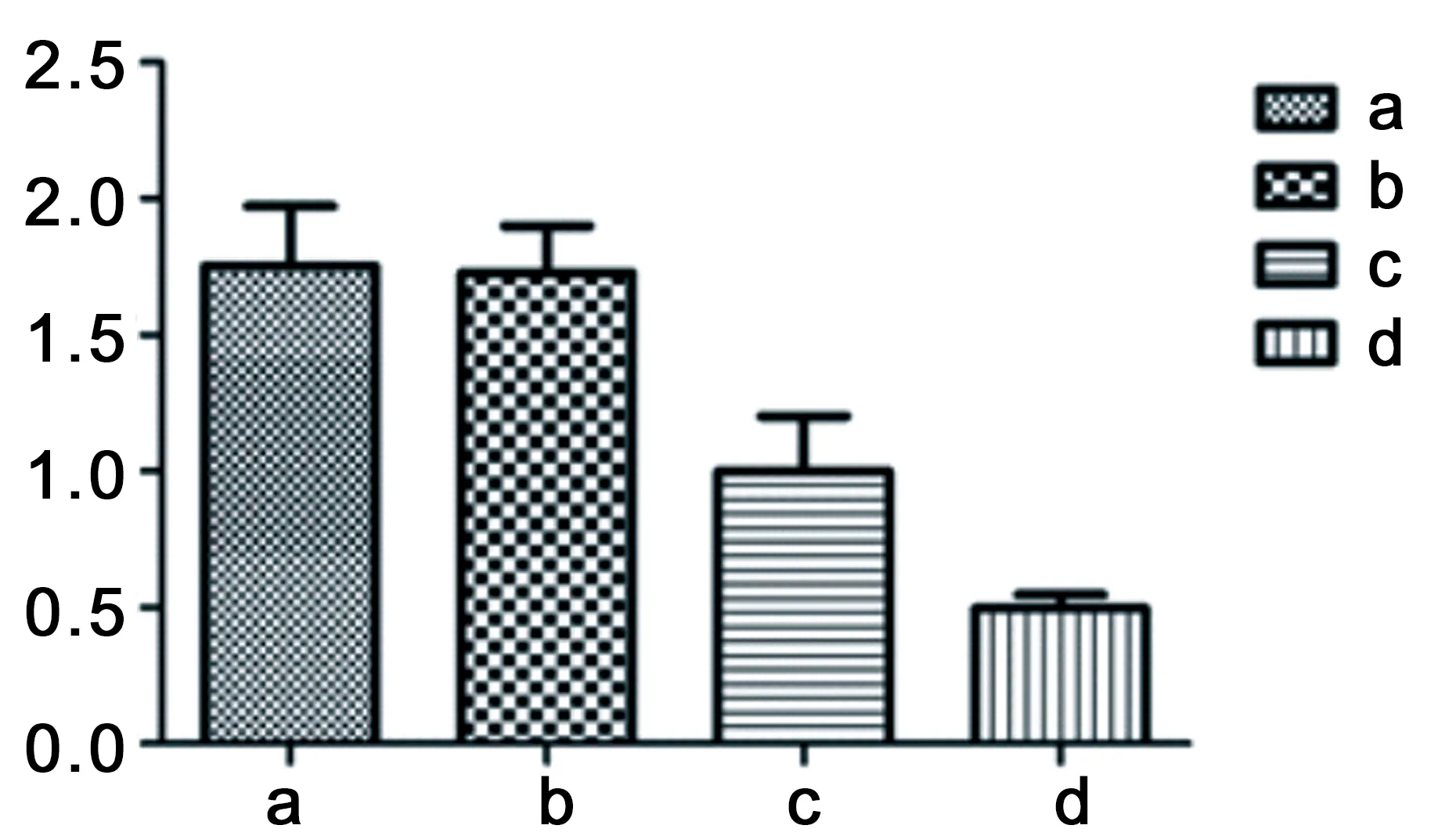
图3不同MOI时β-catenin mRNA 表达水平,a为MOI=0,b为MOI=0.1,c为MOI=1,d为MOI=10
2.2.2 Western Blot检测结果 β-catenin蛋白的表达水平,各组细胞GAPDH条带宽度相似,β-catenin条带组则在MOI=1、10时,条带宽度明显变细,如图4从左至右,在MOI=0、MOI=0.1、MOI=1及MOI=10时,β-catenin蛋白表达均减少。β-catenin与内参比值比较,可见从a到d,β-catenin/GAPDH呈下降趋势,见图5。
β-catenin GAPDH
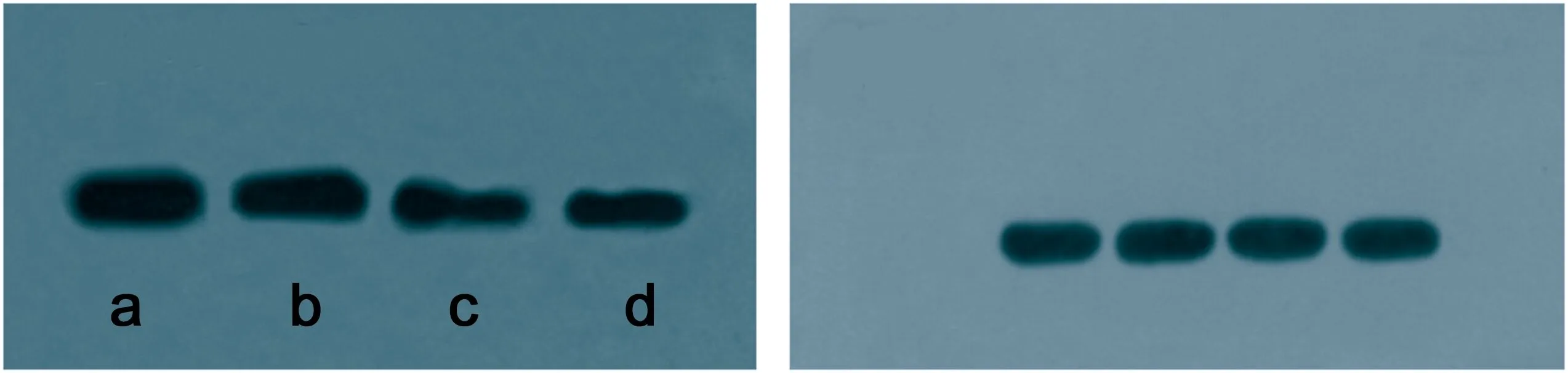
图4转染72h后,β-catenin蛋白的表达,a为MOI=0,b为MOI=0.1,c为MOI=1,d为MOI=10。各组细胞GAPDH条带宽度相似,β-catenin条带组则在MOI=1、10时,条带宽度明显变细
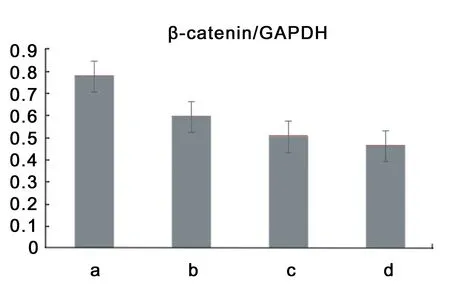
图5转染72h后,β-catenin与内参GAPDH的比值,a为MOI=0,b为MOI=0.1,c为MOI=1,d为MOI=10
2.3 CCK8检测脉冲强磁场干预后的NSCs增殖情况 我们用β-catenin shRNA 序列慢病毒和阴性慢病毒(只含有GFP,但无抑制β-catenin效果)转染NSCs,然后用4T、8次、0.1Hz的脉冲强磁场干预NSCs后,用CCK8试剂测试干预后1d、7d 时NSCs的增殖情况,与未经干预的对比。我们发现阴性组在干预后1d、7d增殖明显(P<0.05),而实验组在干预前后NSCs增殖水平无明显变化。见图6,7。
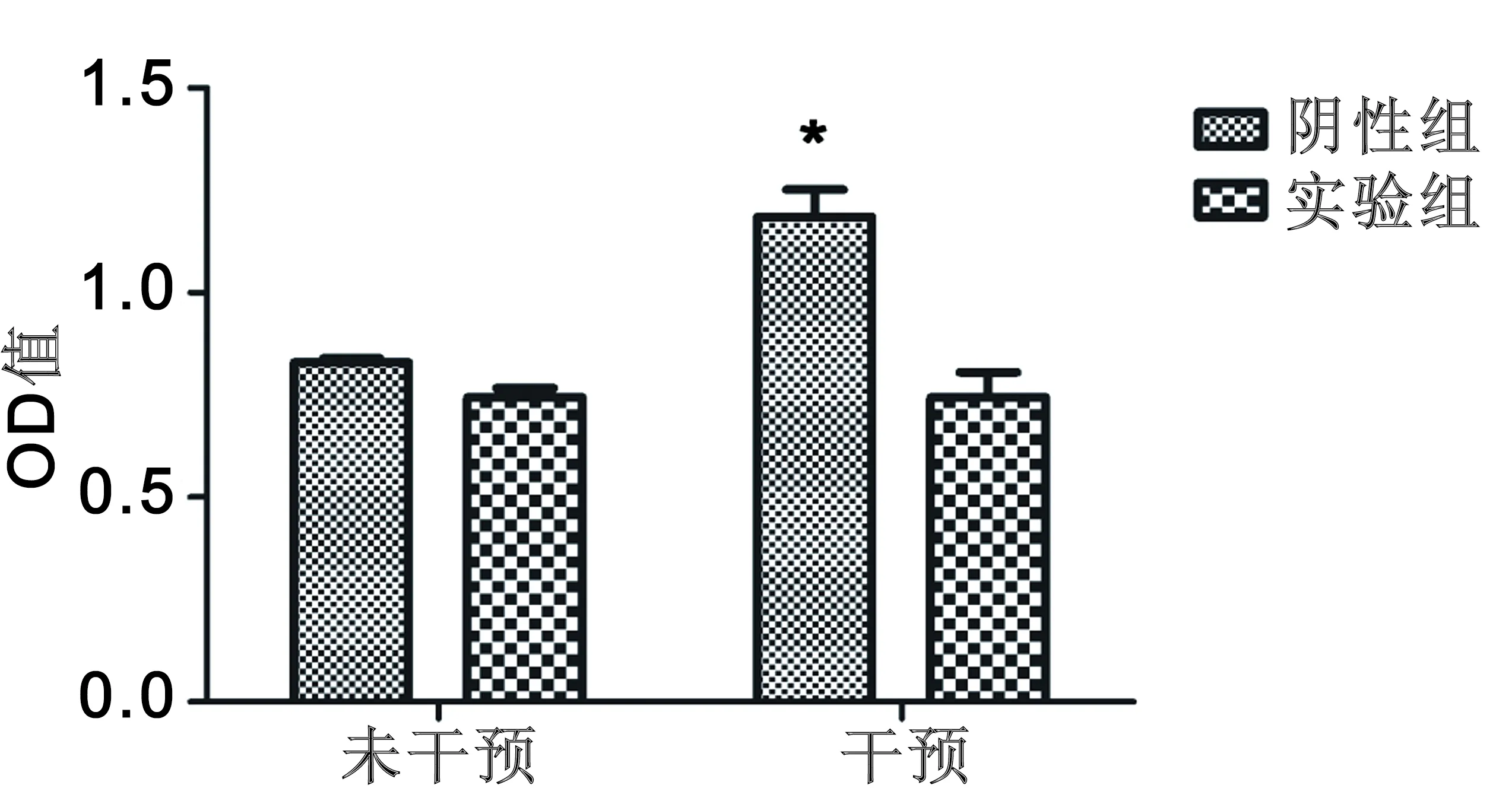
与未干预组比较,*P<0.05
图6干预后1d用CCK8法检测NSCs增殖水平
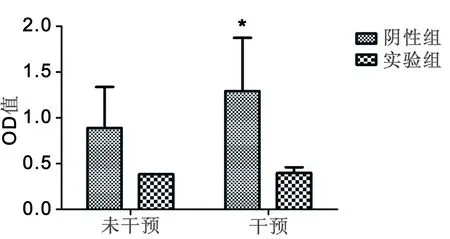
与未干预组比较,*P<0.05
图7干预后7d用CCK8法检测NSCs增殖水平
3 讨论
在湖北省青年科技人才基金以及国家自然科学基金的资助下,课题组前期成员利用国内首个脉冲强磁场对NSCs的作用进行了探索。利用华中科技大学的脉冲强磁场装置,发现其对NSCs有促增殖作用,且这种作用在4T、 0.1Hz、8次的刺激条件下最明显。随后我们发现在4T、 0.1Hz、8次的刺激条件下,NSCs中的β-catenin的表达增加[12]。而wnt/β-catenin通路又与NSCs的增殖有关,因此考虑前期课题组成员发现的脉冲强磁场促进NSCs增殖的效应可能是通过wnt/β-catenin经典通路起作用。在本实验中我们采用RNAi方法抑制NSCs中该通路的表达。在获得抑制β-catenin表达的NSCs后,用4T、 0.1Hz、8次的脉冲强磁场干预NSCs。在干预后1d、7d分别用CCK8法检测实验组与阴性组NSCs增殖水平,发现在干预前后,阴性组NSCs增殖明显,而实验组NSCs增殖则无明显变化。从图6、7可以看到,1d时阴性组和实验组在干预前后细胞数量变化水平小于7d时阴性组和实验组在干预前后细胞数量变化。在1d、7d时干预后,阴性组细胞增殖明显,而实验组细胞增殖变化不明显,说明在抑制β-catenin表达后,实验组的细胞增殖减少,而未抑制β-catenin时,阴性组的细胞增殖明显。
Wnt/β-catenin 信号通路在NSCs的增殖与分化过程中具有的关键作用,其在胚胎发育和肿瘤形成中起到非常关键的调控作用[13]。现已知wnt/β-catenin 信号通路几乎在神经发生的所有方面起作用,特别是经典wnt通路。其主要涉及以下4个方面:①神经管的发生;②维持神经前体细胞状态并控制其分化;③NSCs增殖;④参与轴突和树突的发生,突触的形成和突触的可塑性[14-16]。
不同阶段的神经发育均需Wnt基因的表达,特别是在胚胎神经系统发育过程中,经典Wnt信号通路参与胚胎NSCs的增殖与分化[17]。现有研究表明,Wnt/β-catenin 信号通路能够明显调控NSCs的增殖与分化。Wnt/β-catenin 通路激活可使成人海马区域皮质出现NSCs增殖。而稳定低水平表达的β-catenin蛋白则可使转基因小鼠大脑皮质NSCs增殖,并使皮质表面积增大[18]。Wnt通路与Notch 通路在出生后的神经形成过程中,协同作用增强了NSCs的分化,Wnt-1 可通过缩短细胞分裂周期促进NSCs的增殖[10]。此外,很多促NSCs增殖的方法也都是通过Wnt/β-catenin 通路发挥作用[17]。
前面提到,wnt/β-catenin通路参与了NSCs的增殖与分化过程,其能调节NSCs的数量,使其保持干细胞特性[18-19]。因此推测wnt/β-catenin通路在脉冲强磁场促进NSCs增殖的作用中可能通过这几个方面起作用:①脉冲强磁场可以促进细胞外wnt1、wnt3蛋白表达,从而促进wnt蛋白与细胞膜上受体结合并启动wnt/β-catenin通路。②经典wnt/β-catenin通路中,wnt蛋白与细胞膜上受体结合后,使NSCs细胞内LRP6发生磷酸化,从而增加NSCs内β-catenin数量因此我们认为脉冲强磁场干预NSCs后,通过LRP6的磷酸化间接增加β-catenin数量而表现促增殖效应[20]。③脉冲强磁场干预NSCs后抑制GSK3β,从而增加β-catenin数量。有关wnt/β-catenin通路在神经系统的作用中的研究也提到wnt/β-catenin通路能控制NSCs的增殖与分化,稳定表达低水平β-catenin 蛋白可促使转基因小鼠大脑皮质NSCs增殖及皮质表面积增大[15]。此研究也发现脉冲强磁场促NSCs增殖现象与wnt/β-catenin通路有关,且这种现象在抑制NSCs中β-catenin表达后不明显,这与文献报道相符合。
综合考虑,经4T、 0.1Hz、8次的脉冲强磁场干预的NSCs,其β-catenin数量增加,并与细胞核中的转录因子TcF/LEF结合[21],从而调节与增殖相关基因的转录,表现出促进NSCs增殖现象。因此认为脉冲强磁场促NSCs增殖现象与wnt/β-catenin通路有关。对wnt/β-catenin通路在脉冲强磁场促NSCs增殖效应中的作用的研究有利于弄清脉冲强磁场促NSCs增殖的机制,对后期经脉冲强磁场干预后的NSCs的安全性、分化研究都有帮助,并对将经过脉冲强磁场干预后的NSCs移植提供稳定、安全的细胞来源。由于NSCs增殖还与Notch通路、Shh-Gli通路、PPARγ通路等有关,但是本实验由于时间限制未检测上述通路在脉冲强磁场促NSCs增殖中的作用,后期可对相关通路在脉冲强磁场促NSCs增殖中的作用行进一步研究。
