内镜下钛夹夹闭法治疗大肠ESD术后超24 h迟发穿孔2例
2018-08-31钟彩玲苏艺胜刘添文赵小青张北平
钟彩玲 苏艺胜 李 叶 刘添文 赵小青 张北平
内镜黏膜下层剥离术 (Endoscopic Submucosal Dissection,ESD)是约2000年在内镜下黏膜切除术(Endoscopy Mucosal Resection,EMR)基础上发展起来的技术,其使病变的整体黏膜下完整切除成为可能。我国在2006年开始ESD技术应用于切除癌前病变与早癌治疗并开始推广使用[1]。其较外科手术具有创伤小、恢复快、保持生理功能等优势,逐渐成为消化道癌前病变与早癌的首选的微创治疗方法。
因ESD操作过程复杂,时间长,其对术者技术要求高。随着ESD广泛开展,ESD术穿孔、出血、术后狭窄等相关并发症也日益突出。穿孔是ESD的最严重的并发症之一,据报道其发生率约为1%~7%,包括术中穿孔和迟发性性穿孔[2]。由于结肠壁薄和结肠结构曲折,与胃镜下剥离术相比,结直肠ESD推广应用存在更多障碍,对术者操作技术要求更高,同时穿孔风险也较高[3]。由于大肠是储存粪便的场所,存在大量细菌,其穿孔后引起的腹膜炎比食管和胃穿孔更为严重。研究发现结直肠ESD穿孔率为1.4%~10.0%[4-5]。迟发穿孔更罕见,发生率为0.3%~0.7%[6]。但迟发性穿孔一般较大,可引起严重的并发症,如急性弥漫性腹膜炎、气腹等,常常需外科紧急干预,一般穿孔超过4 h而未行内镜下夹闭处理的患者建议外科手术治疗。外科紧急干预一般为腹腔镜下回肠造口术或腹腔镜下结肠缝补术。
我们内镜中心近期对2例大肠ESD术后超24 h迟发性穿孔患者,做到及时诊断,及时治疗,使用内镜下钛夹夹闭法成功进行了穿孔修补,及时阻断严重气腹,腹腔感染及全身感染等严重并发症的发生,避免了外科手术,现报道如下:
一、病例资料
病例 1:冯 XX,住院号 0192600,女,75岁,因反复左下腹部隐痛3月行结肠镜检查发现乙状结肠一大小约20 mm侧向发育型息肉,于2016-12-08日入院,完善相关检查,排除手术禁忌症,于12月10日在静脉麻醉下行内镜下乙状结肠侧向发育型息肉ESD术。
术后患者安返病房,予卧床、禁食、静脉补液支持。术后28 h,患者突发左下腹部疼痛,进行性加重,查体见腹软,左下腹压痛,反跳痛,无发热恶寒。完善相关检显示:血常规,WBC 9.39×109/L,NEUT%79.8%; 降钙素原 <0.020 ng/L,CRP 15.22 mg/L。并请外科会诊,考虑存在腹膜炎(肠穿孔可能性大),但暂无明显全身感染征象,予放置肛管排气减压。并完善全腹部CT平扫,明确有无气腹。与患者及家属充分交代病情,术后30 h,全腹CT提示腹腔散在游离气体(图1)。
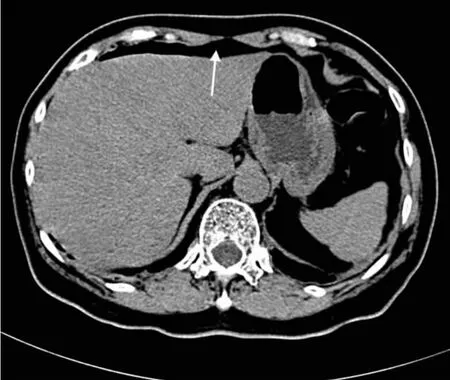
图1箭头所指为膈下游离气体
ESD术后迟发性穿孔诊断明确,外科急会诊建议紧急腹腔镜手术治疗,我们考虑患者腹膜炎局限,可以先行内镜下修补,急送内镜中心行肠穿孔修补术。内镜下示:肠镜进镜至距肛门30 cm降乙交界处,见ESD术口创面,部分止血夹固定在位,局部溃疡形成,周围黏膜充血水肿,整体观察欠佳(图 2)。

图2内镜下ESD术口创面
以带推送器的止血夹及钛夹数枚于可疑创面加固缝合,透视下,注入1:1碘佛醇80 mL后观察,动态观察10 min,未见造影剂外漏(图3),患者腹部出诊较前软,压痛、反跳痛无明显加重,考虑穿孔已封闭,退镜。

图3 X线观察,未见造影剂外漏
术后予禁食、留置胃管、肛管以胃肠减压、抗感染、善宁抑制消化液分泌,抑酸护胃,静脉补液支持等治疗,患者腹痛逐渐缓解,肛门可自主排气。2016-12-21复查腹平片提示腹腔游离气体已吸收(图4),血常规、ESR、CRP等炎症指标恢复正常,最终康复出院。

图4腹部平片提示,腹腔游离气体消失
病例 2:叶 XX,住院号 0110096,男 49岁,2016年 10月曾行结肠息肉摘除术,2017-10-18复查肠镜提示横结肠见大小约10 mm×20 mm侧向发育型息肉,结直肠散在多发息肉。并于2017-11-02日入住我科,入院第2天,排除手术禁忌症,在静脉麻醉下行横结肠侧向发育型息肉ESD术,大肠多发息肉APC术。
术后患者安返病房,予卧床、禁食、静脉补液支持。2017-11-04夜间,术后36 h,患者出现发热恶寒,体温38.5℃,腹部疼痛,查体见右上腹压痛反跳痛,未见明显腹肌紧张,CRP 92.48 mg/L,并请外科会诊,考虑局限性腹膜炎,完善腹部CT排查术后消化道穿孔。急诊腹部CT可见少量腹腔游离气体(图 5)。
术后37 h,ESD术后迟发性穿孔诊断明确,外科急会诊建议紧急腹腔镜手术治疗,我们考虑患者腹膜炎局限,可以先行内镜下修补,急送内镜中心行肠穿孔修补术。肠镜下示:横结肠近肝曲见ESD术后创面,数枚钛夹残留,其中一枚钛夹移位,移位钛夹旁见一大小约1 mm小孔(图6),予可旋转重复开闭组织夹夹闭创面,见小孔缝合(图6)。
后予禁食、留置胃管、肛管以胃肠减压、抗感染、静脉补液支持等治疗,患者腹痛逐渐缓解,体温降至正常,恢复饮食后可自行排便,查体未见腹部压痛反跳痛。2017-11-08术后4天,患者已无腹痛,进流食,复查血常规、ESR、CRP等炎症指标较前明显下降,最终康复出院。

图5箭头所指为膈下游离气体

图6穿孔部位夹闭(左图箭头所指为穿孔部位)
二、讨论
1.迟发性穿孔的危险因素与预防
穿孔是结肠ESD最严重的并发症之一,若未及时处理可出现严重气腹、腹膜后气肿及弥漫性腹膜炎。ESD术后迟发穿孔与多种因素相关。许松欣等[3]研究发现肿瘤类型(侧向发育型肿瘤)和肿瘤位置(右半结肠)、ESD手术的经验缺乏(<50例)、黏膜下注射生理盐水或甘油(不含透明质酸)与穿孔率高相关。也有研究认为[7]术中过度电凝、内镜夹脱落、外科手术吻合口处病灶、糖尿病及血液透析等是迟发穿孔的高危因素。病例1中患者肠镜下见局部溃疡形成,未除溃疡形成导致的穿孔;病例2中患者迟发穿孔即为钛夹移位导致。钛夹移位可能与患者术后活动,肠蠕动明显,或术后溃疡形成,钛夹移位脱落等多种因素相关。预防迟发穿孔方面,术者应在术中避免对创面的过度电凝,确保封闭创面内镜夹的固定,术后抽吸出多余的气、液体,避免刺激引起肠道蠕动;术后患者应卧床,禁食,限制活动,预防穿孔的发生。
2.迟发性穿孔的诊断与治疗
迟发穿孔治疗在于及早发现,并及时进行内镜下修补,若穿孔大,腹腔感染严重则需及时外科干预,紧急行腹腔镜下回肠造口术或腹腔镜下结肠缝补术[8]。当术后出现腹痛、腹部膨隆,皮下气肿,发热恶寒,查体见腹膜刺激征,应高度警惕迟发穿孔的发生,及时完善腹平片或全腹部CT明确诊断,腹平片或CT见膈下游离气体即可明确诊断穿孔。同时完善血常规、ESR、CRP等相关炎症指标,帮助判断感染炎症程度。迟发性穿孔有内镜下保守治疗成功的报道[9-12],但迟发性穿孔内镜下治疗的条件选择仍未形成共识。内镜下穿孔修补多以钛夹夹闭或钛夹夹闭加尼龙绳缝合[2]。以上2例迟发穿孔患者均在腹痛发生后2 h内完成全腹部CT检查明确诊断,考虑2例患者均为腹膜炎局限,感染程度轻,故治疗采取内镜保守治疗,并使用钛夹夹闭法成功修补穿孔。
穿孔修补术后需禁食、胃肠减压、卧床限制活动,抗感染,抑制消化液分泌,并结合补液营养支持等治疗。抗感染方面,抗生素需覆盖革兰氏阴性菌和厌氧菌。
3.迟发性穿孔修补术后预后评估
内镜修补术后,连续观察如体温下降,腹痛减轻,查体见腹部刺激征减轻,血常规白细胞计数下降及中性粒细胞分类降低,ESR、CRP等提示炎症指标下降,复查腹平片或CT提示腹腔游离气体吸收,即是病情好转及治疗成功的体现。迟发性穿孔虽有内镜下治疗成功的报道,但仍有内镜治疗失败的可能,需外科手术治疗,故术后病情变化评估尤为重要。
小结ESD术后迟发穿孔患者,应及时的诊断,及时治疗,若腹膜炎局限,感染轻的病例,行急诊内镜下修补仍是可行的,这能最大可能保留了消化道正常结构。目前迟发性穿孔内镜下治疗的条件选择仍未形成共识,仍需更多的实践与总结。
