内镜下黏膜切除术与高频电切术治疗消化道难治性息肉的疗效分析
2018-08-31刘利平
刘利平 王 莹 曹 鹏
消化道难治性息肉是所有向消化道腔突出且保守治疗无效的赘生物总称,是临床上的常见疾病[1-2]。随着经济的迅速发展以及饮食结构和生活习惯的改变,我国消化道难治性息肉发病率逐年升高[3-5]。消化道难治性息肉传统手术需要比较大的切口,创伤大、康复慢[6-7]。随着内镜治疗技术的迅猛发展,特别是内镜下高频切除术、内镜下黏膜切除术(Endoscopic mucosal resection,EMR)等技术的快速发展,使得难治性息肉切除不再是内镜下治疗的禁忌[8-9]。特别是内镜下黏膜切除术可以切除大的病灶,可为病理提供完整的组织样本[10]。本文具体比较分析了内镜下黏膜切除术与高频电切术治疗消化道难治性息肉的临床效果,现报道如下。
资料与方法
一、一般资料
选取2016年1月至2017年12月我院诊治的112例消化道难治性息肉患者。纳入标准:临床主要表现为腹痛、腹泻、大便异常或者腹部不适等表现;患者知情同意本研究;年龄20~80岁;术前内镜和影像学诊断为消化道息肉且在术中得到确诊;保守治疗无效;研究得到医院伦理委员会的批准。排除标准:合并严重心、肝、肾及内分泌疾病或免疫性疾病;妊娠与哺乳期妇女。按随机数字表法分为观察组和对照组,各56例。两组一般资料对比无显著差异(P>0.05),见表1。
二、治疗方法
1.对照组
给予内镜下高频电切术,确定病变范围后在病灶周围0.5 cm进行电凝切除。
2.观察组
给予内镜下黏膜切除术,将1:20 000肾上腺素液于病灶以及周围黏膜多点注射,使病灶充分抬起,采用圈套器沿黏膜下层将病灶整片切除,较大者可分次切除。在切除过程中,局部出血可喷洒去甲肾上腺素溶液止血,较大出血可以考虑钛夹止血。
两组术后均禁食、禁止剧烈活动,密切观察生命体征,并给于补液止血、抗感染、营养支持及对症处理。
三、观察指标
1.围手术指标
观察并记录两组手术时间、术中出血量、术后禁食时间、排便时间、住院时间。
2.并发症情况
观察并记录两组的术后14 d并发症的发生情况。
3.免疫功能测定
于术后1 d和术后14 d采集所有患者3~5 mL空腹静脉血,分离单个核细胞后进行CD3+淋巴细胞、CD3+CD8+淋巴细胞绝对值的测定,试剂单克隆抗体购于美国BD公司,按说明书进行操作。
四、统计方法
应用SPSS 21.00统计软件对研究数据进行处理。计量数据以±s表示,采用t检验;计数资料以%表示,采用χ2检验,P<0.05为差异具有统计学意义。
结 果
一、围手术指标对比
所有患者都顺利完成手术,两组手术时间、术中出血量间无显著差异(P>0.05)。观察组的术后禁食时间、排便时间、住院时间均显著少于对照组(P<0.05)。见表2。
二、免疫功能指标变化对比
两组术后14 d的外周血CD3+和CD3+CD8+淋巴细胞绝对值均显著高于术后1 d(P<0.05),且观察组亦显著高于对照组(P < 0.05),见表 3。
三、术后并发症发生情况对比
观察组术后并发症发生率为7.14%,显著低于对照组的26.78%(P <0.05),见表 4。
讨 论
息肉系指黏膜表面突出的一种赘生物,消化道息肉是指消化道黏膜局限性隆起病变,当前随着影像技术的进步尤其是超声技术的普及,越来越多的消化道息肉被发现[11]。息肉多为良性,但是随着随着病程的进展,恶变的几率随之增多,严重影响患者的身心健康[12-13]。
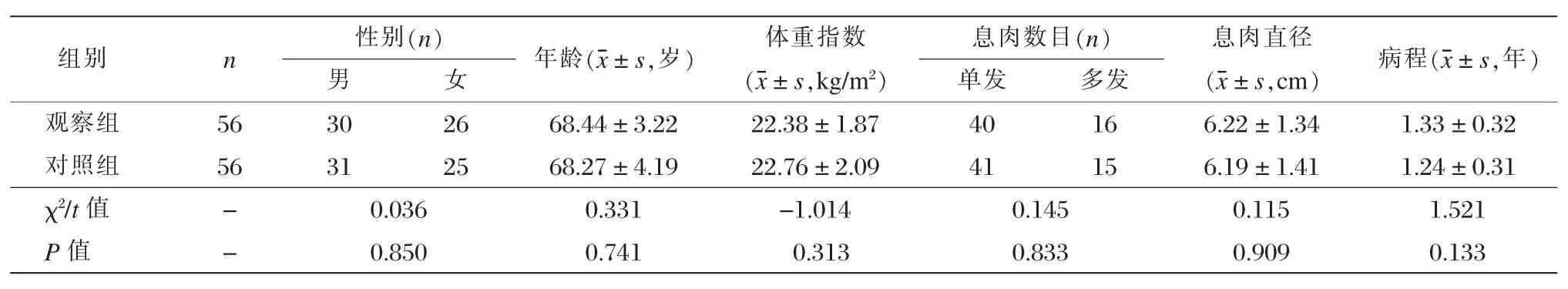
表1两组一般情况比较
表2两组围手术指标对比 ±s)
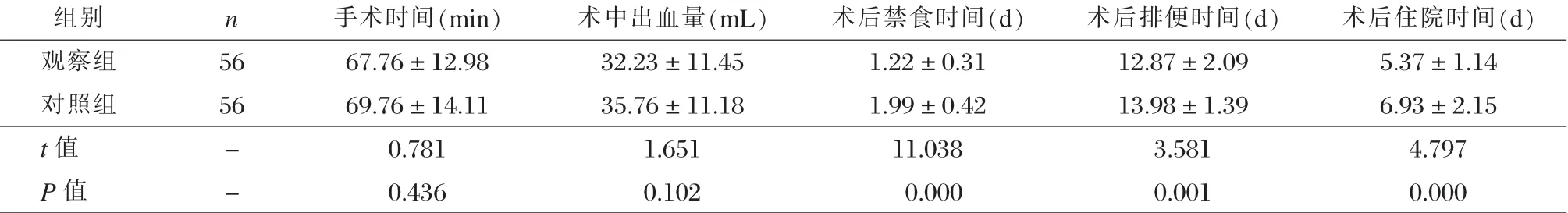
表2两组围手术指标对比 ±s)
组别 n 手术时间(min) 术中出血量(mL) 术后禁食时间(d) 术后排便时间(d) 术后住院时间(d)观察组 56 67.76±12.98 32.23±11.45 1.22±0.31 12.87±2.09 5.37±1.14对照组 56 69.76±14.11 35.76±11.18 1.99±0.42 13.98±1.39 6.93±2.15 t值 - 0.781 1.651 11.038 3.581 4.797 P值 - 0.436 0.102 0.000 0.001 0.000
表3两组术后不同时间点免疫功能指标变化对比 (±s,个/μL)
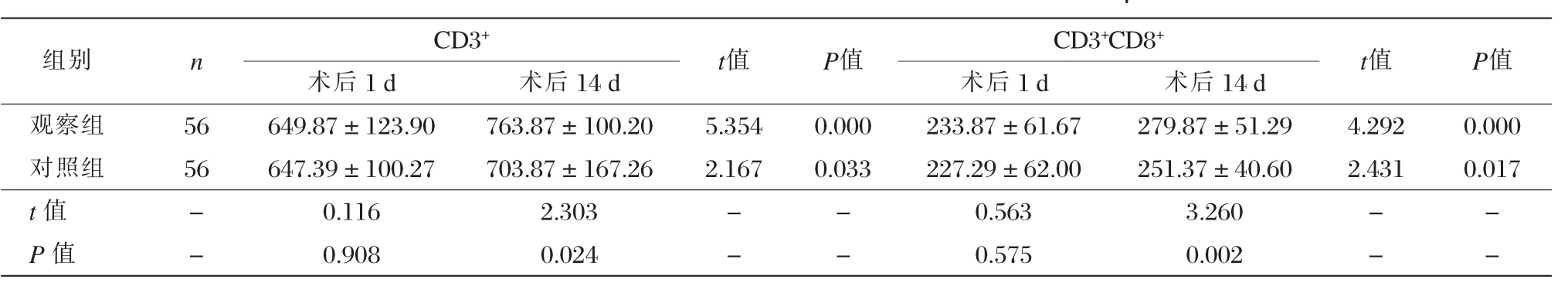
表3两组术后不同时间点免疫功能指标变化对比 (±s,个/μL)
组别 n CD3+t值 P值 CD3+CD8+t值 P值术后1 d 术后14 d 术后1 d 术后14 d观察组 56 649.87±123.90 763.87±100.20 5.354 0.000 233.87±61.67 279.87±51.29 4.292 0.000对照组 56 647.39±100.27 703.87±167.26 2.167 0.033 227.29±62.00 251.37±40.60 2.431 0.017 t值 - 0.116 2.303 - - 0.563 3.260 - -P值 - 0.908 0.024 - - 0.575 0.002 - -

表4两组术后并发症发生情况对比 [n(%)]
消化道难治性息肉的发现主要依赖于传统内镜、染色、共聚焦激光显微内镜、固有荧光激发内镜等,其中内镜对消化道黏膜的检查直观而确切,对于可疑病变还可以直接取活检进行病理学检查,当前应用比较普遍[14-15]。传统外科手术往往是经腹对息肉部位进行切除,其操作对机体创伤大,不易被患者所接受[16]。特别是开腹手术时伤口往往较深较长,可使得消化道正常解剖结构被破坏,术后腹腔易出现肠梗阻、粘连等并发症[17]。内镜下高频电切术的应用有很好的成功率,但是对于病变基底直径比较大的病灶常易穿孔,切除后的标本支离破碎,并且病灶残遗较多[18]。内镜下黏膜切除术可将黏膜病变直接与肌层分离然后整块切除,也能够较完整的切除更多消化系统病变[19]。本研究显示所有患者都顺利完成手术,两组手术时间、术中出血量间无显著差异,观察组的术后禁食时间、排便时间、住院时间均显著少于对照组,也表明内镜下黏膜切除术的应用能促进患者康复。
随着人们对消化道息肉特性研究的进一步深入,逐渐认识到消化道息肉与消化道恶性肿瘤的发生发展存在密切的关系。目前随着内镜操作方法和经验的不断积累,促进了内镜在治疗消化道息肉方面的普及[20]。本研究显示观察组术后并发症发生率为7.14%,显著低于对照组的26.78%。不过在手术操作时应避免动作粗暴,注意解剖层次,避免损伤邻近的腹腔内和腹膜后脏器,减少并发症的发生。
当前随着对消化道病理生理的进一步深入研究,发现消化道具有复杂和极为重要的功能,特别是免疫调节上存在重要价值[21]。研究显示手术创伤后机体产生可逆性的特异性免疫功能改变,主要表现为细胞免疫功能损害,其中外周血CD3+和CD3+CD8+淋巴细胞绝对值更能反映宿主细胞免疫状态[22]。本研究显示观察组与对照组术后14 d的外周血CD3+和CD3+CD8+淋巴细胞绝对值均显著高于术后1 d(P<0.05),且观察组亦显著高于对照组(P<0.05),表明内镜下黏膜切除术能促进患者免疫功能的恢复。
总之,相对于高频电切术,内镜下黏膜切除术治疗消化道难治性息肉能减少对于患者的创伤,促进患者免疫功能的恢复,减少术后并发症的发生,从而促进患者康复。
