腹腔镜下胃癌根治术治疗早期胃癌对患者免疫功能、凝血功能的影响
2018-08-31魏俊
魏 俊
胃癌是发生于胃黏膜上皮的一种恶性肿瘤。在我国,胃癌发病率在各种恶性肿瘤中高居首位。胃癌在临床中分为早期、进展期及晚期,因胃癌病情发展快,可通过血行转移、直接浸润、淋巴转移及腹膜种植转移进行扩散,因此对早期胃癌患者及时采取有效治疗措施有利于提高患者生存率。据相关资料表明[1],胃癌患者的免疫功能将会受到抑制,且经手术治疗后,受应激反应与手术创伤的影响,其免疫功能将会进一步被抑制,故胃癌患者术后免疫功能的状态对胃癌的转移与复发有着直接的影响。此外,应激反应与手术创伤能增加血栓激活产物,改变机体凝血状态,最终引发静脉血栓[2]。当前,临床常采用传统开腹术与腹腔镜下胃癌根治术治疗胃癌,但此类手术治疗胃癌对其凝血功能、机体应激反应及免疫细胞的水平的影响研究还较少。故我院针对2014年5月至2017年5月收治的胃癌患者行传统开腹术与腹腔镜下胃癌根治术进行治疗,旨在研究腹腔镜下胃癌根治术对患者免疫细胞水平及凝血功能的影响,以此为临床研究提供相关的可行性依据,现将结果报道如下。
资料与方法
一、一般资料
本次研究对象纳入2014年5月至2017年5月我院收治的胃癌患者300例,采用随机数字表法将其分为治疗组和对照组,各150例。治疗组男性76例,女性74例,年龄41~78岁,平均(61.7±3.5)岁;肿瘤直径 1.0~6.0 cm,平均(3.2±1.5)cm;肿瘤部位:胃底贲门29例,胃体52例,胃窦 69例;肿瘤分期:Ⅰ期32例,Ⅱ期40例,Ⅲ期55例,Ⅳ期23例。对照组男性 79例,女性71例,年龄40~80岁,平均(63.4±4.6)岁;肿瘤直径 1.0~7.0 cm,平均(3.5±1.4)cm;肿瘤部位:胃底贲门28例,胃体49例,胃窦73例;肿瘤分期:Ⅰ期31例,Ⅱ期43例,Ⅲ期58例,Ⅳ期18例。两组性别、年龄、肿瘤直径、肿瘤部位及肿瘤分期等一般资料比较均无明显差异(P>0.05),具有分组研究价值。
二、入选标准
1.纳入标准
①经病理学检查确诊为胃癌患者;②血常规及重要脏器功能正常者;③无手术相关禁忌症者;④经影像学检查未见肺、肝等部位胃癌转移者;⑤本次研究经我院医学伦理委员会审核批准,患者自愿参加并签署同意书。
2.排除标准
①有严重肝肾及心肺功能不全者;②近期使用影响凝血功能的相关药物者;③有静脉栓塞疾病史及血液高凝疾病史者;④临床资料不全及治疗依从性差者。
三、手术方法
1.对照组
行传统开腹手术治疗,具体操作方法如下[3]:①给予患者全身麻醉后,行气管插管,为患者开腹并充分暴露病变部位,观察肿瘤的浸润深度、大小、病理类型及有无淋巴结肿大,对患者淋巴结进行清扫,并对其清扫数量进行记录;②黏膜内小胃癌与黏膜下癌行D1术切除肿瘤,但切除胃体部或以上部位的肿瘤时,应适当扩大切除范围,防止出现漏诊、漏切等情况发生;③多发癌及癌症肿瘤大小为2~4 cm时行D2术切除肿瘤;肿瘤切除后,对腹腔进行逐层缝合,并将抗菌类药物涂抹于切口处,以避免切口感染。手术完成后,将切除标本送检,以检验肿瘤的病理类型。
2.治疗组
行腹腔镜下胃癌根治术,具体操作方法[4]如下:①在患者两侧锁骨中线的肋缘下5~6 cm处及左腋前方与肚脐平行的肋缘下2~3 cm分别做5 mm与10 mm的弧形切口,便于腹腔镜进行操作,同时将与切口大小、长度相等的套管针放置于切口内;②为患者行CO2人工气腹,并将压力调至12~14 mmHg,再通过腹腔镜观察患者肿瘤病变部位及肿瘤在体内的转移情况,以此确定切除肿瘤的手术方式及切除步骤;③清扫患者肿瘤附近的淋巴结并做胃癌根治术,将患者十二指肠悬韧带20 cm处的系膜与空肠切断,再顺空肠远端将吻合器置入,并通过食管与结肠做侧端吻合,将食管腹膜与空肠浆膜层缝合,再将吻合口下方位置的空肠和食管空肠结合处的空肠近端和远端空肠的断裂端吻合,并重建消化系统,将引流管放置于内,封闭腹腔,并查看创面是否有活动性出血、吻合位置的吻合情况,并将切除标本送检。
四、观察指标
①采用流式细胞仪检测患者免疫细胞CD4+、CD8+及CD4+/CD8+水平;②采用凝血功能自动检测仪检测两组患者凝血功能,包括INR(国家标准化比值)、PT(凝血酶原时间)、FIB(纤维蛋白原)、APTT(活化部分凝血酶原时间);③记录两组患者手术时间、术中出血量及并发症发生情况;④术后随访2年,记录两组患者术后生存率。
五、统计方法
采用SPSS19.0统计学软件对研究数据进行处理。计数资料以%表示,采用χ2检验,计量资料以x±s表示,采用t检验。P<0.05为表示差异具有统计学意义。
结 果
一、两组手术前后免疫细胞水平比较
术前,两组免疫细胞 CD4+、CD8+、CD4+/CD8+水平比较均无统计学差异(P > 0.05);术后,两组免疫细胞 CD4+、CD8+、CD4+/CD8+水平均有所下降,差异均有统计学意义 (P<0.001),但治疗组免疫细胞 CD4+、CD8+、CD4+/CD8+水平显著高于对照组,差异均有统计学意义(P<0.001),见表1。
二、两组手术前后凝血功能比较
术前,两组 INR、PT、FIB、APTT比较无统计学差异(P>0.05)。术后,两组INR、PT、APTT与术前比较均无统计学差异(P>0.05);但两组FIB均明显上升,且观察组明显高于对照组,差异均具有统计学意义(P<0.001)。见表2。
三、两组手术时间、术中出血量及并发症比较
治疗组手术时间、术中出血量较均明显少于对照组,差异有统计学意义 (P<0.001)。治疗组术后出现切口感染2例,肺部感染3例,发热4例;对照组术后出现切口感染10例,肺部感染9例,发热13例。治疗组并发症发生率为6.00%,显著少于对照组的21.33%(P<0.001)。见表3。
四、两组术后生存率比较
术后随访2年,治疗组6个月、1年、2年生存率分别为98.67%、95.33%、72.67%,对照组6个月、1年、2年生存率分别为97.33%、94.00%、70.00%。两组6个月、1年、2年生存率比较,差异均无统计学意义(P>0.05),见表4。
讨 论
胃癌是临床常见病之一,好发于>50岁以上人群,但随人们饮食结构及生活方式的改变,胃癌发病率逐年上升且呈年轻化的发展趋势,严重威胁着患者的生命健康[5]。当前,临床治疗早期胃癌多采取胃癌根治术,早期行胃癌根治术可有效延长患者生命,改善患者生活质量,但因该术式为有创治疗方式,对患者凝血功能及免疫细胞水平会造成不同程度的影响[6]。故及时找出手术创伤小,术后恢复快,对凝血功能与免疫细胞水平影响较小,术后并发症少的手术治疗方式是当前临床医务工作者亟待解决的问题。
表1两组手术前后免疫细胞水平比较 ±s)

表1两组手术前后免疫细胞水平比较 ±s)
注:*与术前比较,P<0.001
组别 n CD4+(%) CD8+(%) CD4+/CD8+术前 术后 术前 术后 术前 术后治疗组 150 43.46±3.17 30.15±2.34* 27.81±2.05 25.08±3.92* 1.56±0.21 1.20±0.15*对照组 150 43.28±3.09 23.41±2.55* 27.76±3.96 22.84±3.79* 1.56±0.18 1.02±0.17*t值 - 0.498 23.851 0.137 5.031 0.000 9.724 P值 - 0.619 0.000 0.891 0.000 1.000 0.000
表2两组手术前后凝血功能比较 (±s)

表2两组手术前后凝血功能比较 (±s)
注:*与术前比较,P<0.001
组别 n INR(%) PT(s) FIB(g/L) APTT(s)术前 术后 术前 术后 术前 术后 术前 术后治疗组 150 1.08±0.20 1.06±0.14 12.63±0.71 12.60±0.72 2.57±0.50 4.52±1.06* 29.58±4.35 29.39±4.50对照组 150 1.08±0.19 1.04±0.17 12.79±0.68 12.54±0.67 2.71±0.48 3.46±1.09* 29.37±4.01 29.28±4.15 t值 - 0.000 1.112 1.993 1.370 0.707 6.122 0.435 0.221 P值 - 1.000 0.267 0.057 0.172 0.480 0.000 0.664 0.826
近年来,随着医疗技术的发展,腹腔镜手术被逐渐广泛应用于胃癌根治术中,并取得了满意效果。该术式为一种微创方法,较传统开腹手术相比,腹腔镜手术具有手术时间短、出血量少、切口小、术后恢复快等优点,因而易被患者接受,并深受临床工作者青睐[7]。本研究结果显示,治疗组行腹腔镜手术治疗的手术时间、术中出血量及术后并发症明显少于行传统开腹手术治疗的对照组,提示对早期胃癌患者行腹腔镜下胃癌根治术,可缩短手术时间、减少术中出血量,且术后并发症较少。虽腹腔镜手术优点较多,但气腹、穿刺等操作过程中仍会对患者造成一定的创伤,在一定程度上会引起患者的应激反应,对患者免疫细胞水平造成影响[8]。相关资料显示[9],应激反应与手术创伤会增加血栓激活产物,改变人体高凝血状态,以此诱发静脉血栓。我国有学者指出[10],胃癌患者因手术创伤对免疫功能进行抑制,其会加大肿瘤的转移与复发。故临床工作者应将工作重点放在如何减少患者术后的机体应激反应、凝血功能及免疫细胞水平的影响。
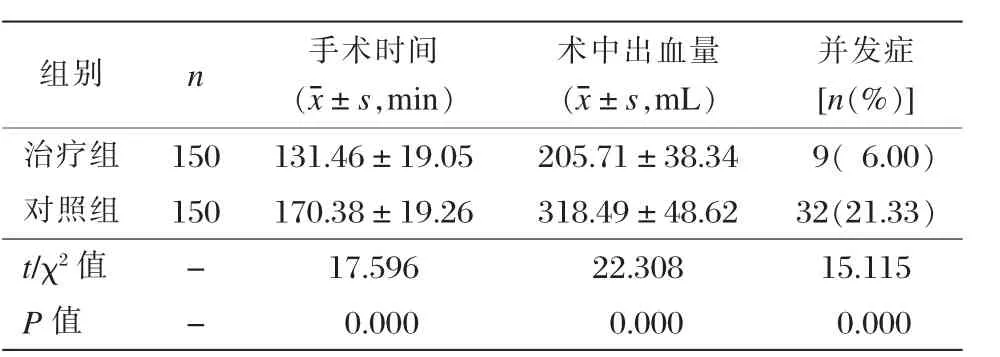
表3两组手术时间、术中出血量及并发症比较

表4两组术后生存率比较 [n(%)]
相关临床研究表明,胃癌患者发病后,其免疫细胞水平受到一定程度的抑制,较之健康人群,胃癌患者的免疫细胞CD4+、CD4+/CD8+水平降低、CD8+水平上升[11]。 而术后,其抑制效果虽有所下降,但因炎性因子失衡,亦会对免疫细胞水平产生进一步的抑制作用,对患者预后造成严重的影响[12]。故降低术后免疫细胞抑制是有效治疗胃癌的重要环节之一。本次研究结果显示,治疗组免疫细胞 CD4+、CD8+、CD4+/CD8+水平较对照组下降幅度更小,说明腹腔镜下胃癌根治术对患者免疫细胞水平的影响更小。
此外,手术治疗胃癌对患者凝血功能的影响是当前临床工作者另需注意的关键性问题。胃癌患者在麻醉、术后应激反应及手术创伤等诸多因素的影响下,血栓激活产物中的凝血酶-抗凝血酶复合物、纤维蛋白与凝血酶片段等均将增加,使患者处于高凝状态,进一步加大血栓的发生率,对手术造成严重的影响[13]。本次研究结果显示,两组患者INR、PT、APTT较术前无显著差异,但治疗组FIB较对照组显著上升,说明两组手术均会使患者处于高凝状态,但较传统开腹术,腹腔镜下胃癌根治术更为明显,故医务工作者应积极做好防血栓的工作。但对术后患者生存率方面,两组手术方式均对其无较大影响。本次研究结果显示,术后经随访2年,治疗组6个月、1年、2年生存率(98.67%、95.33%、72.67%)与对照组(97.33%、94.00%、70.00%)比较无显著差异,说明两组手术方式治疗胃癌均对患者的生存率无明显影响。
由此可见,对胃癌患者行腹腔镜下胃癌根治术较传统开腹手术相比对患者免疫功能影响较小,且具有手术时间短、术中出血量少、术后并发症少等优势,但术中易导致患者血液出现高凝状态,因此做好防治血栓工作至关重要。
