n-3/n-6长链多不饱和脂肪酸对大菱鲆幼鱼脂肪沉积、脂肪吸收及代谢相关酶活性和血清生化指标的影响*
2018-08-31韩秀杰王际英李宝山李学丽郝甜甜张利民
谭 青 韩秀杰 王际英 李宝山 李学丽 郝甜甜 张利民
n-3/n-6长链多不饱和脂肪酸对大菱鲆幼鱼脂肪沉积、脂肪吸收及代谢相关酶活性和血清生化指标的影响*
谭 青1,2韩秀杰1,2王际英1李宝山1李学丽1,2郝甜甜1张利民1①
(1. 山东省海洋资源与环境研究院 山东省海洋生态修复重点实验室 烟台 264006; 2. 上海海洋大学水产与生命学院 上海 201306)
为探讨饲料中不同n-3/n-6长链多不饱和脂肪酸(LC-PUFA)对大菱鲆()幼鱼生长性能及饲料利用、体组成和消化酶的影响,配制了6种不同n-3/n-6 LC-PUFA比值(29.54,D1组;23.04, D2组;18.97,D3组;9.06,D4组;6.86,D5组;3.87,D6组)的实验饲料。以大菱鲆幼鱼[(12.18±0.01) g]为研究对象, 在循环水养殖系统中开展了为期56 d的养殖实验。结果显示,n-3/n-6 LC-PUFA对大菱鲆幼鱼的成活率(SR)无显著影响(>0.05);增重率(WGR)随着n-3/n-6 LC-PUFA的降低呈先上升后下降趋势,D6组显著低于其他各组(<0.05);脂肪沉积率随着饲料中n-3/n-6 LC-PUFA的降低呈下降趋势,且D6组达到最小值,为14.80,显著低于其他各组(<0.05)。随着饲料中的变化,胰蛋白酶的活性呈先增强后减弱的趋势,且在D4组时达到最大值;脂肪酶活性呈上升趋势。随着饲料中n-3/n-6 LC-PUFA的变化, 脂肪酸合成酶活性呈先上升后下降的趋势,最高值为D4组,显著高于其他各组(0.05);葡萄糖-6-磷酸脱氢酶的酶活呈先上升后下降的趋势,D3组为最大值,显著高于其他各组(0.05)。随着饲料中n-3/n-6 LC-PUFA的降低,谷草转氨酶呈先上升后下降的趋势;总蛋白、白蛋白和高密度脂蛋白胆固醇均随着饲料n-3/n-6 LC-PUFA的变化呈先上升后下降的趋势,均在D5组时达到最大值。研究表明,饲料中n-3/n-6 LC-PUFA的比例降低会导致大菱鲆幼鱼的脂肪沉积率降低。
大菱鲆;n-3/n-6 LC-PUFA;脂肪沉积;消化酶;血清生化指标
饲料脂肪不仅是养殖动物重要的能量来源,还能为机体提供必需脂肪酸(Essential fatty acid, EFAs)、磷脂、固醇类和脂溶性维生素以维持生物膜结构和生理功能(Watanabe, 1982; Sargent, 2002)。
动物机体内脂肪来源主要有体内合成和饲料摄入。猪体内脂肪主要来源于脂肪酸的合成并且脂肪组织是合成的主要部位;家禽类中鸡脂肪合成主要部位为肝脏,而鸭为脂肪组织(周长海等, 2006);鱼类脂肪合成的主要场所为肝脏,饲料中脂肪直接吸收、肝脏中糖类转化合成以及饲料中过量的蛋白质是鱼类脂肪的主要来源(王爱民, 2011)。葡萄糖代谢会产生甘油和脂肪酸,并通过一系列酶促反应合成甘油三酯(TG),所有能够影响酶的活性或含量等酶促反应的因素都会影响脂肪的生物合成(马晶晶, 2008)。脂肪的分解代谢通常是在激素敏感脂酶的作用下,将脂肪分解成甘油和脂肪酸,之后释放入血液,供组织氧化利用。肌肉与肝脏组织可以吸收和代谢游离脂肪酸(Free fatty acid, FFA),产生能量供机体利用,TG 也能被肝脏转化成为脂肪酸,并沉积在脂肪组织中(王镜岩等, 2002)。
在水产品养殖过程中,饲料中脂类是能量的主要来源,对机体的脂肪沉积、代谢及消化都有很大的影响作用。而脂类中脂肪酸含量的不同会对脂肪的代谢及消化产生一定的影响,尤其是在海水鱼的养殖过程中,长链不饱和脂肪酸(LC-PUFA)的含量变化也会造成一定的影响。大菱鲆()是典型的底栖性冷水鱼类,原产于欧洲的大西洋北部海域。1992年从英国引进,成为我国海水养殖中的一个重要经济养殖种类。目前,尚无n-3/n-6 LC-PUFA对大菱鲆脂肪代谢及脂肪沉积的影响。本研究配制不同比例n-3/n-6 LC-PUFA饲料,探究其对大菱鲆脂肪代谢及脂肪沉积的影响,为饲料中适宜的n-3/n-6 LC-PUFA提供理论依据。
1 材料与方法
1.1 实验设计与饲料制作
以鱼粉、大豆浓缩蛋白为主要蛋白源,鱼油为主要脂肪源配制基础饲料,在基础饲料中分别添加质量分数为0、0.5、1.5、4.5、6.5、12.5 g/kg的花生四烯酸油脂,配成n-3/n-6 LC-PUFA为29.54(D1 组)、23.04(D2 组)、18.97(D3 组)、9.06(D4 组)、6.86(D5 组)、3.87(D6组)6种等氮等能实验饲料。饲料配方、营养组成见表1,鱼油脂肪酸的组成见表2。
鱼粉等饲料原料粉碎过80目筛,按配方从小到大逐级定量均匀混合,将鱼油和花生四烯酸油脂用超声波震荡仪充分混匀后加入提前混匀的粉料,加适量水混匀。经螺旋挤压机加工成直径为3 mm左右的饲料颗粒,60℃烘干后,–20℃冰箱保存备用。
1.2 饲养管理及样品采集
大菱鲆幼鱼于2015年11月购自山东蓬莱市宗哲养殖有限公司,实验地点为山东省海洋资源与环境研究院循环水养殖实验室,实验周期为56 d。实验开始前,大菱鲆幼鱼投喂商品饲料,暂养14 d并进行分组,每组随机挑选体质健壮、体格大小一致的大菱鲆幼鱼35尾养殖于高为80 cm、直径为70 cm、水深为50 cm的圆柱塑料养殖桶内,共18组,每3组使用同一种饲料。每天定时进行饱食投喂2次,投喂后0.5 h清理残饵并记录残饵量。实验期间,水中溶解氧>5 mg/L,水温为(17±1)℃,盐度为28~32,pH为7.6~8.2,氨氮和亚硝酸≤0.1 mg/L。
实验结束后,停食24 h。记录每桶鱼的数量并称重,计算成活率、增重率,随机选取5尾实验鱼用于全鱼体组成常规分析。剩下10尾进行尾静脉取血,4℃离心分离(4000 r/m, 10 min),取上清液,保存于–80℃冰箱中,用于测定血清生理生化指标;取血后的实验鱼分离肝脏和肠道,用于脂肪酶、胰蛋白酶、脂肪酸合成酶及酰基辅酶A氧化酶的测定。
1.3 样品分析
实验饲料常规成分分析均参照AOAC(2002)方法进行。
谷草转氨酶(Aspertate aminotransferase, AST)、总蛋白(Total protein, TP)、白蛋白(Albumin, ALB)、碱性磷酸酶(Alkaline phosphate, ALP)、总胆固醇(Cholesterol,TCHO)、甘油三酯(Triacyglycerol, TG)、高密度脂蛋白胆固醇(High density lipoprotein cholesterol, HDL-C)、低密度脂蛋白胆固醇(Low density lipoprotein cholesterol, LDL-C)含量的测定均采用日立自动生化分析仪(7020型,Hitachi,日本);葡萄糖-6-磷酸脱氢酶(Glucose 6-phosphatedehydrogenase, G6PD)、脂肪酸合成酶(Fatty acid synthetase, FAS)、酰基辅酶A氧化酶(Acyl-CoA oxidase, ACO)购自上海江莱生物科技有限公司;胰蛋白酶(Trypsin)和脂肪酶(Lipase)均购自南京建成生物工程研究所。
1.4 测定指标
成活率(Survival rate, SR, %)=S/S× 100;
增重率(Weight gain rate, WGR, %) = (W–W)/W× 100;
表1 饲料配方及营养组成
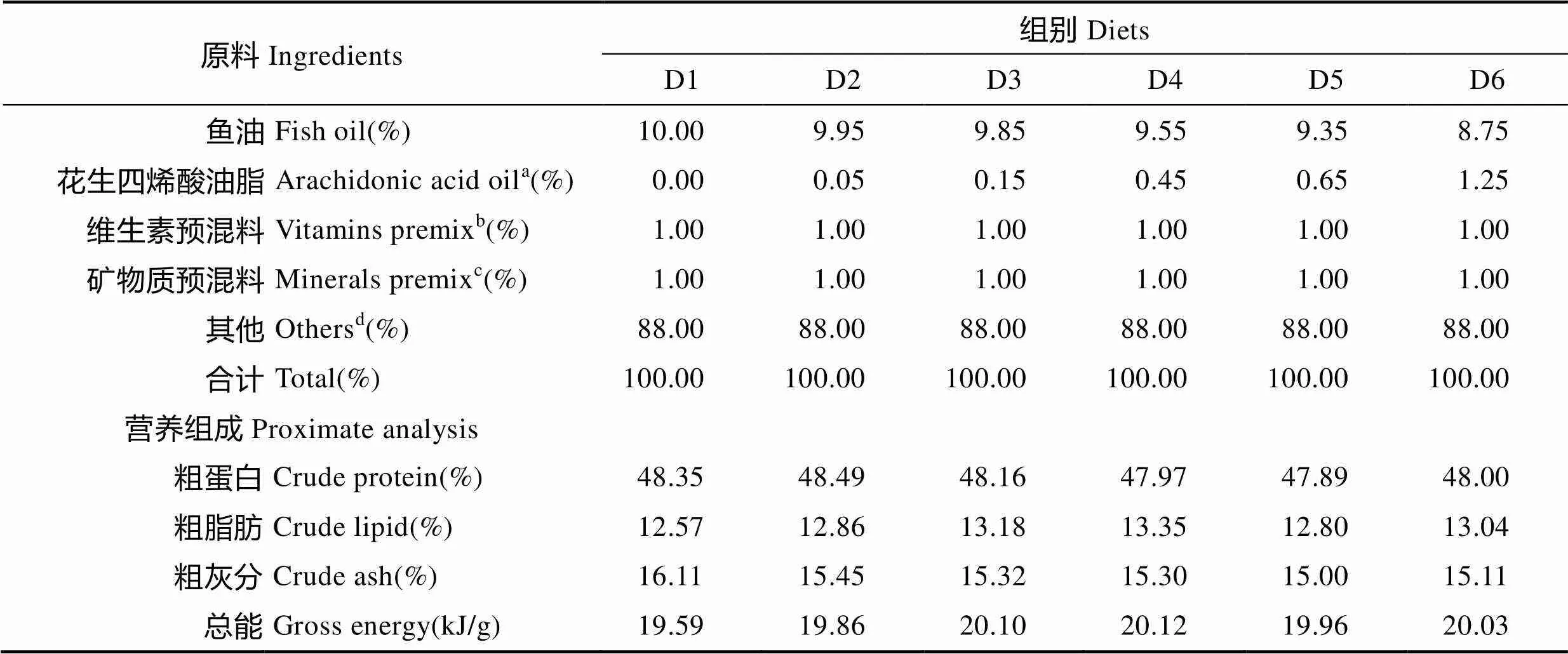
Tab.1 Composition and nutrient levels of the experimental diets
a:花生四烯酸油脂购自嘉必优生物工程(武汉)有限公司,成分为51.69% ARA;6.56% C16:0;5.59% C18:0;5.62% C18:1n-9;9.50% C18:2n-6;8.02% C24:0 b:维生素预混料(mg/kg饲料):维生素A 38.0 mg;维生素D313.2 mg;维生素K310.0 mg;硫胺素115.0 mg;核黄素380.0 mg;盐酸吡哆醇88.0 mg;泛酸 368.0 mg;烟酸1030.0 mg;生物素10.0 mg;叶酸20.0 mg;维生素B121.3 mg;肌醇 4000.0 mg;抗坏血酸500.0 mg c:矿物质预混料(mg/kg饲料):NaCl 100.0 mg;KCl 3020.5 mg;KAl(SO4)211.3 mg;ZnSO4·7H2O 363.0 mg;CuSO4·5H2O 8.0 mg;MgSO4·7H2O 3568.0 mg;MnSO4·4H2O 65.1 mg;Na2SeO32.3 mg;CoCl228.0 mg;KI 7.5 mg;NaF 4.0 mg;NaH2PO4·2H2O 25558.0 mg;Ca-lactate 15978.0 mg;C6H5O7Fe·5H2O 1523.0 mg d:其他:鱼粉45%;大豆浓缩蛋白25%;α-淀粉12%;磷酸二氢钙0.5%;抗氧化剂0.05%;氯化胆碱0.5%;羧甲基纤维素钠4.95%
a: Arachidonic acid oil were purchased from CABIO Bioengineering (Wuhan) Co.,Ltd, the concentration of 51.69 % ARA, 6.56 % C16:0, 5.59 % C18:0, 5.62 % C18:1n-9,9.50 % C18:2n-6, 8.02 % C24:0 b: Vitamin mixture (mg/kg diet): Retinol acetate 38.0 mg; Cholecalciferol 13.2 mg; Vitamin K310.0 mg; Thiamin 115.0 mg; Riboflavin 380.0 mg; Pyridoxine HCl 88.0 mg; Pantothenic acid 368.0 mg; Niacin acid 1030.0 mg; Biotin 10.0 mg; Folic acid 20.0 mg; Vitamin B121.3 mg; Inositol 4000.0 mg; Ascorbic acid 500.0 mg c: Mineral mixture (mg/kg diet): NaCl 100.0 mg; KCl, 3020.5 mg; KAl(SO4)2, 11.3 mg; ZnSO4·7H2O, 363.0 mg; CuSO4·5H2O 8.0 mg; MgSO4·7H2O 3568.0 mg; MnSO4·4H2O 65.1 mg; Na2SeO32.3 mg; CoCl228.0 mg; KI 7.5mg; NaF, 4.0 mg; NaH2PO4·2H2O, 25558.0 mg; Ca-lactate,15978.0 mg; C6H5O7Fe·5H2O, 1523.0 mg d: Others: Fish meal 45%; Soy protein concentrate 25%; α-starch 12%, Ca(H2PO4)20.5%; Antioxidant 0.05%; Choline chloride 0.5%; CMC 4.95%
表2 鱼油脂肪酸的组成(总脂肪酸)
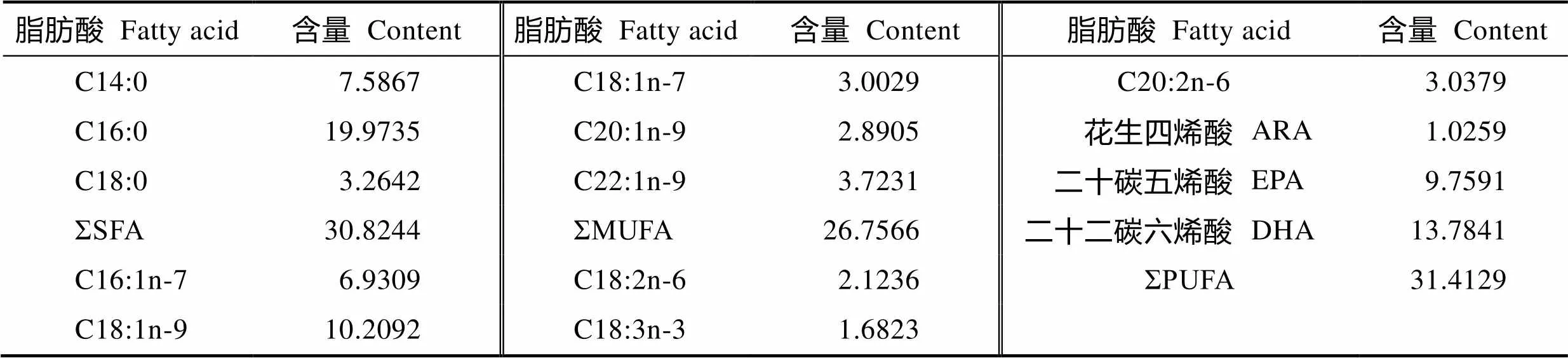
Tab.2 Fatty acid composition of fish oil (Total fatty acid) (%)
脂肪沉积效率(Lipid deposition rate, LR, %) = (W×L–W×L)/L
式中,S为养殖实验开始前实验鱼数量,S为养殖实验结束后实验鱼数量,W为实验初始鱼体重(g),W为实验结束时鱼体重(g),L为实验饲料中粗脂肪的含量,L为实验开始前鱼体中粗脂肪的含量,L为实验结束后鱼体中粗脂肪的含量。
1.5 数据统计分析
采用SPSS17.0软件进行单因素方差分析(One-way ANOVA),差异显著时(<0.05)采用Duncan’s检验进行多重比较分析。统计结果以平均值±标准误(Mean ± SE)表示。
2 结果
2.1 n-3/n-6 LC-PUFA对大菱鲆幼鱼成活率、增重率、脂肪沉积效率影响
n-3/n-6 LC-PUFA对大菱鲆幼鱼生长性能及脂肪沉积率见表3。从表3可以看出,n-3/n-6 LC-PUFA对大菱鲆幼鱼的SR无显著影响(>0.05);WGR随着n-3/n-6 LC-PUFA的降低呈先上升后下降趋势,D6组显著低于其他各组(<0.05);LR随着饲料中n-3/n-6 LC-PUFA的变化呈下降趋势,且D6组达到最小值,为14.80,显著低于其他各组(<0.05)。
2.2 n-3/n-6 LC-PUFA对大菱鲆幼脂肪代谢酶的影响
不同 n-3/n-6 LC-PUFA对大菱鲆幼鱼脂肪代谢酶的影响见表4。从表4可以看出,脂肪酸合成酶活性随着饲料中n-3/n-6 LC-PUFA的变化呈先上升后下降的趋势,D4组达到最大值,显著高于其他各组(0.05),而D1、D2、D3组无显著差异(0.05),D6组显著低于其他各组(0.05)。随着饲料中n-3/n-6 LC-PUFA的变化,葡萄糖-6-磷酸脱氢酶的酶活性呈先上升后下降的趋势,在D3组达到最大值,显著高于其他各组(0.05),在D1、D2组之间及D5、D6组之间无显著性差异(0.05)。随着饲料中n-3/n-6 LC-PUFA的变化,酰基辅酶A氧化酶呈先增加后下降的趋势,且在D5组达到最大值,显著高于其他各组(0.05)。
2.3 n-3/n-6 LC-PUFA对大菱鲆幼鱼消化酶的影响
不同 n-3/n-6 LC-PUFA对大菱鲆幼鱼消化酶的影响见表5。从表5可以看出,随着饲料中n-3/n-6 LC-PUFA的变化,胰蛋白酶的活性呈先增强后减弱的趋势,在D4组时达最大值,与D5组无显著差异(0.05),D6组为最小值,与D2组无显著差异(0.05),与其他各组之间均呈显著性差异(0.05)。随着饲料中n-3/n-6 LC-PUFA的变化,脂肪酶活性呈上升趋势,D1和D2组之间无显著差异(0.05),其他各组之间均呈显著性差异(0.05)。
2.4 n-3/n-6 LC-PUFA对大菱鲆幼鱼血清生化指标的影响
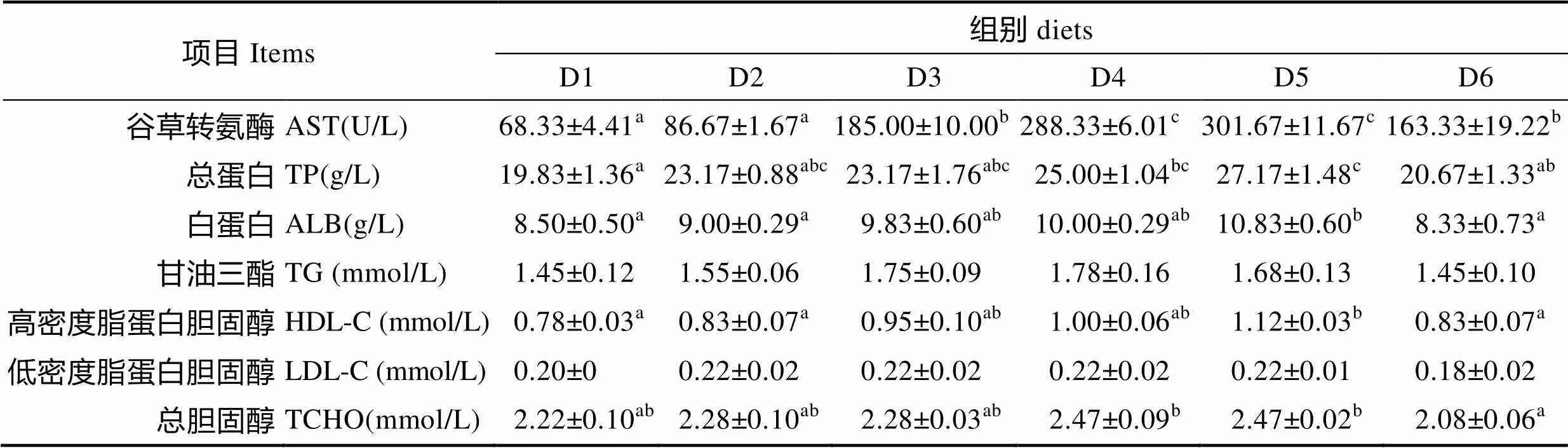
不同n-3/n-6 LC-PUFA对大菱鲆幼鱼血清生化指标的影响见表6。从表6可以看出,随着饲料中n-3/ n-6 LC-PUFA的变化,谷草转氨酶呈先上升后下降的趋势,D5组达到最大值,为301.67,与D4组无显著差异(0.05),显著高于其他各组(0.05),D1组为最小值,与D2组无显著差异(0.05)。总蛋白、白蛋白和高密度脂蛋白胆固醇均随着饲料的变化呈先上升后下降的趋势,均在D5组时达到最大值。
表3 n-3/n-6 LC-PUFA对大菱鲆幼鱼生长性能及脂肪沉积效率的影响
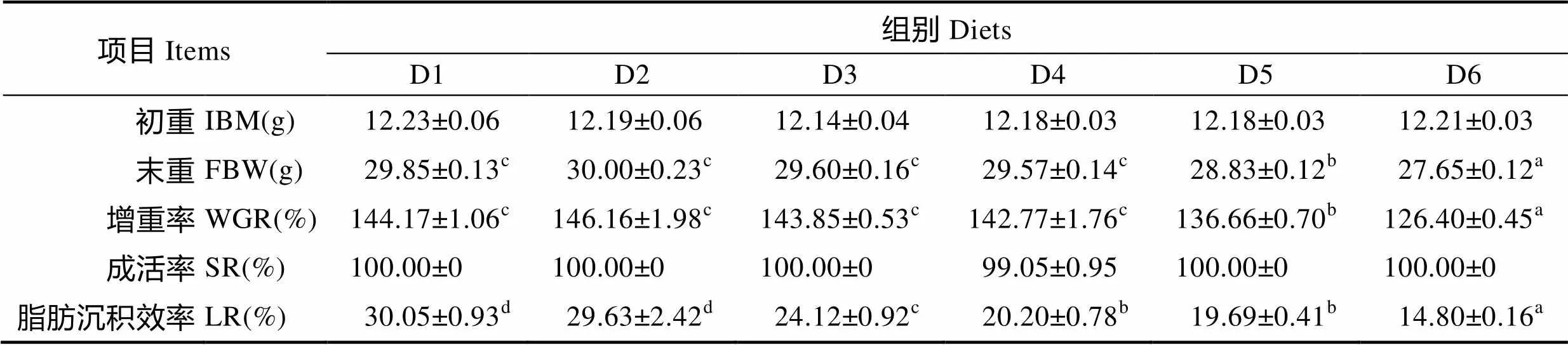
Tab.3 Effects of dietary n-3/n-6 LC-PUFA ratios on growth performance and lipid deposition rate of juvenile turbot
注:同行数值上标英文字母不同表示差异显著(<0.05),下同
Note: Values in the same row with different superscripts show significant difference (<0.05), the same as below
表4 n-3/n-6 LC-PUFA对大菱鲆幼鱼脂肪代谢酶的影响
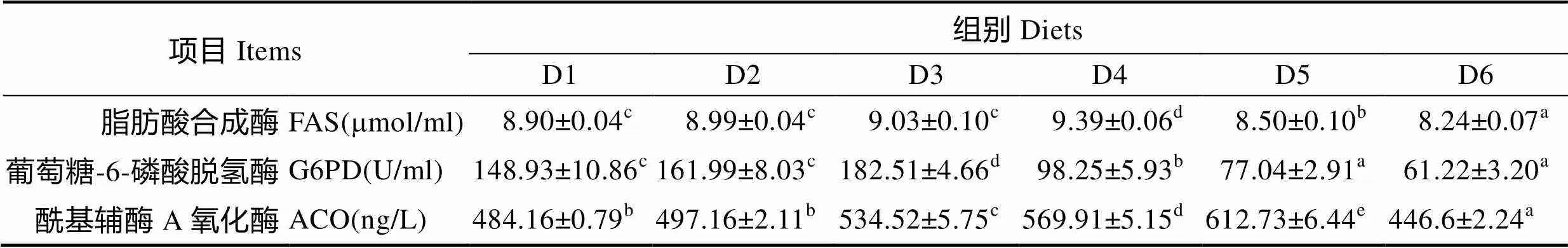
Tab.4 Effects of dietary n-3/n-6 LC-PUFA ratios on fat metabolic enzymes of whole fish in juvenile turbot
表5 n-3/n-6 LC-PUFA对大菱鲆幼鱼消化酶的影响

Tab.5 Effects of dietary n-3/n-6 LC-PUFA ratios on digestive enzyme of juvenile turbot
表6 n-3/n-6 LC-PUFA对大菱鲆幼鱼血清生化指标的影响
Tab.6 Effects of dietary n-3/n-6 LC-PUFA ratios on serum biochemical indices of juvenile turbot
其中,D5组的总蛋白显著高于D1、D6组(0.05),白蛋白和高密度脂蛋白胆固醇D5组显著高于D1、D2和D6组(0.05)。总胆固醇随着饲料的变化呈先上升后下降的趋势,在D4和D5组时达到最大值,显著高于D1和D6组(0.05)。甘油三酯和低密度脂蛋白胆固醇各组之间均无显著性差异(0.05)。
3 讨论
李思萌等(2015)研究表明,饲料中不同脂肪源不影响大菱鲆幼鱼的成活率。本研究结果显示,大菱鲆幼鱼的生长随着饲料中n-3/n-6 LC-PUFA变化呈剂量效应反应,与徐后国(2013)在鲈鱼()中的研究结果一致。鱼类的脂类一般以脂肪的形式累积于腹腔、头盖腔、皮下、腹侧等脂肪组织(Toussaint, 2005),也可存在于肝脏等其他器官。鱼体组织中脂肪的过量沉积可能会影响鱼肉的品质及经济价值。鱼体过度的脂肪沉积,严重时甚至会导致大量脂肪在肝细胞内堆积(张春暖等, 2013),引起肝细胞变性、坏死,导致肝功能下降,甚至造成衰竭。实际生产过程中,在一定范围内提高饲料的脂肪水平有利于增加鱼类对饲料的利用效果(Hansen,2008),而饲料中过高的脂肪含量会引起鱼体过量的脂肪沉积。LC-PUFA能抑制脂类合成,促进脂类分解,降低肝脂和血脂(马晶晶等, 2014)。其中,ARA及其代谢物前列腺素(PGE),特别是PGEJ2可通过活化脂肪细胞促进脂肪代谢进而降低机体体脂水平(Duplus,2002),还能抑制FAS基因表达(蔡双莲等, 2003)。这可能是本研究中大菱鲆幼鱼脂肪沉积率随着饲料的变化下降的原因,具体的机理有待进一步探究。
脂肪酸合成酶、葡萄糖-6-磷酸脱氢酶和酰基辅酶 A 氧化酶等都是肝脏脂质代谢酶,其活性高低直接影响脂肪的合成与分解。脂肪酸合成酶在动物体脂生成、沉积中发挥重要作用,而不同动物的器官和组织中FAS的活性、反应时间和作用机理并不一样(韩光明, 2009)。本研究发现,脂肪酸合成酶活性的变化随着饲料中n-3/n-6 LC-PUFA的变化呈先上升后下降的趋势,D4 组为最大值,最能促进脂肪合成酶的活性。葡萄糖-6-磷酸脱氢酶是戊糖磷酸途径的关键酶,为脂肪的合成提供NADPH(赵红霞等, 2008)。本研究中,葡萄糖-6-磷酸脱氢酶随着饲料中n-3/n-6 LC-PUFA的变化,在 D3 组时达到最大值,显著高于其他各组,低于18.97 (D2组)时,葡萄糖-6-磷酸脱氢酶酶活迅速下降,说明过量的ARA对其有抑制作用。研究表明,酰基辅酶 A 氧化酶活性降低导致肝细胞的严重脂肪变性,因此,本研究饲料中,n-3/n-6LC-PUFA 为D5 组时达到最大值,说明肝细胞的脂肪发生变性,影响正常生长。胃和肠道是动物机体消化吸收食物的场所(麦康森, 2011),主要依赖消化酶消化分解饲料中的能量物质,进而有效地吸收(Furné, 2005)。因此,消化酶活性在一定程度上可以作为鱼类对营养物质消化分解能力的指标。消化酶的活性不仅与动物自身生理状态有关,还与其食性及所采食的饲料成分、含量等多因素相关(戚常乐, 2016)。胰蛋白酶是动物机体内主要的蛋白水解酶之一,它不仅可以分解食物中的蛋白质,而且迅速激活肝胰脏分泌的其他酶原促进机体的消化功能。本研究中,大菱鲆幼鱼肠道中胰蛋白酶的活性随着饲料中n-3/n-6 LC-PUFA的变化,呈先增强后减弱的趋势,在n-3/n-6 LC-PUFA为9.06 (D4组)时,胰蛋白酶活性最强,说明此时肠道对蛋白质的消化吸收能力最好;但是,n-3/n-6 LC-PUFA为9.06时(D4组),大菱鲆幼鱼WGR的D1、D2和D3组无显著差异而显著高于D5、D6组。其可能的原因是过量的ARA会对鱼体产生一定的炎症反应(左然涛等, 2015),从而导致以下原因:首先是通过改变膜脂成分影响了酶活性表达(许友卿等, 2010a);其次是因为当饲料中n-3/n-6 LC-PUFA为9.06 (D3组)时,ARA对大菱鲆幼鱼造成的炎症反应已经超出其对免疫调节的范围,造成机体对蛋白质的消化吸收能力下降。
脂肪酶活性的变化可显示出鱼体对脂肪的利用能力(曲木等, 2016)。戚常乐(2016)在关于卵形鲳鲹()ARA的最适研究中发现,ARA显著影响了卵形鲳鲹脂肪酶活性,0.51%组和 0.96%组的脂肪酶活显著高于0.15%组和0.36%组,与本研究结果不一致。本研究发现,饲料中n-3/n-6 LC-PUFA的变化使大菱鲆幼鱼肠道中脂肪酶的活性呈上升趋势。目前,尚无较多关于ARA影响脂肪酶活性的报道,推测可能是因为ARA及其代谢物前列腺素(PGE),特别是PGEJ2可与脂肪细胞转录因子(PPARr)迅速反应并激活它,从而活化脂肪细胞,促进其代谢使机体体脂水平下降(Duplus,2002),也可能是因为本研究所设计配方n-3/n-6 LC-PUFA的变化增加了PUFAs的含量,而PUFAs促进脂类在消化道中的乳化而增加与消化酶的接触面积,促进脂肪酶消化的缘故(许友卿等, 2010b)。具体原因需要进一步的验证。
血清中的蛋白质具有重要的生理作用,直接关系到鱼体代谢及抗病能力,是鱼类机体健康状况的重要指标之一(强俊等, 2012)。白蛋白的生理作用主要体现在维持鱼体血量和渗透压方面。正常生理状况下,摄食情况会影响机体血清蛋白含量(蒋明等, 2015)。叶剑雄(2016)研究表明,血清中蛋白质含量受环境和饲料的种类及含量影响。本研究表明,饲料中n-3/n-6 LC-PUFA的变化对血清中蛋白质有显著影响,总蛋白和白蛋白在n-3/n-6 LC-PUFA为6.86 (D5组)时均为最大值,且在D6组有下降趋势,说明饲料中n-3/n-6 LC-PUFA对饲料的机体健康产生重要的作用,在一定的范围内起到促进作用。AST是动物细胞线粒体中的重要氨基转移酶,对机体蛋白质代谢具有重要作用,AST的活性变化是肝细胞损伤的敏感指标(王香丽等, 2015)。当机体在正常情况下,血清中AST活性较低。组织病变会造成细胞膜通透性增强,血浆中的AST活性升高。本研究中,AST呈先上升后下降的趋势,说明饲料中ARA增强细胞膜通透性,另外,谷草转氨酶在D6组时呈下降趋势,综合在WGR等方面的结果来看,D6组大菱鲆幼鱼处于不健康的状态,AST活性下降。高密度脂蛋白胆固醇主要由肝脏合成,有利于预防心血管疾病,过量的低密度脂蛋白易引发动脉硬化(李新等, 2016),韩宏毅等(2010)研究认为,不饱和脂肪酸能够降低LDL-C含量并升高HDL-C含量。而本研究中,饲料中n-3/n-6 LC-PUFA的变化对低密度脂蛋白胆固醇各组之间无显著影响,说明本研究中ARA对大菱鲆幼鱼的低密度脂蛋白胆固醇无降低作用。高密度脂蛋白胆固醇均随着饲料的变化呈先上升后下降的趋势,说明本研究中ARA对大菱鲆幼鱼的高密度脂蛋白胆固醇有升高作用。
在本研究条件下,饲料中n-3/n-6 LC-PUFA比值在适宜范围(18.97~23.04)能促进大菱鲆幼鱼的生长,同时,饲料中ARA对消化呈先上升后降低的趋势,在n-3/n-6 LC-PUFA为9.06 (D4组)时,胰蛋白酶酶活达到最大值。n-3/n-6 LC-PUFA的比例过低会对大菱鲆幼鱼存在降脂作用,具体机理需要进一步验证。
AOAC International. Official methods of analysis of AOAC International (17thed). Gaithersburg, MD, USA: Association of Analytical Communities, 2002
Cai SL, Li M. Advances in polyunsaturated fatty acids. Life Science Research, 2003, 7(4): 289–292, 304 [蔡双莲, 李敏. 多不饱和脂肪酸的研究进展. 生命科学研究, 2003, 7(4): 289–292, 304]
Duplus E, Forest C. Is there a single mechanism for fatty acid regulation of gene transcription? Biochemical Pharmacology, 2002, 64(5–6): 893–901
Furné M, Hidalgo MC, López A,. Digestive enzyme activities in Adriatic sturgeon, and rainbow trout. A comparative study. Aquaculture, 2005, 250(1–2): 391–398
Han GM. Effects of dietary lipid levels on growth, fat deposition, fatty acid profiles and fatty acid synthase of GIFT strain Nile tilapia,. Master¢s Thesis of Nanjing University, 2009, 6 [韩光明. 饲料脂肪水平对吉富罗非鱼生长、体脂沉积、脂肪酸组成及脂肪酸合成酶的影响. 南京农业大学硕士研究生学位论文, 2009, 6]
Han HY, Wang J. Polyunsaturated fatty acids and their physiological functions. Chinese Journal of Clinical Research, 2010(6): 523–525 [韩宏毅, 王剑. 多不饱和脂肪酸及其生理功能. 中国临床研究, 2010(6): 523–525]
Hansen JØ, Berge GM, Hillestad M,. Apparent digestion and apparent retention of lipid and fatty acids in Atlantic cod () fed increasing dietary lipid levels. Aquaculture, 2008, 284(1–4): 159–166
Jiang M, Huang F, Wen H,l. Effects of dietary zinc on growth, serum biochemical indices, and antioxidant responses in juvenile blunt snout bream,. Journal of Fishery Sciences of China, 2015, 22(6): 1167– 1176 [蒋明, 黄凤, 文华, 等. 饲料锌对团头鲂幼鱼生长性能、血清生化指标和抗氧化功能的影响. 中国水产科学, 2015, 22(6): 1167–1176]
Li SM, Wu LX, Jiang ZQ,. Effects of dietary lipid source on growth performance and muscle fatty acid composition of juvenile turbot (). Chinese Journal of Animal Nutrition, 2015, 27(5): 1421–1430[李思萌, 吴立新, 姜志强, 等. 饲料脂肪源对大菱鲆幼鱼生长性能和肌肉脂肪酸组成的影响. 动物营养学报, 2015, 27(5): 1421– 1430]
Li X, Yang RB, Qian XQ,. Effect of dietary vegetable oils when fed to genetically improved farmed tilapia strain of Nile tilapia. Acta Hydrobiological Sinica, 2016, 40(4): 672–680[李新, 杨瑞斌, 钱雪桥, 等. 不同植物脂肪源对吉富罗非鱼生长性能、肌肉脂肪酸和生理生化指标的影响. 水生生物学报, 2016, 40(4): 672– 680]
Ma JJ, Wang JY, Sun JZ,. Effect of dietary DHA to EPA ratios on growth performance, body composition and serum physiological parameters in juvenile. Journal of Fisheries of China, 2014, 38(2): 244–256[马晶晶, 王际英, 孙建珍, 等. 饲料中DHA/EPA值对星斑川鲽幼鱼生长、体组成及血清生理指标的影响. 水产学报, 2014, 38(2): 244–256]
Ma JJ. Effect of dietary n-3 HUFA on growth performance and lipid metabolism in juvenile black sea bream,. Master¢s Thesis of Zhejiang University, 2008, 9 [马晶晶. n-3高不饱和脂肪酸对黑鲷幼鱼生长及脂肪代谢的影响. 浙江大学硕士研究生学位论文, 2008, 9]
Mai KS. Aquatic animal nutrition and feedstuffs. ⅡEdition. Beijing: China Agricultural Press, 2011 [麦康森. 水产动物营养与饲料学. 2版. 北京: 中国农业出版社, 2011]
Qi CL. Effects of LNA, ARA, DHA and EPA on the growth and immunity of juvenile pomfret. Master¢s Thesis of Shanghai Ocean University, 2016, 28[戚常乐. LNA、ARA、DHA和EPA对卵形鲳鲹幼鱼生长及免疫影响的研究. 上海海洋大学硕士研究生学位论文, 2016, 28]
Qiang J, Yang H, Wang H,. Studies on blood biochemical indices and expression of hepatic HSP70 mRNA of different tilapia strains artificially challenged with. Journal of Fisheries of China, 2012, 36(6): 958–968[强俊, 杨弘, 王辉, 等. 海豚链球菌感染对不同品系罗非鱼血液生化指标和肝脏HSP70mRNA表达的影响. 水产学报, 2012, 36(6): 958–968]
Qu M, Li CE, Liu HC,. Effects of different dietary carbohydrate-to-lipid ratios on growth, body composition and digestive enzyme activities of Common carp (). Chinese Journal of Animal Nutrition, 2018, 28(7): 2069–2078 [曲木, 李长娥, 刘宏超, 等. 饲料不同糖脂比对鲤鱼生长、体成分及消化酶活性的影响. 动物营养学报, 2016, 28(7): 2069–2078]
Sargent JR, Henderson JR, Tocher DR,. The lipids. Elsevier, 2002, 2(3), 181–257
Toussaint C, Fauconneau B, Médale F,. Description of the heterogeneity of lipid distribution in the flesh of brown trout () by MR imaging. Aquaculture, 2005, 243(1–4): 255–267
Wang AM. Effects of dietary lipid levels on growth and fat metabolism of GIFT strain of Nile tilapia (). Doctoral Dissertation of Nanjing University, 2011, 9[王爱民. 饲料脂肪水平对吉富罗非鱼生长及脂肪代谢调节的研究. 南京农业大学博士研究生学位论文, 2011, 9]
Wang JY, Zhu SG, Xu CF. Biochemistry (Third Edition). Beijing: Higher Education Press, 2002[王镜岩, 朱圣庚, 徐长法. 生物化学(第三版). 北京: 高等教育出版社, 2002]
Wang XL, Mai KS, Xu W,. Influence of dietary methionine on the activity of liver and plasma Glutamic-Pyruvic and glutamic oxalacetic transaminases of juvenile darkbarbel catfish (). Periodical of Ocean University of China(Natural Science), 2015, 46(9): 49–53 [王香丽, 麦康森, 徐玮, 等. 蛋氨酸对瓦氏黄颡鱼幼鱼肝脏及血浆中谷草转氨酶和谷丙转氨酶活力的影响. 中国海洋大学学报(自然科学版), 2015, 46(9): 49–53]
Watanabe YG. An organ culture study on the site of determination of ACTH and LH cells in the rat adenohypophysis. Cell and Tissue Research, 1982, 227(2): 267–275
Xu HG. Effects of dietary fatty acids on growth performance, health and accumulation of lipids and fatty acids in juvenile Japanese seabass (). Doctoral Dissertation of Ocean University of China, 2013, 65 [徐后国. 饲料脂肪酸对鲈鱼幼鱼生长、健康及脂肪和脂肪酸累积的影响. 中国海洋大学博士研究生学位论文, 2013, 65]
Xu YQ, Zhong M, Ding ZK. Influence and mechanism of poly unsaturated fatty acids on fish feed conversion ratio. Feed Industry, 2010a, 31(8): 46–50[许友卿, 钟鸣, 丁兆坤. 多不饱和脂肪酸对鱼饲料转化率的影响及其机理. 饲料工业, 2010a, 31(8): 46–50]
Xu YQ, Zhuang L, Ding ZK. Effects and their mechanisms of poly unsaturated fatty acids on the growth and development of seawater fish larva. Feed Industry, 2010b, 31(14): 13–18 [许友卿, 庄丽, 丁兆坤. 多不饱和脂肪酸对海水仔稚鱼生长发育的影响及机理. 饲料工业, 2010b, 31(14): 13–18]
Ye JX. The effects of soluble substance of crude oil on development, antioxidant and biochemical indicators of carp. Master¢s Thesis of Shanghai Ocean University, 2016, 35[叶剑雄. 原油水溶物对鲫发育、组织抗氧化和血清生化指标的影响. 上海海洋大学硕士研究生学位论文, 2016, 35]
Zhang CN, Wang AM, Liu WB,. Effects of dietary lipid levels on fat deposition, lipid metabolize enzyme and antioxidantic activities of. Journal of Fishery Sciences of China, 2013, 20(1): 108–115 [张春暖, 王爱民, 刘文斌, 等. 饲料脂肪水平对梭鱼脂肪沉积、脂肪代谢酶及抗氧化酶活性的影响. 中国水产科学, 2013, 20(1): 108–115]
Zhao HX, Cao JM, Zhu X,. Effects of dietary glutathione on growth performance, serum biochemical indices and body composition of juvenile grass carp (). Chinese Journal of Animal Nutrition, 2008, 20(5): 540–546 [赵红霞, 曹俊明, 朱选, 等. 日粮添加谷胱甘肽对草鱼生长性能、血清生化指标和体组成的影响. 动物营养学报, 2008, 20(5): 540–546]
Zhou CH, Wang SJ, Tanaka KI,. Theomparative research on the fatty acid and lipid synthesis ability between the meat - type ducks and the meat-type chicken. Acta Nutrimental Sinica, 2006, 28(1): 87–88[周长海, 王淑杰, 田中桂一, 等. 肉鸭和肉鸡脂肪酸及脂类合成能的对比研究. 营养学报, 2006, 28(1): 87–88]
Zuo RT, Mai KS, Xu W,. Advance of studies on the effects of fatty acids on immune responses and nutritional regulation mechanism in fish species. Jounal of Fisheries of China, 2015, 39(7): 1079–1088[左然涛, 麦康森, 徐玮, 等. 脂肪酸对鱼类免疫系统的影响及调控机制研究进展. 水产学报, 2015, 39(7): 1079–1088]
(编辑 陈严)
Effects of n-3/ n-6 LC-PUFA on Fat Deposition, Digestion, and Lipid Metabolism in Juvenile Turbot ()
TAN Qing1,2, HAN Xiujie1,2, WANG Jiying1, LI Baoshan1, LI Xueli1,2, HAO Tiantian1, ZHANG Limin1①
(1. Shandong Marine Resource and Environment Research Institute, Shandong Key Laboratory of Marine Ecological Restoration, Yantai 264006; 2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306)
An 8-week feeding trial was conducted in a recirculated system to study the effect of dietary n-3/n-6 long-chain polyunsaturated fatty acid (LC-PUFA) ratios (29.54, D1; 23.04, D2; 18.97, D3; 9.06, D4; 6.86, D5; 3.87, D6) on growth performance, whole-body fatty acid composition, and serum biochemical indices in turbot (). Six diets were formulated to feed six groups of juvenile turbots [mean initial weight (12.18±0.01) g]. Each diet was randomly fed to triplicate groups of 35 fish per tank. There were no significant differences in the survival rate (SR) of turbot (>0.05). With decreasing dietary n-3/n-6 LC-PUFA ratios, the weight gain rate (WGR) first increased and then decreased. The WGR of the D6 group was significantly lower than that of the other groups (<0.05). The lipid deposition rate (LR) reduced with decreasing dietary n-3/n-6 fatty acid ratios, and the D6 group achieved 14.80, which was significant lower than that of the other group (<0.05). The trypsin content increased as the dietary n-3/n-6 LC-PUFA level decreased from 29.54 to 9.06, and then decreased. Lipase increased with decreasing n-3/n-6 LC-PUFA. As the dietary n-3/n-6LC-PUFA level decreased, fatty acid synthetase and glucose-6-phosphate dehydrogenase first increased and then decreased. When the dietary n-3/n-6 LC- PUFA level was 9.06, fatty acid synthetase levels were significantly higher than those in the other groups (<0.05). Additionally, glucose-6-phosphate dehydrogenase levels were significantly higher than those in the other groups (<0.05) when the dietary n-3/n-6 LC-PUFA level was 18.97. Aspartate aminotransferase, total protein, albumin, and high-density lipoprotein cholesterol first increased and then decreased with increasing dietary n-3/n-6 LC-PUFA ratios.These results indicate that, with decreasing dietary n-3/n-6 LC-PUFA ratios, resulting in reduced lipid deposition rate of juvenile turbot.
; n-3/n-6 LC-PUFA; Fat deposition;Digestive enzyme; Serum biochemical indices
ZHANG Limin, E-mail: zhanglimin@126.com
10.19663/j.issn2095-9869.20170417001
* 国家海洋生物产业–水生动物营养与饲料研发创新示范平台(201701002)、山东省重点研发计划(2016GSF115005)和山东省自然科学基金(ZR2015CQ023; 201701002)共同资助[This work was supported by the Marine Bio-Industry Innovation and Development Regional Demonstration Service Platform(201701002),Shandong Province Key Research and Development Program of China (2016GSF115005), and Shandong Provincial Natural Science Foundation, China (ZR2015CQ023; 201701002)]. 谭 青,E-mail:1242192819@qq.com
张利民, 研究员, E-mail: zhanglimin@126.com
2017-04-17,
2017-05-27
S963.1
A
2095-9869(2018)04-0066-08
谭青, 韩秀杰, 王际英, 李宝山, 李学丽, 郝甜甜, 张利民. n-3/n-6长链多不饱和脂肪酸对大菱鲆幼鱼脂肪沉积、脂肪吸收及代谢相关酶活性和血清生化指标的影响. 渔业科学进展, 2018, 39(4): 66–73
Tan Q, Han XJ, Wang JY, Li BS, Li XL, Hao TT, Zhang LM. Effects of n-3/n-6 n-3/ n-6 LC-PUFA on fat deposition, digestion, and lipid metabolism in juvenile turbot (). Progress in Fishery Sciences, 2018, 39(4): 66–73
