多平衡体系能斯特方程还原电极电势计算
2018-08-30杨梅,鲜亮,2
杨 梅,鲜 亮,2
(1.西北民族大学 化工学院,甘肃 兰州 730030;2. 甘肃省高校环境友好复合材料及生物质利用省级重点实验室,甘肃 兰州 730124)
电化学是大学化学教学过程中的重点和难点.电化学知识的学习和掌握涉及到电子转移、电极材料、电解液、原电池、电解池、Faraday定律,原电池电动势的测定及电极电势的运用,以及多个反应参与下的氧化还原平衡中还原电极电势计算等[1-4].而Nernst方程是对于上述问题的定量计算公式.在教学实践中,初学者一般可以掌握简单反应体系当中的Nernst方程电对电极电势和原电池电动势的计算.但是,当反应体系较为复杂,尤其多个反应参与到氧化还原平衡当中之后或者计算步骤繁琐时,往往不知所措,从而在这一知识点的学习方面有所欠缺[5,6].本文针对上述问题就不同反应体系当中的Nernst方程的计算讨论如下.
1 水相中的电对还原电极电势的计算
无机化学反应大部分都是在水相当中完成的.在水相当中的电对还原电极电势往往受到水溶液酸碱性的影响.所以,在水相中进行Nernst方程计算的时候,必须考虑到水的解离平衡以及水分子可能以H+或OH-解离形式参与到氧化还原反应平衡当中.
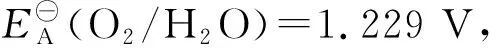
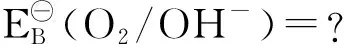
解:① 发生的反应如下:O2(g)+ 4H﹢(aq)+ 4e-2H2O
(l)
因为pH=14,故c(H﹢)=10-14mol/L,
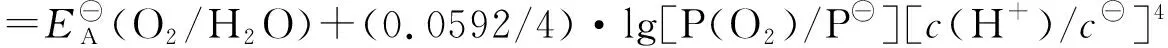
=1.229+(0.0592/4)·lg(1.0×10-14)4
=0.400 V
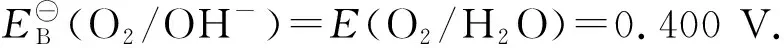
上述解题过程证明,在有H2O、OH-和H+参与的反应体系当中,需要考虑到水的解离平衡H2O+H2OH3O++OH-,并利用题干给定pH值获得相关反应物种的浓度.
2 沉淀-溶解平衡体系中的电极电势计算
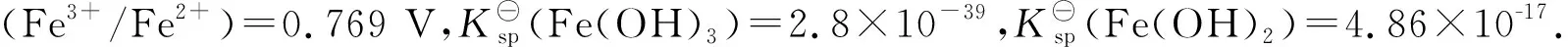
E(Fe3+/Fe2+)=?E⊖(Fe(OH)3/ Fe(OH)2)=?
解:在上述反应体系当中,存在着如下多个平衡体系:
反应(I): Fe(OH)3(s)Fe3+(aq)+3OH-(aq)
反应(II): Fe(OH)2(s)Fe2+(aq)+2OH-(aq)
反应(III):Fe3+(aq)+e-Fe2+(aq)
反应(I)和反应(II)为沉淀-溶解平衡,反应(III)为相关电对的还原反应.在题干给定的c(OH-)=1.0 mol/L反应条件下,可以认为Fe(OH)3和Fe(OH)2这两种固体形式并没有直接发生电子的转移和交换,而实际发生的还原反应途径是Fe(OH)3和Fe(OH)2固体沉淀各自以解离的形式,通过Fe3+和Fe2+的电子转移发生了还原反应(图1).所以,E⊖(Fe(OH)3)和Fe(OH)2电对的还原反应实质上就是给定条件下的Fe3+和Fe2+的还原反应,E⊖(Fe(OH)3/ Fe(OH)2)=E(Fe3+/Fe2+).这样,就可以利用Fe3+/Fe2+的Nernst方程进行计算.
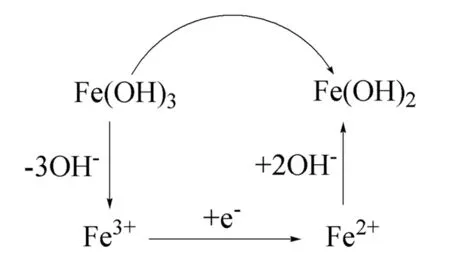
图1 Fe(OH)3/Fe(OH)2电对还原反应的实际发生途径
在反应(I)和反应(II)的相对平衡当中,c(Fe3+)和c(Fe2+)受制于各自的溶度积常数.当保持
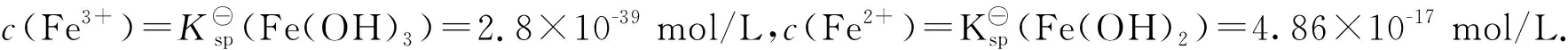
E⊖(Fe(OH)3/ Fe(OH)2)=E(Fe3+/Fe2+)=E⊖(Fe3+/Fe2+)+0.0592·lg(c(Fe3+)/c(Fe2+))
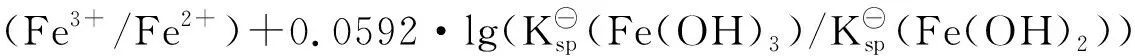
=0.769+0.0592·lg(2.8×10-39/4.86×10-17)
=-0.55 V
通过该例题的求解,说明在此类涉及到多平衡的电极电势的计算过程时,需要考虑参与反应的全部化学平衡,并正确地理解这些反应平衡之间的关联以及数量关系.在此基础上才能够得到正确的解答.
3 配位-解离平衡参与的还原电极电势的计算
配位反应是典型的Lewis酸碱反应.配位反应平衡以配合物的稳定常数和解离常数进行定量描述.和上述沉淀-溶解平衡类似,配合物的稳定性在此类多平衡反应体系当中对相关电对还原电极电势也有一定的影响.
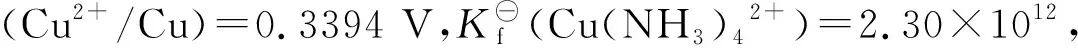
E⊖(Cu(NH3)42+/Cu)=?
解:该反应在给定条件下,存在着Cu(NH3)42+的配位-解离平衡和Cu2+的还原反应平衡:
反应(I): Cu(NH3)42+(aq)Cu2+(aq)+4NH3(aq)
反应(II): Cu2+(aq)+2e-=Cu(s)
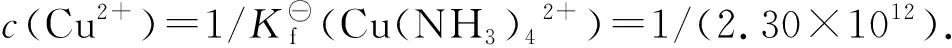
E⊖(Cu(NH3)42+/Cu)=E(Cu2+/Cu)=E⊖(Cu2+/Cu)+0.0592/2·lg{c(Cu2+)}
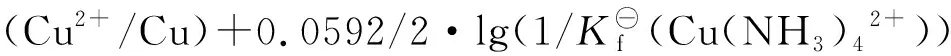
=0.3394+0.0592/2·lg(1/(2.30×1012))
=-0.0265V
显然,在配位-解离平衡当中进行相关物种电极电势计算时,必须将相关物种放在题干给定条件下的、可能存在的化学反应平衡体系当中去完成计算过程.而涉及多平衡体系时的各物种浓度需要用相关反应的平衡常数来获得.
综上所述,电极电势Nernst方程只适用于利用标准状态下的电对电极电势计算处于非标准状态下的电极电势.如果计算相关物种的标准电极电势,必须设计适当的多平衡反应体系[6,7],利用平衡常数获得相关计算数据,从而完成计算过程.
