三种小鼠肠道病毒核酸检测技术在小鼠健康监测中的应用
2018-08-30李欣悦丛日旭阮研硕向志光
李欣悦,佟 巍,丛日旭,郭 智,蔡 鹃,阮研硕,向志光
(中国医学科学院医学实验动物研究所,北京 100021)
小鼠肝炎病毒(mouse hepatitis virus,MHV),呼肠孤病毒III型(reovirus 3,Reo-3)和小鼠诺如病毒(murine norovirus,MNV)是在实验小鼠中感染率较高的三个病原体,其中MHV和Reo-3是国内外实验动物微生物质量要求的必须排除的病原体,MNV虽未列在我国检测标准项目内,但已在国内多次检出[1-6]。目前我国实验动物病毒检测标准主要是采用血清学方法检测动物血清中的抗体,属于回顾性诊断,适用于病毒感染后的检测。PCR核酸检测技术是对待检样本中病原体的直接检测,其检测结果代表当期实验动物携带病原体情况。而且PCR核酸检测技术具有高度的特异性和敏感性,可在实验动物感染病原体初期检测到病原体[7-9]。MHV,Reo-3和MNV属于肠道病毒,经粪便传播,可通过对实验动物盲肠内容物或粪便进行核酸检测。因此病原微生物核酸检测在实验动物健康监测中是非常重要的一部分。本研究对送检本室的实验小鼠的盲肠内容物样品检测上述三种病毒,并与血清学检测结果进行了关联分析,分析核酸检测在实验动物健康监测中的适用性。
1 材料和方法
1.1 主要试剂和仪器
病毒核酸DNA/RNA提取试剂盒(Takara,9766);相关病毒抗体检测抗原片由本室制备;荧光标记的羊抗小鼠IgG(Jackson ImmunoResearch Laboratories,115-095-003);引物和探针由Invitrogen公司合成;一步法逆转录核酸扩增试剂盒One Step PrimeScriptTMRT-PCR Kit (Perfect Real Time)(Takara,RR064 A)。
台式离心机(Thermo fisher, Thermo Scientific Heraeus Fresco 21);荧光显微镜(Nikon,ECLIPSE Ni);实时PCR系统扩增仪(ABI,7500 Fast)。
1.2 实验方法
1.2.1 样品的选择和储存
送检本室小鼠随机采样,无菌采集盲肠内容物样品272份。每份样品取0.1 g小鼠盲肠内容物,储存于-80℃冰箱。
1.2.2 样品核酸的提取
小鼠盲肠内容物样品恢复至室温,加入200 μL PBS溶液涡旋振荡1 min,经12 000 r/min离心10 min,取200 μL上清液用病毒核酸DNA/RNA提取试剂盒进行核酸提取。
1.2.3 血清学检测方法和核酸检测方法结果判定
本实验室血清学检测采用间接免疫荧光试验技术检测MHV,Reo-3和MNV抗体[10-12],以1:10稀释小鼠血清样品滴加于抗原片,温育结合,以荧光标记的羊抗小鼠IgG结合抗原抗体复合物,使用荧光显微镜观察记录抗原孔荧光信号进行血清学判定。小鼠盲肠内容物样品核酸用探针法实时荧光定量 PCR检测MHV,Reo-3和MNV核酸[13],取样品核酸提取物5 μL,进行一步法逆转录实时定量PCR,用实时PCR系统扩增仪对各样品核酸进行荧光信号检测。以1×101~1×107copies/μL质粒的CT值绘制标准曲线,作为样品检出量估算的基础。在同一批次检测试验同时设置空白对照和阳性对照。阳性对照为含有目标核酸序列10 copies/μL的质粒。阳性对照品的多通道荧光信号图中显示荧光标记FAM信号值呈指数上升,扩增曲线图中荧光信号到达设定的域值时所经历的循环数(cycle threshold, CT)值小于36;空白对照以水为模板。空白对照的多通道荧光信号图中显示荧光标记FAM信号一直为水平线,扩增曲线图中荧光信号在设定的最高循环数40以内没有特征性扩增曲线,表明该批检测试验体系无污染。满足上述条件下,待检样品的多通道荧光信号图中显示荧光标记FAM信号有增长,在扩增曲线图中有指数增长且曲线光滑,CT值小于40,即判定待检样本含有目标病原体核酸。
1.3 统计学方法
对检测结果进行统计分析,以检出率表示。对核酸检出样品CT值和检出量分布用GraphPad Prism 7作箱式图分析。对血清学技术与核酸检测技术检测结果的分析使用SPSS 25软件进行t检验独立样本分析,以P< 0.05为差异有显著性。
2 结果
2.1 MHV、Reo-3、MNV三种肠道病毒在小鼠盲肠内容物的病毒核酸检出率和核酸检出量

图1 MHV、Reo-3、MNV在小鼠盲肠内容物中的病毒核酸检测Figure.1 The nucleic acid detection of MHV, Reo-3, and MNV in mouse cecal contents
在272份实验小鼠盲肠内容物样品中,MHV、Reo-3、MNV三种肠道病毒核酸检出率为17.3%,18.8%,16.9%,如图1A所示。MHV核酸检出样品的CT值分布在34~40之间,最大值是39.65,最小值是34.23,中位数是37.71,离群样品CT值为33.27,31.22和26.3; Reo-3核酸检出样品的CT值分布在34~39之间,最大值是39.01,最小值是34.61,中位数是36.96,无离群样品; MNV核酸检出样品的CT值在20~31之间,最大值是30.95,最小值是20.02,中位数是24.84,离群样品CT值为33.91,33.48,如图1B所示。根据三种病毒荧光定量PCR方法对1×101copies/μL~1×107copies/μL含有病毒靶序列标准质粒测定而绘制的定量标准曲线公式(MHV:CT=-3.075×X(拷贝数的指数)+38.685;Reo-3:CT=-3.185×X(拷贝数的指数)+40.16;MNV:CT=-3.347×X(拷贝数的指数)+38.618)对盲肠内容物样品的核酸检出量进行估算,MHV检出样品的核酸检出量多分布在0~100 copies/μL范围内,另有3份样品在102~104copies/μL之间,Reo-3检出样品的核酸检出量多分布在1~100 copies/μL范围内;MNV检出样品的核酸检出量多分布在100~105copies/μL范围,另有2份样品在10~100 copies/μL之间,如图1C所示。综上,MHV和Reo-3在小鼠盲肠内容物中的病毒核酸检出量较低,在1~100 copies/μL之间,而MNV病毒核酸检出量较高,在100~105copies/μL之间。
2.2 MHV、Reo-3、MNV三种病毒核酸检测结果与血清学结果关联分析
本研究抽取的小鼠盲肠内容物样品有254份存在可比较的MHV、Reo-3血清抗体检测结果,有243份存在MNV血清抗体检测结果。其核酸检测结果与血清学结果汇总见表1。MHV核酸检出率是16.5%(42/254),抗体阳性率是1.2%(3/254),核酸检出阳性样品对应的血清学结果均为抗体阴性,抗体阳性结果对应的核酸检测结果为阴性;Reo-3的核酸检出率是18.1%(46/254),抗体阳性率是1.2%(3/254),核酸检出阳性样品对应的血清学结果均为抗体阴性,抗体阳性结果对应的核酸检测结果为阴性;MNV的核酸检出率为15.6%(38/243),抗体阳性率是14.8%(36/243)。在36份血清学抗体阳性的对应盲肠内容物样品中,对应有24份MNV核酸检出;在207份血清学抗体阴性的对应盲肠内容物样品中,对应有14份MNV核酸检出。对上述2组样品的MNV检出的CT值做统计分析(CT值分布见图2),在24份MNV抗体阳性组的MNV检出的CT值与14份在MNV抗体阴性组的MNV检出的CT值差异无显著性(P=0.177,P> 0.05)。由此得出,针对免疫应答所产生抗体的血清学检测结果与针对病毒核酸的小鼠盲肠内容物样品核酸检测结果不完全一致,不存在相互替代的关系。
3 讨论
3.1 小鼠盲肠内容物病毒核酸低拷贝检出的情况
小鼠盲肠内容物样品核酸检测结果显示,MHV、Reo-3检出样品的CT值大部分在34~40范围内,部分MNV检出样品的CT值在31~33之间,接近或低于阳性对照的CT值。(MHV阳性对照品的CT值均值为35.18,Reo-3阳性对照品的CT值均值为35.62,MNV阳性对照品的CT值均值为33.7。)三种病毒目标扩增序列分别108 bp,67 bp,96 bp,其引物和探针的序列已经覆盖目标序列的60%以上,具备高度特异性。且空白对照品在40个检测循环内无特异扩增曲线,可保证检测反应体系无污染,当检测样品在40个检测循环内出现了特异性扩增曲线,则判为病毒核酸阳性,此种判定方法具有较高的准确性。
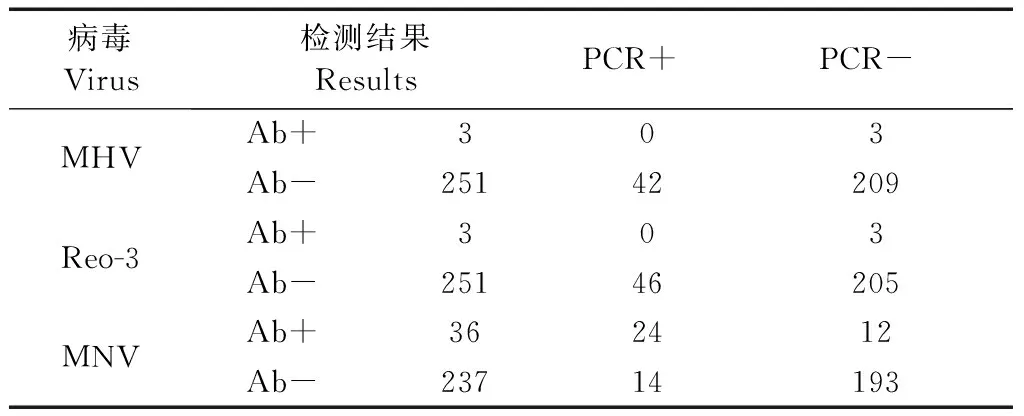
表1 MHV、Reo-3、MNV的小鼠盲肠内容物核酸检测及血清学检测Table.1 Nucleic acid detection in cecal contents and serological tests of MHV, Reo-3, and MNV
注:“PCR”代表核酸检测结果;“Ab”代表血清检测结果;“+”代表阳性;“-”代表阴性。
Note.“PCR” means the results of nucleic acid detection in mice cecal contents.“Ab” means the results of serological test.“+” means positive.“-” means negative.

图2 MNV抗体阳性和抗体阴性对应的核酸检出样品CT值的分布Figure.2 Distribution of CT values of samples with detected nucleic acid corresponding to antibodies positive and negative for MNV
在本次小鼠盲肠内容物样品核酸检测中,根据定量标准曲线估算,MHV、Reo-3核酸检出量范围在1~100 copies/μL之间,MNV病毒核酸检出量范围在100~105copies/μL范围内。在抗体阴性对应的小鼠盲肠内容物样品中也有核酸检出(MHV 42/251,Reo-3 46/251,MNV 14/237),表明在实验动物群体中可能存在MHV,Reo-3,MNV的潜伏感染。
3.2 在实验动物健康监控中核酸检测与血清学方法互为补充
本研究结果显示,MHV血清学检出率较低(3/254),而血清学检测阳性的3份样品核酸检测却为阴性;但是在血清学阴性的251份样品中核酸检测阳性率为42/251。Reo-3的检测结果类似。MNV两种检测方法似乎有一些相关性:在血清学阳性的36份样品中,核酸检测阳性的占比为2/3(24/36);血清学阴性的207份样品中,核酸检测阴性的占比193/207。但是这种相关性较低,同时对检出样品分析血清学阳性与阴性之间核酸检出量,也无统计学差异,在此次样品调查中,存在血清学结果为阴性对应的盲肠内容物样品有核酸检出阳性的情况,这说明血清学不能完全反映实验动物当期病原体携带情况。核酸检测结果与血清学抗体检测结果不完全相关,分析这种检测结果的差异,一方面,这与病原感染时实验动物体内病毒载量和血清抗体滴度的消长规律相关,如图3所示:在病原体感染早期,病毒存在指数级的扩增,但动物机体的特异性体液免疫应答在感染最初阶段未能快速激活,因此,针对病原免疫抗体的血清学检测方法存在一定的窗口期(A阶段);理论上存在一个期限,此阶段体液免疫已被激活,而且病毒的复制在动物机体内仍然存在,这时无论血清学还是核酸检测方法都应能检出(B阶段);在之后,病毒的复制被控制,而免疫抗体将会维持较长的一段时间(C阶段)。这种一般规律性的变化是血清学检测方法与针对病原的核酸检测出现差异的一种可能原因。另一方面,核酸检测方法与血清学方法存在各自的敏感性和特异性。一般来说核酸检测方法因为具有指数放大的效应而十分敏感,高敏感性同时也带来了特异性的降低,部分样品的检测可能受多种因素影响而出现假阳性;因而在进行核酸检测时需要对多个检测环节进行质量控制。鉴于此,今后须对两类方法的适用性进行标准化的病原感染研究,从而实现对检测结果的确切理解。

注:A阶段表示动物携带病原体,但不激发免疫应答,或者动物存在感染但抗体产量未达检测限,使得抗体检测结果为阴性,核酸检出阳性;B阶段表示动物感染了病原体同时处于排毒阶段,能够同时检测出抗体阳性和核酸阳性;C阶段表示动物感染过病原体,排出病毒量低于核酸方法检测限时,抗体检出阳性,核酸检测结果为阴性。图3 实验动物感染病原体期间病毒载量和抗体滴度变化示意图Note.Phase A indicates that animals carry pathogens but do not elicit an immune response, or animals have an infection but the amount antibody production does not reach the detection limit. It results in antibody negative and nucleic acid positive; phase B indicates that the animal is infected with the pathogen and is detoxifying, so antibody positive and nucleic acid positive were detected. In the C phase, animals were infected with the pathogen, and then the virus output was lower than the detection limit of the nucleic acid method. This result showed antibody positive and the nucleic acid negative.Figure.3 Schematic diagram of viral load and antibody titer changes in laboratory animals infected with virus
对于实验动物微生物质量的监测,一方面需要了解动物的既往感染史,需要使用血清学方法;而对于病原携带状态,以及环境中病原的丰度的检测可使用核酸检测方法。因此在实验动物健康监测中,病原体核酸检测结果与血清学结果互为补充,对实验动物病原潜伏感染或感染过情况予以检测。
