沉默DNA-PKcs对肝癌耐药细胞Bel7402/5-Fu凋亡的影响*
2018-08-29李大玉余春波朱欣婷刘喜平李长福
李大玉,余春波,朱欣婷,刘喜平,范 芳,李长福
(遵义医学院生化教研室,贵州遵义 563000)
原发性肝癌(HCC)是临床常见的消化系统恶性肿瘤之一,临床治疗主要是包括手术、放疗、化疗、介入治疗等的综合治疗,其中化疗对HCC的治疗有着重要作用,但化疗过程中形成的多药耐药(MDR)是导致化疗失败的重要原因之一[1]。DNA依赖蛋白激酶催化亚基(DNA-PKcs)是DNA依赖蛋白激酶(DNA-PK)的催化亚单位,在细胞内有许多重要的功能和作用,包括细胞凋亡信号传导[2]、免疫细胞分化、基因重组性监视等。前期研究显示,当沉默DNA-PKcs表达后Bel7402/5-Fu细胞P-糖蛋白(P-gp)表达下调,同时化疗敏感性增加[3]。ZHANG等[4]研究结果显示,当沉默神经胶质瘤细胞DNA-PKcs后,其化疗敏感性增加,提示DNA-PKcs对肿瘤耐药有一定关系,但其影响肝癌耐药的功能及机制还未清楚。本研究以siDNA-PKcs转染Bel7402/5-Fu肝癌耐药细胞,检测DNA-PKcs沉默后对肝癌耐药细胞Bel7402/5-Fu的凋亡及其机制的影响,探讨DNA-PKcs影响肝癌耐药的作用及机制。
1 材料与方法
1.1材料 Bel7402/5-Fu细胞购自南京凯基生物科技发展有限公司;小干涉RNA(siRNA)寡核苷酸购自上海吉玛基因生物技术有限公司;LipofectmineTM2000购自Invitrogen公司;Hoechst33342染色液购自上海碧云天生物技术公司;Annexin V-EGFP/PI细胞凋亡检测试剂盒购自江苏凯基生物技术有限公司;小鼠抗B细胞淋巴瘤-2相关x蛋白(Bax)、小鼠抗B细胞淋巴瘤/白血病-x基因长片段(Bcl-xl)、抗体购自美国Proteintech公司;兔抗DNA-PKcs抗体购自美国Assay biotech公司;其他试剂均为国产分析纯试剂。
1.2方法
1.2.1细胞培养 将Bel7402和Bel7402/5-Fu细胞培养在含10%的胎牛血清的1640培养液中,置于37 ℃、5%的二氧化碳孵箱中培养,观察细胞生长情况,取对数生长期细胞用于实验。
1.2.2分组与转染 实验分为空白对照组、脂质体对照组、阴性siRNA对照组(NC对照组)、siDNA-PKcs(针对DNA-PKcs基因转录水平表达的siRNA)实验组。取对数生长期细胞种于培养板中,96孔板按(8~10)×103/孔接种细胞,6孔板按(6~8)×105/孔接种细胞,分组培养,当融合度为70%~90%时进行转染,配制siDNA-PKcs-脂质体复合体,并加入对应孔中,培养箱内培养5 h后换液。
1.2.3Bel7402/5-Fu细胞耐药性检测 培养Bel7402和Bel7402/5-Fu细胞,分别接种96孔板,按1×104/孔加入其中,培养12 h,在对应孔内分别加入浓度为0、10、20、40、80、160、320、640 mg/L的5-氟尿嘧啶(5-Fu),细胞在培养箱中再孵育48 h后,弃上清液,磷酸盐缓冲液(PBS)洗两次,然后每孔加入无血清-无抗生素培养基180 μL和20 μL噻唑蓝(MTT),培养箱内再孵育4 h后,小心吸掉上层液(切勿吸掉底部结晶),每孔加二甲基压砜(MDSO)150 μL,振荡30 s使结晶全部溶解后,490 nm波长测定其吸光度值(A值),并计算半数抑制剂量(IC50)值及Bel7402/5-Fu细胞的耐药指数(耐药细胞IC50/亲本细胞IC50)。
1.2.4Hoechst33342染色法检测细胞形态学变化 将Bel7402/5-Fu细胞接种于6孔板中,12 h后转染,用含200 mg/L 5-Fu的培养基进行培养,48 h后处理细胞,Hoechst33342染色(按试剂盒说明书操作),倒置显微镜下观察细胞形态变化并拍照。
1.2.5流式细胞术检测细胞凋亡 将Bel7402/5-Fu细胞接种于6孔板,12 h后转染,用含200 mg/L 5-Fu的培养基进行培养,48 h后收集细胞,PBS洗细胞两次,用 Annexin V-EGFP/PI 双染(按试剂盒说明书操作), 1 h内流式细胞仪检测各组细胞凋亡情况。
1.2.6Western blot检测DNA-PKcs、Bax、Bcl-xl蛋白表达情况 提取各组细胞总蛋白,二喹啉甲酸法(BCA)检测定量样品蛋白水平,十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳,转膜,5%牛血清清蛋白封闭1 h,分别加入小鼠抗Bax抗体(1∶1 000)、小鼠抗Bcl-xl抗体(1∶1 000)和兔抗DNA-PKcs抗体(1∶1 000),孵育过夜(4 ℃),Tris缓冲生理盐水吐温(TBST)洗膜3次,10分钟/次,分别加1∶1 000稀释的辣根过氧化物酶(HRP)标记的山羊抗小鼠免疫球蛋白G(IgG)、HRP标记的山羊抗兔IgG室温孵育2 h,TBST洗膜3次,10分钟/次,电化学发光(ECL)发光显色,ImageJ定量分析软件分析灰度比。
1.2.7Real-time PCR检测DNA-PKcs的mRNA表达情况 使用Trizol试剂提取RNA,使用寡聚(dT)18引物(0.5 μg/μL)以总体积为10 μL的RT试剂盒进行反转录,用cDNA和SYBR Premix Ex TaqTMⅡ在荧光PCR仪上进行实时PCR,引物为序列如下。DNA-PKcs正向5′-GTG ACA AGG CAA CTG TAT GAG C-3′;反向5′-ACA CCG ACC ACA AAA ATC TCT T-3′。β-actin正向 5′-TGA CGT GGA CAT CCG CAA AG-3′;反向5′-CTG GAA GGT GGA CAG CGA GG-3′,通过公式2-△△Ct分析计算各基因的相对表达量。
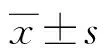
2 结 果
2.1MTT检测细胞耐药性 结果显示,耐药细胞Bel7402/5-Fu的IC50值[(683.93±9.38)mg/L]比亲本细胞Bel7402的IC50值[(52.09±6.46)mg/L]高,差异有统计学意义(P<0.01)。耐药细胞Bel7402/5-Fu的耐药指数为13.13。

a:P<0.01,与siDNA-PKcs实验组比较。A:实时定量PCR检测细胞DNA-PKcs mRNA水平;B:Western blot法检测细胞DNA-PKcs的蛋白表达及蛋白水平的半定量分析
图1 siDNA-PKcs对细胞DNA-PKcs mRNA及蛋白表达的影响
2.2siDNA-PKcs对肝癌耐药细胞Bel7402/5-Fu DNA-PKcs的mRNA及蛋白表达的影响 当细胞Bel7402/5-Fu转染siDNA-PKcs 后,各组细胞DNA-PKcs的mRNA表达水平及蛋白表达水平较其余组明显下调(P<0.01);空白对照组、脂质体对照组、NC对照组之间比较差异无统计学意义(P>0.05),见图1。
2.3Hoechst33342染色法检测细胞形态学变化 细胞转染siDNA-PKcs后细胞体积缩小,细胞核边集,呈亮蓝色;对照组细胞形态无明显变化,细胞转染siDNA-PKcs后出现凋亡现象,见图2。
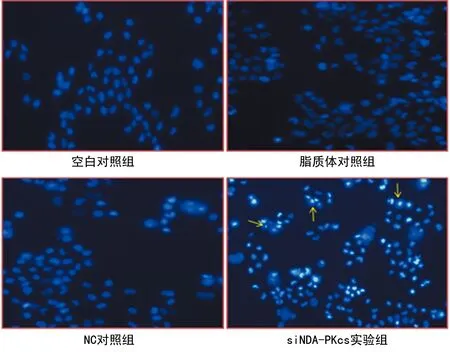
图2 细胞凋亡形态学图片(hoechst33342染色,×100)
2.4流式细胞技术检测细胞凋亡 当细胞转染siDNA-PKcs后,经流式细胞术检测结果显示siDNA-PKcs实验组细胞凋亡率较其余组增加,差异有统计学意义(P<0.01);空白对照组、脂质体对照组、NC对照组间比较差异无统计学意义(P>0.05),见图3。

a:P<0.01,与siDNA-PKcs实验组比较。A:流式细胞术检测细胞的凋亡;B:各组细胞凋亡的半定量分析
图3 siDNA-PKcs影响细胞凋亡的流式分析
2.5Western blot检测Bax、Bcl-xl蛋白表达情况当细胞转染siDNA-PKcs后,检测结果显示siDNA-PKcs组Bax蛋白表达上调,Bcl-xl蛋白表达下调,与其余组比较差异有统计学意义(P<0.01),见图4。
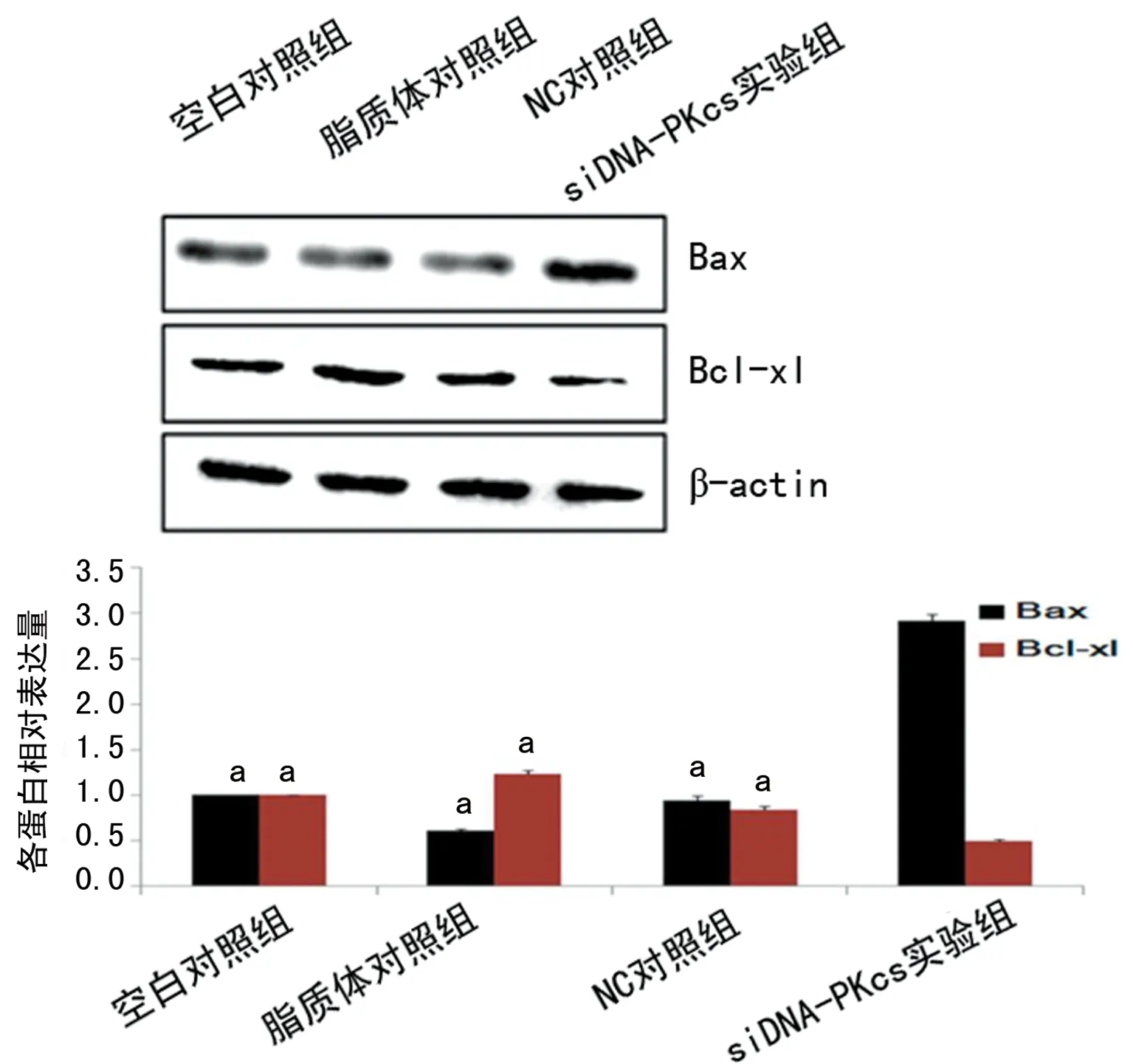
a:P<0.01,与siDNA-PKcs实验组比较
图4 siDNA-PKcs影响Bax、Bcl-xl蛋白表达的分析(Western blot)
3 讨 论
HCC是常见的恶性肿瘤之一,临床主要采用以手术为主的联合多种方法的综合治疗,其中化疗对肿瘤的治疗具有重要的意义,但化疗过程中容易形成MDR而影响肿瘤的治疗效果。肿瘤耐药是一个多重因素综合作用的复杂过程,如肿瘤细胞凋亡通路受阻[5]、DNA损伤修复能力增强等。DNA-PKcs是DNA-PK的催化亚单位,DNA-PKcs有很多磷酸化位点,可通过自身磷酸化或磷酸化下游分子参与细胞内的多种生物学活动,包括参与双链断裂的DNA修复[6-7]和细胞凋亡途径的信号传导等[8]。DNA-PKcs在不同的细胞活动中发挥了不同的生物学功能。
在胃癌细胞中,当抑制PARP1的活性时,增加了DDP诱导的DNA损伤和细胞凋亡,其机制是通过影响DNA-PKcs的稳定性,从而减少DNA损伤修复的能力,提高化疗敏感性[9]。HU等[10]研究胰腺癌细胞发现,抑制细胞DNA-PKcs的表达会增加细胞的化疗敏感性。当DNA-PKcs的功能缺失时,将引起A549细胞ATM的激活和p53的反应,进一步调控细胞周期[11]。DNA-PKcs具有调节细胞凋亡的功能[12]。ZOU等[13]报道发现,DNA-PKcs与Bcl-2呈正相关。当siRNA沉默人肝癌HepG2中DNA-PKcs表达后,激活Caspase-3和p53,同时下调Bcl-2和外源谷胱甘肽(GSH)的表达,通过抑制磷酸肌醇-3激酶/蛋白激酶B/核因子-kappaB(PI3K/Akt/NF-κB)途径,促进顺铂(DDP)和5-Fu联合应用引起的细胞凋亡及DNA损伤[14]。下调骨肉瘤细胞中DNA-PKcs表达后,以增进凋亡[15]和G1阻滞提高细胞对顺铂的敏感性[16]。以上研究结果提示DNA-PKcs可能通过对不同途径或凋亡通路中的分子进行调控,从而影响不同肿瘤细胞的耐药性。本实验中,当HCC耐药细胞Bel7402/5-Fu的DNA-PKcs表达沉默后,形态学检测结果显示,细胞体积缩小,染色质边聚,呈亮蓝色,这些形态学上的改变提示细胞出现凋亡现象。进一步用流式细胞术检测凋亡,结果显示凋亡率增加。同时,免疫印迹检测Bax、Bcl-xl蛋白表达水平,结果显示Bax蛋白表达水平增加、Bcl-xl蛋白表达水平减少,提示沉默DNA-PKcs的表达能促进HCC耐药细胞Bel7402/5-Fu的细胞凋亡,增加化疗敏感性。这说明DNA-PKcs可通过细胞某个凋亡途径影响肝癌细胞的耐药,其机制可能与siDNA-PKcs上调Bax蛋白表达水平和下调Bcl-xl蛋白表达水平有关,但具体的机制还需进一步的实验研究。
