GDNF基因治疗对帕金森病小鼠TH阳性神经元损害及胃肠功能障碍的影响*
2018-08-29吴少璞祁亚伟杨红旗马建军
吴少璞,祁亚伟,李 学,杨红旗,马建军
(河南省人民医院神经内科,郑州 450002)
帕金森病(PD)是一种中枢神经退行性疾病,其临床症状除了静止性震颤、姿势不稳等运动障碍以外,还表现为胃肠道功能障碍等非运动障碍。PD主要是由于患者大脑黑质多巴胺能神经元发生退行性病变而导致的神经元坏死和神经功能受损。目前对于PD发病的具体机制尚不明确,但普遍认为PD是由于多巴胺含量下降引起的;其临床治疗以减轻临床症状、促进神经元修复为主[1]。胶质细胞源性神经营养因子(GDNF) 能修复退化的多巴胺神经元,促进黑质纹状体多巴胺系统的再生,是目前活性最强的神经元保护因子[2]。目前关于GDNF与PD动物模型的研究主要有两种,除了通过GDNF直接输注,还有通过病毒为载体的基因改造疗法或经基因工程改造后再通过细胞介导输注[3]。GDNF相对分子质量大,难以透过血脑屏障,且必须通过持续性给予才能起到较好的神经修复作用,直接输注的效果不佳。本文通过GDNF基因疗法研究其对PD小鼠模型的神经修复作用和对胃肠功能的影响,为基因治疗提供科学依据。
1 材料与方法
1.1材料 健康雄性 C57BL/6J小鼠60只,由北京维通利华实验动物技术有限公司提供[许可证编号SCXK(京)2006-0009]。(24±2)℃、(55±5)%相对湿度、12 h日夜循环适应性喂养7 d,6周龄,体质量(20±2)g。小鼠分为对照组(n=15)、实验组(n=30)和健康组(n=15)。
1.2方法
1.2.1GDNF慢病毒质粒巨噬细胞特异性合成启动子构建 慢病毒载体的巨噬细胞特异性合成启动子构建参照BIJU等[4]报道,该序列包含两个顺式作用元件:CATT/增强子结合蛋白α(C/EBPα)和融合蛋白-1(AML-1),采用CD68迷你启动子代替质粒中原来的p47phox的迷你基因启动以提高特异性,然后用大鼠GDNF基因(Genbank编号:nm019139,STS 50-685)取代报告基因(GFP)。设计引物的上游引物为5′-CGG AAT TCG GTA CCG AGC TCT TAC GC-3,下游引物为5′-CGA CCG GTA CTG GGT GGC CTC CAG TG-3′; 使用标准的PCR分子扩增程序,PCR反应条件为30 s 30次94 ℃,56 ℃ 30 s,72 ℃ 1 min。并对产生的结构进行测序,以验证插入位点,以及GDNF基因的完整性。获得由慢病毒载体的293T细胞瞬时转染产生的3个包装质粒(pmdlg/pMDlg-pRRE,pRSV Rev和PMD.G)构成的慢病毒质粒。
1.2.2慢病毒转导与骨髓细胞移植[5]在骨髓注射前4 d给供体小鼠注射150 mg/kg氟尿嘧啶。用stempro-34-sfm完全培养基(Gibco公司)冲洗供体小鼠的股骨和胫骨骨髓获得骨髓细胞,添加200 mmol/L谷氨酰胺,100 IU/mL青霉素,100 μg/mL链霉素,5 U/mL肝素制作单细胞悬液。使用淋巴细胞培养基富集骨髓间充质干细胞并采用密度梯度分离法分离,进行体外过夜培养,第2天使用400 μL浓缩病毒上清液重悬获得的细胞悬液。在含有RetroNectin蛋白(Takara)的图层板上,4 μg/mL硫酸鱼精蛋白存在下进行6 h感染。感染后经小鼠尾静脉注射(1~2)×106细胞。实验组小鼠接受表达GDNF的慢病毒骨髓干细胞转导,对照组和健康组小鼠进行等量灭菌生理盐水注射。
1.2.3PD模型建立[6]移植后8周,给予对照组和观察组小鼠1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP,美国Sigma公司)生理盐水腹腔注射:第1天15 mg/kg,第2天25 mg/kg,第3~7天30 mg/kg。前两天进行低剂量注射是为了避免周围毒性导致动物死亡。健康组在相同的方案下进行生理盐水腹腔注射。建立模型第7天对造模小鼠进行PD行为学检测,从对照组和观察者中分别挑选12、24只造模成功的小鼠入组;健康组选取12只健康小鼠入组。在最后1次MPTP/生理盐水注射1周后处死动物。
1.2.4观察指标
1.2.4.1RT-PCR检测GDNF表达 分别于移植GDNF的慢病毒骨髓干细胞转染后第1、3、5、8周从实验组挑选3只小鼠验证GNDF的表达:使用8%水合氯醛进行麻醉,在麻醉成功后,向小鼠心脏注射肝素化冰生理盐水,断头取脑。提取小鼠黑质总RNA,提取方法为TRnzol试剂提取法,按照试剂盒(购自江莱生物)说明进行反转录。取反转录产物进行RT-PCR检测,以β-actin mRNA转录水平作为内参,反应循环参数设置。预变性:94 ℃ 5 min;PCR反应:94 ℃ 30 s,56 ℃ 60 s,72 ℃ 2 min,共35个循环;72 ℃延伸10 min。
1.2.4.2行为学观察 通过爬杆试验和转棒行为试验来评价小鼠的四肢运动协调能力。(1)爬杆试验:测试时间为MPTP注射第1、5、7天及最后1次注射后7 d;在0.5 m长(直径0.8 cm)的木棍一侧固定直径0.25 m的软木球,木杆上缠绕纱布,记录小鼠从软木球上出发走完整个木棍的时间,即爬杆时间。(2)转棒行为学检测:测试时间为注射第7天及最后1次注射后7 d,提前3 d开始使用转棒行为学仪器训练3组动物,每天转速12 r/min,训练5 min,测试时记录3组小鼠在20 r/min转速下的棒上停留时间。
1.2.4.3黑质酪氨酸羟化酶阳性(Tyrosine hydroxylase+,TH+)多巴胺能神经神经元数目 于最后1次注射MPTP/生理盐水后第7天,使用8%水合氯醛进行麻醉,在麻醉成功后,向小鼠心脏注射肝素化冰生理盐水,断头取脑。于冰上进行小鼠脑组织冠状切片,厚度约为1 mm,然后进行免疫组织化学染色,在光学显微镜下观察结果,详细操作严格按照说明书进行,试剂盒由江莱生物提供。同时采用光学分流法对3组小鼠脑组织中的多巴胺能神经元细胞进行计数。
1.2.4.4体质量变化 MPTP具有全身毒性作用,会导致小鼠发生营养障碍,体质量下降。分别在皮下注射前1天,注射第1天,注射第7天,最后1次注射后第7天对3组小鼠进行称重,比较3组动物的体质量变化。
1.2.4.5胃肠道功能 配置淀粉糊:向125 mL蒸馏水中添加5.0 g羧甲基纤维素钠,8.0 g奶粉,4.0 g蔗糖,4.0 g淀粉,1.5 g活性炭末,搅拌配置成均匀的糊状物。所有小鼠在最后一次注射MPTP/生理盐水后第7天处死前18 h进行禁食,然后进行淀粉糊灌胃,灌胃剂量0.025 mL/g,灌胃后20 min处死小鼠,结扎幽门和贲门,分离胃和小肠,称胃的质量,质量记为M;对胃进行解剖除去内容物生理盐水冲洗晾干,再次称重,记为m。同时平铺小肠,测量幽门至盲肠的长度L1、幽门至小肠中淀粉糊处的长度L2。胃排空率=[1-(M-m)/灌胃质量]×100%;小肠推进率=L2/L1×100%。
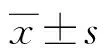
2 结 果
2.1脑组织中GDNF在mRNA水平的表达 在移植GDNF的慢病毒骨髓干细胞转染后,GDNF在小鼠脑组织中成功表达,并且从第1周到第8周小鼠脑组织中GDNF的表达逐渐增强,见图1。
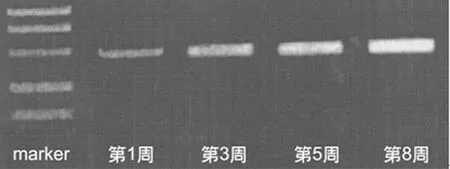
图1 实验组小鼠脑组织中GDNF的表达
2.2行为学观察 注射MPTP/生理盐水造模第1、7天,以及最后1次注射后7 d,3组小鼠爬杆时间比较差异有统计学意义(P<0.05),实验组小鼠爬杆时间明显长于健康组且短于对照组(P<0.05)。注射MPTP/生理盐水造模第7天,以及最后1次注射后7 d,3组小鼠转棒停留时间差异有统计学意义(P<0.05),实验组小鼠停留时间明显短于健康组且长于对照组(P<0.05),见表1。
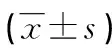
表1 3组小鼠爬杆时间和转棒停留时间比较
a:P<0.05,与对照组比较;b:P<0.05,与健康组比较
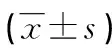
表2 3组小鼠体质量变化比较
a:P<0.05,与对照组比较;b:P<0.05,与健康组比较
2.3TH+多巴胺能神经神经元数目 对照组、实验组和健康组小鼠的TH+多巴胺能神经神经元数目分别为:(8 610.26±833.64)、(1 117.54±1 037.18)、(1 369.87±1 440.16)×10-4/μm3。3组两两比较差异有统计学意义(P<0.05)。免疫组织化学染色结果显示实验组小鼠黑质中的TH+多巴胺神经元纤维比对照组更密,颜色更深;实验组小鼠黑质中的TH+巴胺神经元纤维比健康组更疏,颜色更浅,见图2。

A:健康组;B:对照组;C:实验组
图2 3组小鼠黑质中TH+多巴胺神经元染色结果(×20)
2.4体质量变化 造模前1 d 3组小鼠体质量无明显差异;注射MPTP/生理盐水第1、7天,以及最后1次注射后7 d时3组小鼠体质量比较差异有统计学意义(P<0.05),其中实验组小鼠注射第7天及注射后7 d体质量均明显低于健康组且高于对照组(P<0.05),见表2。
2.5胃肠道功能 实验组小鼠的胃排空率、小肠推进率均明显低于健康组且高于对照组(P<0.05),见表3。
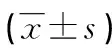
表3 3组小鼠的胃排空率和肠推进率比较
a:P<0.05,与对照组比较;b:P<0.05,与健康组比较
3 讨 论
PD是因多巴胺能神经元发生退行性变化而导致神经退化坏死所致,其临床特征主要为运动障碍。此外,98%以上的患者还会出现非运动障碍,其中胃肠道功能障碍是PD患者最明显的非运动障碍,发生率约为80%[7]。目前PD尚无根治之法,临床治疗以缓解患者症状为主,既不能恢复坏死的神经元也不能很好地终止病理进程。GDNF是目前公认最佳神经保护因子,具有促进神经细胞分化和再生长的功能[8]。但GDNF是一种大分子,直接注射难以透过血脑屏障,疗效不佳。GDNF基因修饰是改善PD的最有效途径,但目前尚处于动物实验摸索研究阶段[9]。慢病毒载体介导通过基因重组构建表达GDNF的慢病毒,再包装、注射进入体内,免疫反应小,安全性高[10]。本文通过慢病毒质粒巨噬细胞获得表达GDNF的慢病毒质粒并进行转染,使得GDNF在小鼠脑组织中成功表达。
本文采用爬杆试验、转棒试验比较3组小鼠的运动协调能力。结果表明,实验组小鼠的运动协调功能明显优于对照组并明显弱于健康组,巨噬细胞介导基因治疗能有效改善PD小鼠的运动障碍。PD发病的一个最重要原因是其脑内黑质中的多巴胺含量下降,导致神经元细胞受损。MPTP的体内代谢产物能够通过抑制多巴胺合成酶TH的活性来降低小鼠黑质中多巴胺含量[11];TH是多巴胺合成的限速酶[12]。本研究中实验组小鼠脑组织中神经元数目明显低于健康组且高于对照组(P<0.05)。免疫组织化学染色结果显示,实验组小鼠黑质中的TH+多巴胺神经元纤维比对照组更密集,颜色更深,比健康组更疏,颜色更浅。说明GDNF基因移植后能明显促进小鼠脑组织中的神经元细胞的再生,改善修复受损的神经元。分析认为通过基因工程改造后的骨髓干细胞经过小鼠尾静脉移植能够跨过血脑屏障,与局部组织整合,并表达GDNF,进一步通过丝裂原活化蛋白激酶-蛋白激酶C信号通路提高TH阳性表达[13],提高多巴胺的合成,抑制神经元细胞凋亡,有助于神经纤维修复[14]。段奎甲等[15]通过GDNF基因修饰神经干细胞并移植PD大鼠体内发现GNDF基因修饰移植的大鼠较GFP基因移植的大鼠的多巴胺神经元分化更多,其TH+阳性表达也明显更高,该方法能够明显改善PD大鼠的运动障碍,与本文研究结果类似。
除了典型的运动障碍、神经元损害外,PD患者胃肠道功能障碍的中最明显的表现是胃排空延迟;胃肠道功能损害会进一步引起体质量下降,并且随着病情发展,胃肠道功能障碍会随之加重[16]。本研究结果发现注射MPTP第1天对照组和实验组小鼠表现出明显的体质量下降,且对照组明显低于实验组;造模第7天及造模后第7天对照组小鼠体质量无明显变化,对照组和试验组小鼠体质量明显下降,且对照组明显低于实验组。同时实验组小鼠的胃排空率、小肠推进率均明显低于健康组且高于对照组,说明实验组小鼠的胃排空功能和肠道蠕动明显优于对照组但明显弱于健康组,GDNF的基因治疗能明显改善PD小鼠的胃肠道功能障碍。研究认为PD患者发生胃肠功能障碍的原因可能是脑组织中的中枢神经系统发生变性退化,导致神经递质的减少,对胃肠道蠕动的调控变弱[17]。同时有学者报道PD大鼠体内的胃肠道多巴胺神经元数量明显低于健康大鼠[18]。分析认为小鼠移植表达GDNF的巨噬细胞,能够促进脑组织中多巴胺合成,修复与胃肠道蠕动相关的受损神经,改善PD小鼠的胃肠道功能障碍。
综上所述,GDNF基因疗法治疗PD小鼠能够明显改善PD小鼠的运动障碍,促进脑组织中受损的TH阳性神经元细胞再生,修复神经纤维,提高胃肠道蠕动,改善胃肠道功能障碍。但是其具体机制尚不清楚,还需要进行进一步的分子生物学研究。
