多发性硬化的疾病修正治疗研究进展
2018-08-29刘翕然张星虎
刘翕然 张星虎
作者单位:100050 首都医科大学附属北京天坛医院神经感染与免疫科
多发性硬化(multiple sclerosis,MS)是一种以中枢神经系统(central nervous system,CNS)白质炎症性脱髓鞘病变为主要特点的免疫介导性疾病。病理学特征表现为炎性反应、髓鞘脱失、胶质增生,而轴突相对完好[1]。北美和欧洲人群的MS患病率较高〔(108~140)/10万〕,东亚人群的患病率较低(2.2/10万)[2]。在我国尚缺乏确切、系统的MS流行病学资料,一项来自上海的基于医院调查的数据显示,MS患病率约为1.39/10万,男女患病比约为1∶1.8[3]。MS具有复发缓解及进展的临床特点,是重要的致残性疾病。美国调查数据显示,MS患者从发病至行动困难的中位时间为8年,这严重影响患者的生活质量和工作能力,从而造成沉重的社会经济负担[4]。
根据疾病的临床演变,MS分为复发缓解型(relapsing-remitting MS,RRMS)、原发进展型(primary progressive MS,PPMS)和继发进展型(secondary progressive MS,SPMS)[5]。早期研究中尚有进展复发型(progressive-relapsing MS,PRMS)的分类,目前,这一分类已被归入PPMS范畴。80%~85%的MS患者最初为RRMS,表现为临床多次发作,通常在疾病早期经过治疗或自行缓解甚至可以完全恢复。采用高灵敏度定量脑磁共振成像(magnetic resonance imaging,MRI)可在每次发作时检测到新发病灶[6]。但每年有2%~3%的RRMS转化为SPMS,最终有40%的RRMS会转化为进展型[7]。疾病修正治疗(disease-modifying treatment,DMT)是MS缓解期的标准治疗,可在不同程度上减少RRMS患者的临床发作和MRI活动性,但大多数DMT药物无法影响进展期患者的疾病进程。
20世纪90年代以前,MS的治疗仅限于在急性期采用糖皮质激素治疗。其后20年间,不同干扰素β注射剂(包括干扰素β-1a、-1b)和醋酸格拉替雷(glatiramer acetate,GA)成为复发型MS患者缓解期的一线标准治疗。2010年以后,随着DMT口服药物及单抗制剂上市,MS患者DMT治疗有了更多用药途径,使用更便捷、灵活的治疗选择。MS的治疗目标也从单纯减少复发率和延缓残疾进展,发展为预防所有新出现的疾病活动[8]。目前国外已有超过10种DMT药物上市,本文拟对不同药物的作用机制、疗效、安全性和DMT治疗策略进行综述。
1 全球和中国获批上市的DMT药物
在美国食品药品监督管理局(Food and Drug Administration,FDA)获批上市的MS DMT药物如表1所示,其中干扰素β-1b与干扰素β-1a在中国获批用于MS患者,米托蒽醌也在中国获批,但适应证仅限于各种恶性肿瘤,并不包括MS。
2 各类药物的作用机制、疗效和安全性
各类药物相关疗效和安全性评价的Ⅲ期临床试验资料见表2。
2.1干扰素β干扰素β治疗MS的作用机制尚未完全阐明,可能与抑制T细胞活化、改变T细胞在血脑屏障内外的分布以及调控细胞因子间平衡有关[9]。迄今共有5种干扰素β制剂获美国FDA批准用于RRMS治疗,包括1993年基于IFNB研究[10]获批的干扰素β-1b(倍泰龙)和同年基于MSCRG研究[11]获批的肌内注射型干扰素β-1a,以及2002年基于PRISMS研究[12]获批的皮下注射型干扰素β-1a和2014年基于ADVANCE研究[13]获批的聚乙二醇干扰素β-1a;此外还有一种化学名干扰素β-1b(Extavia)在2009年获批。各种皮下注射型干扰素治疗RRMS的有效性相当,肌内注射型干扰素β-1a疗效相对较弱。皮下注射型干扰素使用1~3年后可使患者的年度复发率(annualized relapse rate,ARR)降低27%~36%,并可有效减少脑部MRI新发病灶和延缓由扩展残疾状态量表(expanded disability status scale,EDSS)评估的残疾进展[10,12-13]。肌内注射型干扰素β-1a可使患者的ARR降低18%[11]。但接受干扰素治疗的患者中约20%~40%(干扰素β-1b:45%~47%;干扰素β-1a:12.5%~23.8%)会出现中和抗体[10-12],降低此类药物的疗效[14]。

表1 美国FDA获批上市的MS DMT药物
注:表中所有信息参考自各药物美国FDA获批说明书和网站信息;a建议用于对至少2种MS治疗药物应答不佳的患者;CIS,临床孤立综合征;PPMS,原发进展型多发性硬化;PRMS,进展复发型多发性硬化;RRMS,缓解复发型多发性硬化;D1:第1天;D15:第15天
2.2GA此药物是人工合成的肽类制剂,可通过抑制髓磷脂碱性蛋白(myelin basic protein,MBP)激活T细胞,同时诱导产生Th2细胞发挥免疫调节和神经保护作用[9]。GA 20 mg 1次/d方案于1996年基于Copolymer 1 MS研究[15]获批,40 mg每周三次方案于2014年基于GALA研究[16]获批。上述研究[15-16]以及一项在欧洲/加拿大进行的GA研究[17]显示,GA可使RRMS患者的ARR下降29%~34%,并减少MRI增强病灶数量。
2.3米托蒽醌米托蒽醌是一种人工合成的强效广谱免疫抑制剂,可进入血脑屏障抑制免疫细胞增殖,减少免疫反应[18]。2000年,基于一项米托蒽醌单药治疗的Ⅲ期MIMS研究[19]和一项米托蒽醌联合甲泼尼龙治疗的Ⅱ期研究[20],米托蒽醌获美国FDA批准用于SPMS、PRMS和恶化的RRMS患者。

表2 各类型DMT药物的主要Ⅲ期临床试验

续表2 各类型DMT药物的主要Ⅲ期临床试验
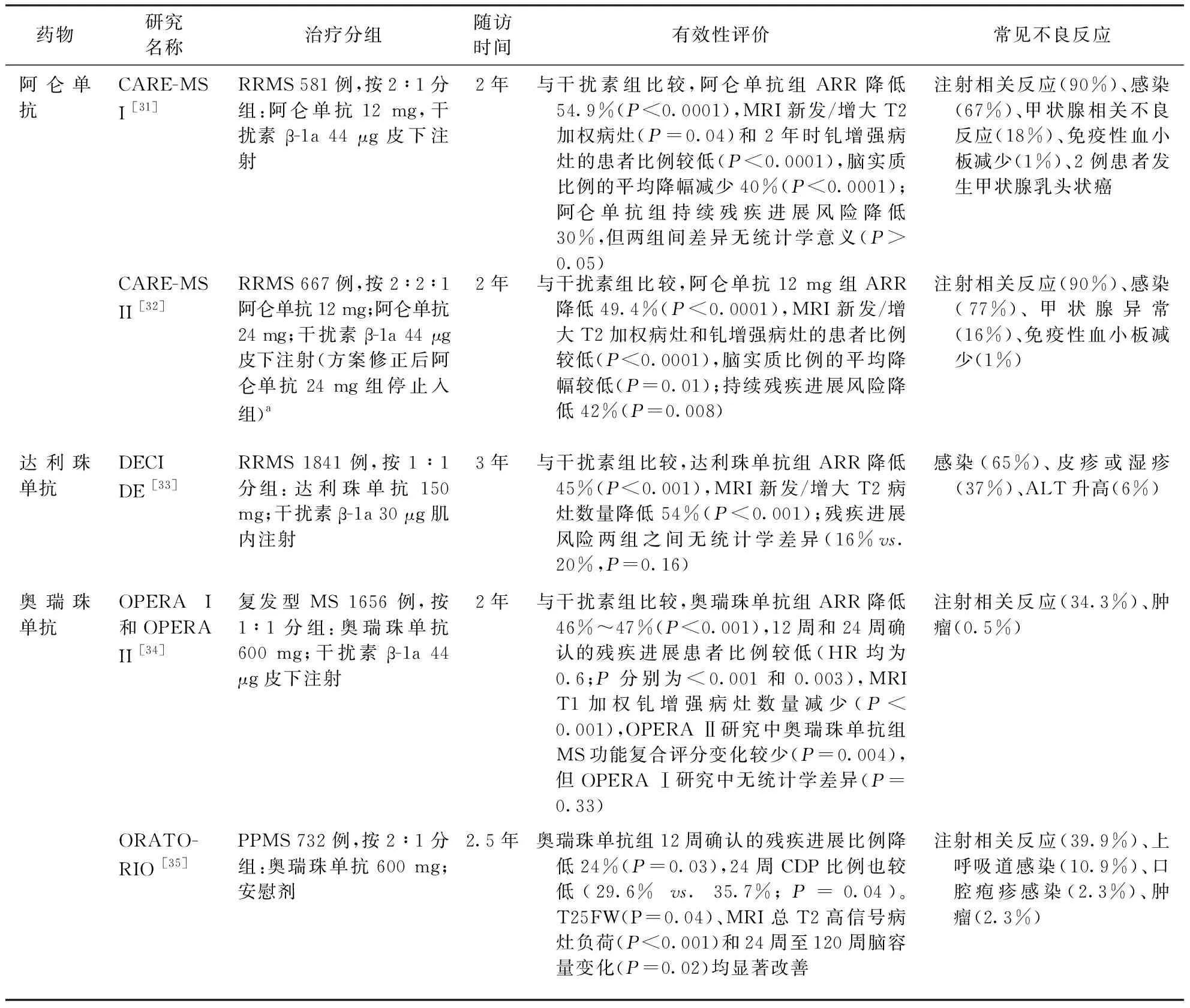
续表2 各类型DMT药物的主要Ⅲ期临床试验
注:ARR:年度复发率;CDP:经确认的残疾进展;DMF:富马酸二甲酯;EDSS:扩展残疾状态量表;GA:醋酸格拉替雷;HR:风险比;MS:多发性硬化;PPMS:原发进展型多发性硬化;RRMS:复发缓解型多发性硬化;SPMS:继发进展型多发性硬化;T25FW:25英尺步行时间;a:2007年10月27日开始患者招募,2008年11月方案修正后阿仑单抗24 mg组停止入组,该组患者数据纳入安全性分析
2.4芬戈莫德该药是一种鞘氨醇-1-磷酸(sphingosine-1-phosphate,S1P)受体调节剂,通过与淋巴细胞上的S1P受体结合阻止其从淋巴组织中释出,减少其渗入CNS引起MS病灶[36]。2010年,芬戈莫德基于FREEDOMS研究[21]和TRANSFORMS研究[22]获批用于复发型MS患者。上述两项研究以及后续开展的FREEDOMSⅡ研究[23]显示,芬戈莫德0.5 mg 1次/d可使RRMS患者的ARR降低48%~54%,减少新发MRI病灶方面的效果优于安慰剂和肌内注射干扰素β-1a(表2)[21-22]。但该药对残疾进展的作用在不同研究中未得到一致性结论:FREEDOMS研究显示芬戈莫德组患者残疾进展风险降低(HR=0.7,P=0.02),而在TRANSFORMS研究和FREEDOMSⅡ研究中,芬戈莫德组和对照组患者的残疾进展比例无明显差异(均P>0.05)[22-23]。在安全性方面,由于S1P可表达于人体多种组织,芬戈莫德与人体多种组织上表达的S1P受体结合可导致相应的不良反应,包括淋巴细胞减少、心动过缓、房室传导阻滞、视网膜黄斑水肿等[37]。此外,2015年美国FDA报告发现2例患者在芬戈莫德治疗期间发生确诊或可疑的进行性多灶性脑白质病(progressive multifocal leukoencephalopathy,PML)。这是一种由John Cunningham病毒(John Cunningham virus,JCV)导致的CNS感染,可导致死亡或不可逆的神经损伤且目前仍无有效治疗。
2.5特立氟胺此药是抗风湿病药物来氟米特的主要活性代谢物,其通过抑制嘧啶从头合成途径中的关键线粒体酶——二氢乳清酸脱氢酶,减少活化T细胞、B细胞增殖,CNS淋巴细胞浸润和轴突丢失,从而保护神经系统功能[38]。特立氟胺于2012年基于Ⅲ期TEMSO研究[24]获得美国FDA批准。TEMSO研究和另一项Ⅲ期TOWER研究显示,与安慰剂比较,小剂量(7 mg)和大剂量(14 mg)特立氟胺可使RRMS患者的ARR降低22.3%~36.3%,并可减少MRI增强病灶数量和体积(表2);特立氟胺14 mg可使患者的残疾进展风险显著降低29.8%~31.5%[24-25]。此外,在与皮下注射干扰素β-1a(44 μg,每周3次)头对头比较研究中,两种剂量特立氟胺的治疗失败率(研究主要终点,定义为任何原因的停药或经过确认的疾病复发)与干扰素组相似;14 mg组患者的ARR(次要终点)与干扰素组相当[26]。近期对TEMSO研究的MRI数据分析显示,与安慰剂组比较,特立氟胺可显著减少患者的脑容量损失(14 mg组治疗1年和2年时分别减少36.9%和30.6%,P值均为0.0001)[39]。
2.6富马酸二甲酯(dimethylfumarate,DMF) DMF作用机制尚未完全明确,一般认为与参与细胞对氧化应激应答的核因子红系相关因子2(Nrf2)途径相关。DMF在2013年基于DEFINE研究[28]和CONFIRM研究[27]获批。此两项研究结果显示,DMF 240 mg每日两次方案可使RRMS患者的ARR降低44%~53%,MRI病灶数量减少;但此两项研究在DMF能否减少患者残疾进展方面未得出一致结论[27-28]。美国FDA曾报告1例接受DMF治疗的患者发生PML并死亡。
2.7单克隆抗体
2.7.1那他珠单抗:此药是一种选择性作用于淋巴细胞和单核细胞表面的细胞黏附分子α4整合素的人源化单克隆抗体,可阻止免疫细胞迁移至CNS[40]。那他珠单抗于2004年基于AFFIRM研究[29]和SENTINEL研究[30]获批。AFFIRM研究显示,那他珠单抗单药可使RRMS患者的ARR降低68%,减少残疾进展风险和MRI病灶数量[29];SENTINEL研究显示,那他珠单抗联合肌内注射型干扰素β-1a治疗的效果优于干扰素单药加安慰剂组(ARR相对降低54%,P<0.001)[30]。那他珠单抗治疗中主要的安全性问题是PML风险,在SENTINEL研究(n=1171)中即有2例患者出现PML,其中1例死亡[30]。上市后数据显示,在所有接受那他珠单抗治疗的患者中,PML的发生率为4.22/1000例患者[41]。
2.7.2阿仑单抗:此药是一种作用于单核细胞和淋巴细胞表面的CD52的人源化单克隆抗体,可使T细胞、B细胞和单核细胞耗竭而减少炎性反应。2014年,阿仑单抗基于CARE I[31]和CARE II[32]两项Ⅲ期临床研究结果获批用于复发型MS患者。这两项研究结果显示,与皮下注射干扰素β-1a比较,阿仑单抗可使ARR降低49.4%~54.9%,并减少MRI钆增强病灶[31-32]。
2.7.3达利珠单抗:此药是一种与高亲和力IL-2受体α亚基(CD25)结合的人源化单克隆抗体,可通过阻断IL-2信号抑制CD4和CD8阳性T细胞活化并减少炎性反应[42]。达利珠单抗于2016年基于Ⅱb期SELECT研究和Ⅲ期DECIDE研究获批。在这两项研究中,达利珠单抗150 mg可使RRMS患者的ARR降低,减少MRI活动病灶的效果也优于安慰剂和干扰素组[33,43]。
2.7.4奥瑞珠单抗:此药是一种二代抗CD20 IgG1单克隆抗体,可通过多种途径诱导B细胞耗竭[44]。2017年,奥瑞珠单抗基于OPERAⅠ和OPERAⅡ研究[34]获批用于复发型MS患者,基于ORATORIO研究获批用于PPMS患者。奥瑞珠单抗用于复发型MS患者时,与皮下注射干扰素β-1a比较,ARR降低46%~47%;残疾进展和96周时达到无疾病活动证据(定义为无复发、确认的残疾进展或MRI活动)复合终点等指标均优于干扰素组[34];用于PPMS患者时,可有效改善多项神经功能和MRI指标[35]。
3 DMT治疗策略和路径
DMT治疗策略的选择取决于MS患者的疾病活动程度(近期发作频度、严重程度和恢复情况)、神经功能损害程度、脑和脊髓MRI中显示的“病灶负担”、药物可及性和费用、合并证和联合用药、不良反应、监测需求、患者偏好等。对于MS这种需要长期治疗的疾病,尤其在疾病早期,其用药可能优先考虑患者偏好(如患者希望避免注射或特定不良反应)。但疾病活动性更高的患者,尤其是遗留神经功能缺损的患者,更有可能接受风险较高且疗效更强的治疗。
2018年美国神经病学学会(American Academy of Neurology,AAN)指南[45]提出,对复发型MS应予DMT治疗,如治疗中患者维持稳定(即无复发、无残疾进展、影像学表现稳定)应维持当前的DMT方案。根据ANN指南的推荐意见[45]和2014年丹麦学者提出的RRMS治疗路径[46],RRMS的DMT一线治疗可选择特立氟胺、DMF、干扰素β或GA,并同时考虑不良反应因素和之前用药背景。如MS活动性较高,可选择那他珠单抗(抗JCV抗体阴性),或依次考虑选用芬戈莫德、奥瑞珠单抗(抗JCV抗体阳性)。如一线疗效不佳或不能耐受不良反应,二线治疗可选择那他珠单抗(抗JCV抗体阴性),或依次考虑选用芬戈莫德、奥瑞珠单抗或阿仑单抗(抗JCV抗体阳性)。如果治疗效果仍不理想,可考虑米托蒽醌或三线治疗药物(包括部分尚处于试验阶段的DMT策略)。需注意的是,数年内有备孕计划的育龄期女性,可不选用特立氟胺;DMF和芬戈莫德的PML风险有待进一步评估。由于安全性原因,建议阿仑单抗和米托蒽醌用于对至少2种DMT药物应答不佳的患者。
根据2018年AAN指南[45]建议,对于SPMS患者,应全面评估年龄、病程、复发病史和MRI表现的疾病活动度后决定是否给予DMT治疗,如患者无持续复发(或无MRI钆增强活动性病灶),有复发或新发活动性病灶的SPMS患者可从DMT治疗中获益,对可能从DMT治疗中获益的PPMS患者应给予奥瑞株单抗治疗。对存在残疾的患者,干扰素可降低复发风险,但不能延缓残疾进展。
综上可见,过去20年中,MS的治疗取得了很大进展;目前已证实有10余种DMT药物可改变疾病的短期和中期自然病史。不同DMT药物对长期残疾的改善作用、长期获益风险比等仍有待进一步观察。此外,当前MS的治疗效果评估均基于临床表型或影像学证据(复发、进展),缺乏可预测治疗反应的早期特异性生物标志物;随着新的遗传学检测技术在MS研究中的引入,临床已开展了许多MS的药物基因组学研究,这些研究结果将为阐明MS的个体异质性,从而在实现个体化治疗方面提供潜在的临床指导意义,目前这些研究尚处早期阶段。当前中国MS患者的治疗困境是用于预防复发的药物选择有限,目前仅有干扰素β-1b、干扰素β-1a,以及特立氟胺在中国获批用于MS患者。不过,目前国内已有多个进口原研药物申报注册,也有多家国内药企申报原料药和制剂。随着这些药物的获批上市,中国MS患者有望尽快摆脱这一困境。
志谢
作者在文章撰写过程中接受了赛诺菲(中国)资助的编辑/撰写支持。但是,作者对所有内容及编辑决策负完全责任。作者未就撰写文章本身接受任何其他形式的酬劳。
