莲房原花青素改善老化大鼠学习记忆功能的机制
2018-08-29聂淑科高慧许继取张振涛张允建刘烈刚张兆辉
聂淑科 高慧 许继取 张振涛 张允建 刘烈刚 张兆辉
作者单位:430060 武汉大学人民医院神经内科(聂淑科、张振涛、张兆辉);430030 华中科技大学同济医学院附属同济医院营养科(高慧);430062 中国农业科学院油料作物研究所(许继取);430022 华中科技大学同济医学院附属协和医院神经内科(张允建);430030华中科技大学同济医学院公共卫生学院营养与食品卫生系(刘烈刚)
原花青素是一种多酚化合物,具有抗肿瘤、抗氧化等生物活性[1]。莲房原花青素(lotus seedpod procyanidins,LSPC)是莲房的主要活性成分之一,是一种氧自由基清除剂和脂质过氧化抑制剂,具有降低毛细血管通透性、抗氧化、增强心血管活性等多种生物活性和药理作用[2-3]。血红素氧合酶(hemeoxygenase,HO)是血红素代谢的限速酶,能够催化血红素代谢生成胆绿素、Fe2+和一氧化碳(carbon monoxide,CO)。研究证明HO及其催化产物具有抗氧化应激、抗炎、抗细胞凋亡以及抗血小板聚集的作用[4]。HO包括HO-1、HO-2和HO-3 3种形式同工酶。HO-1基因定位于染色体22q12,又称为热休克蛋白32(hot shock protein32,HSP32),主要分布于外周组织单核巨噬细胞系统的微粒体内,血红素、氧化应激、紫外线照射、高温等各种氧化应激因素可明显诱导其表达[5]。HO-2基因定位于染色体16p13,主要表达于中枢神经系统,在大鼠的前脑、嗅球区、海马、中脑、基底节、丘脑区、小脑和脑干神经元均有强而稳定的HO-2表达[6-7]。二者参与了神经损伤修复和神经元退行性变等中枢神经系统的病理和生理过程。
作者团队前期研究发现,LSPC能够改善东莨菪碱所致小鼠学习障碍,并通过抑制脑组织乙酰胆碱酯酶(AChE)活性提高脑组织内乙酰胆碱(ACh)水平[8]。然而LSPC干预对正常衰老所致的老年认知功能障碍大鼠中枢神经系统HO的表达是否有调控作用尚不清楚。本实验通过构建自然衰老的老化大鼠模型,检测其行为学指标并观察HO-1、HO-2在脑组织中的表达变化,旨在进一步阐明LSPC对脑衰老的保护作用及其机制,为LSPC在抗衰老方面的研究提供实验依据。
1 材料和方法
1.1实验动物和分组13月龄健康雌性SD老年大鼠200只,购自上海Sippr-BK联合实验动物供应中心,恒温〔(24±1)℃〕、昼夜交替(08:00~20:00)条件下给予普通饲料喂养,自由饮水。4个月后,从相同动物供应中心购买3月龄年轻雌性SD大鼠40只,相同条件下喂养1个月,然后行Morris水迷宫进行老年认知功能障碍大鼠的筛选。喂养期间剔除患呼吸道疾病、感染和肿瘤的大鼠。以40只4月龄年轻雌性SD大鼠Morris水迷宫实验中第3~5天的平均潜伏期为基础,从200只18月龄雌性SD大鼠中筛选出老年认知功能正常(aged unimpaired,AU;其平均潜伏期小于年轻大鼠3个标准差)大鼠和老年认知障碍(aged impaired,AI;其平均潜伏期大于年轻大鼠0.5个标准差)大鼠。从40只4月龄年轻SD大鼠中随机选取12只作为年轻对照组,从AU大鼠中随机选取12只作为AU组,另随机选取36只AI大鼠并随机分为AI组、低剂量LSPC干预组〔50 mg/(kg·d),以下简称L-LSPC组〕、高剂量LSPC干预组〔100 mg/(kg·d),以下简称H-LSPC组〕。
1.2主要材料和仪器LSPC(由华中农业大学提供),大鼠HO-1和HO-2酶联免疫试剂盒(美国LifeSpan BioSciences公司)、Morris水迷宫(Columbus 公司Videomex-v型)、低温高速离心机(德国Eppendorf公司)、-80℃低温冰箱(日本SANYO公司)、电动匀浆器(美国Terre Haute公司)、不同规格微量加样器(德国Eppendorf公司)、FA1604电子天平(上海天平仪器厂)由同济医学院基础医学院和公共卫生学院科学研究公共平台提供。
1.3方法
1.3.1给药干预:将LSPC采用生理盐水溶解后,分别按体质量50、100 mg/(kg·d)给予L-LSPC组和H-LSPC组大鼠灌胃给药〔1 mL/(100 g·d)〕,年轻对照组、AU组和AI组大鼠给予等剂量生理盐水灌胃,持续灌胃给药8周。
1.3.2Morris水迷宫实验:灌胃干预8周后行Morris水迷宫行为学测试。Morris水迷宫中水池被划分为Ⅰ、Ⅱ、Ⅲ、Ⅳ四个象限区域,将平台置于第Ⅲ象限正中距离池壁40 cm处,水面高于平台顶1 cm,加入墨汁染色,以从水面无法看见平台为准。首先练习站台,将SD大鼠首先放于平台上1 min适应性训练后,再将大鼠面向水池池壁从除平台所在象限之外的其他3个象限中分别放入水中1次,记录90 s内SD大鼠从入水到爬上平台所需时间,即为逃避潜伏期(escaping latency),如果SD大鼠在90 s内能够找到平台,使其在平台上停留10 s,同时记录潜伏期;若90 s内未找到平台,则实验员将其引导至平台上同样停留10 s,将潜伏期记录为90 s。大鼠从放入池中到找到平台所游过的距离,即为游泳距离(swimming distance)。在平台停留10 s后间隔3 min再进行一次,每天重复3次,连续5 d。水池上方安置带有显示系统的摄像机,同步记录大鼠运动轨迹和时间,并将图像和数据传输至计算机由Ethovision系统软件进行分析。
1.3.3HO-1和HO-2水平检测:完成行为学测试后,于冰盘上断头处死大鼠,迅速分离大脑皮质及海马,分别用冰冷生理盐水冲洗,滤纸吸干,精密称重,加入50 mmol/L冷磷酸盐缓冲液(pH 7.0)剪碎,制成5%皮质及海马组织匀浆,分别置-20℃过夜,反复冻融2次破坏细胞膜后,以4℃ 3500 r/min(离心半径=10 cm)离心10 min,取上清液,采用酶联免疫法检测HO-1与HO-2水平。首先配置标准液以及倍比稀释标准品:从试剂盒中取出标准品,以8000 r/min(离心半径=10 cm)离心30 s,用1 mL样本稀释液稀释,并用枪头对准冻存管底部反复吸打5次,充分溶解、混匀后,得到标准品S7,给予标准品倍比稀释,配置洗涤工作液、生物素标记抗体工作液、辣根过氧化物酶标记亲和素工作液。严格按照大鼠HO-2和HO-1酶联免疫试剂盒说明书步骤操作。反应终止后5 min内,采用酶标仪检测450 nm处各孔的吸光度〔D(λ)〕值,绘制标准曲线。根据标准曲线计算各样本HO-1和HO-2水平。
1.4统计学处理应用SPSS22.0统计分析软件进行统计分析,对数据进行正态性和方差齐性检验,符合正态分布的计量资料以均数±标准误表示,各组大鼠Morris水迷宫结果比较采用重复测量的多因素方差分析,分析时间、分组因素的作用及时间和分组之间的交互作用(时间×分组),对每个时间点上5个分组之间行LSD两两比较;各组大鼠HO-1、HO-2表达水平比较采用单因素方差分析,组间两两比较采用LSD法。以P<0.05为差异有统计学意义。
2 结果
2.1Morris水迷宫实验结果比较各组SD大鼠第1~5天逃避潜伏期呈缩短趋势,时间和分组间无交互作用(F时间=47.278,P时间<0.01;F组别=13.797,P组别<0.01;F交互作用=1.261,P交互作用=0.222)。AI组大鼠平均潜伏期较年轻对照组大鼠延长(P<0.05或P<0.01)。L-LSPC组、H-LSPC组第1~5天平均潜伏期也呈缩短趋势,H-LSPC组大鼠平均潜伏期与年轻对照组和AU组大鼠比较差异无统计学意义(均P>0.05),H-LSPC组大鼠第3~5天平均潜伏期明显短于AI组(P<0.05)。结果见表1。
各组SD大鼠第1~5天游泳距离呈缩短趋势,时间和分组间无交互作用(F时间=15.376,P时间<0.01;F组别=3.509,P组别=0.008;F交互作用=0.861,P交互作用=0.615)。AU组大鼠第1~5天时间点游泳距离均大于年轻对照组(P<0.05或P<0.01);第4~5天,L-LSPC组大鼠游泳距离较AI组明显缩短(P< 0.05);第3~5天,H-LSPC组大鼠游泳距离短于AI组(P<0.05或P<0.01),而H-LSPC组大鼠游泳距离与年轻对照组和AU组比较无统计学差异(P>0.05)。结果见表2。
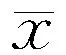
表1 各组大鼠Morris水迷宫实验不同时间点逃避潜伏期比较(±s,n=12,s)
注:AU:老年认知功能正常,AI:老年认知障碍;L-LSPC:低剂量莲房原花青素;H-LSPC:高剂量莲房原花青素;表2~3同。与年轻对照组比较,aP<0.05,bP<0.01;与AI组比较,cP<0.05,dP<0.01
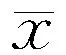
表2 各组大鼠Morris水迷宫实验不同时间点游泳距离比较(±s,n=12,cm)
注:与年轻对照组比较,aP<0.05,bP<0.01;与AI组比较,cP<0.05,dP<0.01
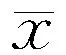
表3 各组大鼠皮质及海马HO-1和HO-2水平比较(±s,n=12,ng/mL)
注:与年轻对照组和AU组分别比较,aP<0.05;与AI组比较,bP<0.01;与L-LSPC组比较,cP<0.01
2.2各组大鼠皮质和海马HO-1和HO-2水平比较各组大鼠皮质HO-1和HO-2表达水平组间比较差异无统计学意义(均P>0.05)。各组海马组织HO-1和HO-2表达存在统计学差异(均P<0.01),与年轻对照组和AU组比较,AI组大鼠海马HO-1水平明显升高(均P<0.01),而海马HO-2水平降低(均P<0.05);与AI组比较,L-HSPC和H-LSPC组海马HO-1水平降低(均P<0.01),而海马HO-2表达水平升高(P<0.01),且H-LSPC组升高海马HO-2水平较L-LSPC组更明显(P<0.01)。结果见表3。
3 讨论
阿尔茨海默病(Alzheimer diseases,AD)是目前最为常见的年龄相关神经系统退行性疾病,可供选择的有效治疗手段非常有限,仍不可治愈,给社会和家庭带来了沉重的经济和生活负担[9-10]。研究AD认知功能障碍的动物模型很多,包括有急性胆碱能功能障碍动物模型,有基于AD特征性病理产物β淀粉样蛋白和tau蛋白的众多转基因动物模型(如BACE1敲除基因动物模型、3XTg-AD动物模型等),遗传学模型大多基于家族遗传性认知功能障碍,急性胆碱能功能障碍所致的痴呆在临床亦不常见,而目前临床中的痴呆患者多数为慢性散发型AD,这也是为何目前有关AD众多治疗手段在临床前期无法转化应用于临床治疗的关键原因[11-12]。本研究选取的SD大鼠为自然衰老的认知功能障碍模型,能够尽可能地模拟占多数患者的散发型AD的病情及病理进程,旨在为其认知功能障碍的干预治疗提供可能的选择。
HO所涉及的氧化应激系统是老化所致认知功能障碍的机制之一,神经元的氧化应激与HO系统的活性特别是HO-1和HO-2蛋白的活性相关。研究人员发现胶质细胞HO-1的过度激活参与细胞的氧化应激过程,引起病理性的铁沉积和能量利用障碍,进一步加剧神经组织的退行性变[13];同时HO-2在神经递质即内源性CO的产生中发挥重要作用,HO-2能够维持并改善学习记忆及认知功能[14-15]。CO对于维持长时程增强(long-term potentiation,LTP)至关重要,HO-2/CO对神经信号传导的调控与年龄相关学习记忆认知障碍密切相关。Raju等[16]研究发现位于HO-2基因启动区域的功能性皮质类固醇反应元件(glucocorticoid response element,GRE)能够调控脑组织HO-2表达水平,GRE与GRs的结合可激活HO-2基因的转录,因此HO系统可以作为痴呆的干预靶点。
研究发现,LSPC具有较强的抗氧化活性[3],能够抑制脑组织脂质过氧化反应,蛋白质的氧化反应和年龄相关的DNA氧化损伤[17]。作者团队前期研究发现LSPC能够改善东莨菪碱所致小鼠学习障碍,并通过抑制脑组织AChE活性提高脑组织内ACh水平[8]。然而LSPC干预对正常衰老所致的老年认知功能障碍大鼠中枢神经系统HO系统的表达是否有调控作用尚不得而知。研究发现,LSPC能够降低AI大鼠海马诱导型一氧化氮合酶的表达和活性,调节海马神经元型一氧化氮合酶磷酸化抑制年龄相关性的NO过表达,增加海马NO-sGC-cGMP信号转导从而改善AI大鼠的认知功能[18]。同时LSPC也可通过细胞外信号调控激酶介导的通路活化海马CREB改善AI大鼠的空间学习记忆能力[19]。Takahashi等[20]在AD的研究中发现,HO可能与淀粉样前体蛋白相结合进而抑制HO的活性引起神经元凋亡。本研究结果显示,AI组大鼠Morris水迷宫实验平均潜伏期较年轻对照组大鼠延长,游泳距离较年轻对照组增加,经LSPC干预后,H-LSPC组大鼠3~5 d平均潜伏期明显短于AI组,游泳距离短于AI组;与年轻对照组和AU组比较,AI组大鼠海马HO-1水平明显升高,海马HO-2水平降低,给予LSPC干预能够降低海马HO-1表达水平,增加海马HO-2表达水平,提示LSPC可明显改善老年脑老化大鼠的记忆功能,其机制可能通过降低大脑海马组织HO-1水平,上调HO-2表达水平来发挥神经保护作用。LSPC如何调控中枢神经系统HO系统的表达,是否通过GRE作用于HO-2基因的启动子区域,LSPC是否能够阻断HO系统与淀粉样前体蛋白的结合进而发挥神经保护作用,LSPC对AD的其他特征性病理改变如tau蛋白的过度磷酸化及神经纤维缠结的形成有无改善作用,均需进一步研究证实。
综上所述,本研究结果显示,LSPC可明显改善老年脑老化大鼠的记忆功能,其机制可能通过降低大脑海马组织HO-1水平、上调HO-2表达水平来发挥神经保护作用,提示LSPC作为一种可以通过血脑屏障的药物,对老年认知功能障碍具有一定改善作用,具备一定的临床应用前景,后续更多的机制研究将有助于该药物的进一步转化应用。
