高血压导致认知功能损害与海马区TLR4的相关性
2018-08-29高福林臧沛溪胡小娟张毅
高福林 臧沛溪 胡小娟 张毅
作者单位:730000 甘肃中医药大学(高福林);730000 甘肃省人民医院神经内科〔高福林(在读研究生)、臧沛溪、胡小娟、张毅〕
近年来,脑血管疾病的发病率逐年增加,其导致的认知功能下降给社会带来很多负担。因此,关于大脑功能健康和高血压之间关系的研究越来越受到重视[1-2]。越来越多的证据表明,高血压是认知功能障碍和痴呆病程中重要的危险因素之一,也是最重要的可干预因素。高血压对神经细胞产生损伤的机制尚不完全明确,目前多认为是通过激活炎性反应和释放血管活性物质等使神经细胞受到细胞毒性分子的损害,导致神经元丢失、脑白质损伤,从而导致认知功能衰退[3]。作为Toll样受体(TLR)家族中最为被广泛研究的TLR4,其在炎性反应中的确切作用及其作用机制仍然是一个有争议的话题[4]。有研究表明,TLR4能够识别入侵的病原体,诱导一系列炎性反应产生炎性因子,参与神经炎性反应的调控[5]。自发性高血压大鼠(SHR)作为遗传性高血压实验模型与人体形式的高血压相似,其可发展成慢性严重高血压,随后出现脑血管病变和脑血流减少[6-7]。本研究采用SHR模型探讨高血压导致的认知功能损伤与海马区TLR4表达的变化,进而探讨高血压引起认知功能下降的可能机制。
1 材料和方法
1.1动物和主要试剂12周龄成年雄性SHR大鼠15只、成年雄性WKY大鼠6只,体重240~300 g(购自北京维通利华实验动物技术有限公司)。主要试剂包括TLR4小鼠单克隆抗体(购自美国Santa Cruz公司)、小胶质细胞蛋白抗体(Iba1)兔单克隆抗体(购自美国Abcam公司)、星形胶质纤维酸性蛋白(GFAP)兔单克隆抗体和神经元核抗原(NeuN)兔单克隆抗体(均购自美国Cell Signaling Technology公司),其余均为国产分析纯试剂。
1.2方法
1.2.1鼠尾血压监测:随机取SHR大鼠7只、WKY大鼠4只作为监测对象,12周龄时监测尾静脉压。于早上10点测量,固定大鼠,鼠尾局部加温,待其安静进行血压测量,将加压尾套、脉搏换能器依次套在鼠尾合适位置,采用自动测压仪进行测量,读取收缩压。连续测量3~5次,选取其中3组相对稳定的收缩压取其平均值作为测量值,此后于18、24、30周龄固定时间点监测血压。
1.2.2Morris水迷宫实验:Morris水迷宫检测系统由一个圆柱形水池和图像采集分析系统两部分组成。随机取SHR大鼠7只、WKY大鼠5只作为训练对象,训练开始,将大鼠放入水池中使其熟悉迷宫环境,而后将平台置于第二象限,将受试大鼠按顺时针方向依次由第一、二、三、四象限入水点顺序放入水中,训练完成台上休息15 s再进行下一轮实验。连续训练5天,每天以大鼠4次训练潜伏期的平均值作为大鼠当天的学习成绩,比较两组大鼠每天训练潜伏期的差异。在随后的18、24、30周定期监测大鼠学习记忆能力,以测得不同时间点逃避潜伏期作统计分析来判断两组大鼠学习记忆损害程度。
1.2.3Western blot法检测海马区TLR4蛋白表达:35周龄时随机取7只SHR和3只WKY大鼠,以7%(质量浓度)水合氯醛按体质量0.5 mL/100 g进行腹腔麻醉,断头取海马组织,配制裂解液并与海马组织混合,将海马组织剪碎、匀浆、超声、震荡、离心,取上清液,测定蛋白浓度,水煮蛋白、总蛋白上样量为100 μg,用8%聚丙烯酰胺凝胶电泳(PAGE)分离,印迹到PVDF膜。用5%(质量浓度)脱脂牛奶封闭1 h,后加小鼠抗TLR4(1∶200)4℃过夜。TBST洗3次,加山羊抗小鼠二抗室温孵育1 h,加显影液显影。分析每个特异条带灰度值,以GAPDH为内参,计算各组目的蛋白相对表达量。所有实验均重复3次,取平均值。
1.2.4免疫组化检测海马区TLR4阳性细胞数:35周龄时取剩余8只SHR和3只WKY大鼠,以7%(质量浓度)水合氯醛按体重0.5 mL/100 g进行腹腔麻醉,心脏灌注,断头取脑,4%(质量浓度)甲醛固定大脑后储存于4%PA和10%(质量浓度)蔗糖混合物中,直到脑组织沉底,再储存于30%(质量浓度)蔗糖,直到脑组织沉底。使用低温恒温切片机将脑组织连续切片(厚20 μm),每隔5片取一脑片,0.01 mol/L PBS洗3次,抗原修复,0.3%(体积分数)H2O2孵育30 min。洗片,10%(质量浓度)山羊血清封闭1 h,后加小鼠抗TLR4(1∶100)4℃过夜。洗片,加山羊抗小鼠二抗在37℃下孵育1 h。洗片。与辣根酶标记链霉卵工作液在37℃下孵育1 h。洗片,0.1 mol/L Tris-Hcl洗片。DBA染色,烤片,脱色,树胶封片,显微镜采集图片,计数各组大鼠海马DG区多个不同层面400倍镜下TLR4阳性细胞数。
1.2.5免疫荧光技术检测海马区TLR4、Iba1、NeuN、GFAP阳性细胞数:取按“1.2.4”方法制备的大鼠脑组织切片,每隔5片取一脑片,以0.01 mol/L PBS洗片3次。0.3% (质量浓度)Triton-100细胞核膜打孔,洗片。10%(质量浓度)山羊血清封闭1 h后加小鼠抗TLR4(1∶100)或兔抗Iba1(1∶200)或兔抗GFAP(1∶200)或兔抗NeuN(1∶200)4℃过夜。洗片,加与一抗对应的山羊抗小鼠或山羊抗兔二抗37℃避光孵育1 h。洗片,加DAPI(1∶5000)避光孵育15 min。洗片,树胶封片,荧光显微镜采集图片,计数各组大鼠海马DG区多个不同层面200倍镜下TLR4、Iba1、NeuN、GFAP阳性细胞数。
1.3统计学处理采用SPSS20.0统计软件进行分析,计量资料以均数±标准差表示,两组比较采用独立样本t检验,多组均数比较采用重复测量的ANOVA分析。以P<0.05为差异有统计学意义。
2 结果
2.1鼠尾监测血压和水迷宫实验(1)尾静脉血压:与WYK大鼠相比较,SHR大鼠在各时间点收缩压升高(均P<0.01),此后收缩压一直处于高水平状态。两组大鼠不同时间点比较收缩压差异无统计学意义(FSHR=0.286,P=0.835;FWYK=0.386,P=0.766)。结果见图1。(2)水迷宫实验:12周龄SHR大鼠与WKY大鼠相比学习记忆能力无明显差异(均P>0.05)。随着周龄的增加,SHR大鼠逐渐出现记忆能力损害(FSHR=9.675,P<0.01),而WKY大鼠在不同时间点的逃避潜伏期差异无统计学意义(FWKY=4.308,P=0.054)。30周龄时,SHR大鼠相比WKY大鼠逃避潜伏期明显延长(t=4.748,P<0.01)。结果见图2和表1。

注:SHR:自发性高血压大鼠,图2~6同;与WKY大鼠比较,aP<0.01 图 1 各组大鼠不同周龄血压变化趋势
2.2各组大鼠海马区TLR4表达(1)Western

注:与组内18周龄比较,aP<0.01;与WKY大鼠比较,bP<0.01 图 2 Morris水迷宫实验检测各组大鼠学习记忆能力变化
blot检测:与WKY大鼠相比,35周龄SHR大鼠海马区TLR4蛋白表达相对增多(0.894±0.131vs.0.431±0.089;t=5.842,P<0.01)。(2)免疫组化:35周龄SHR大鼠海马DG区TLR4阳性细胞数表达升高〔(48.5±14.364)个/400倍镜vs.(24.5±13.077)个/400倍镜;t=4.722,P<0.05〕。结果见图3~4。
2.3免疫荧光技术检测海马区TLR4、Iba1、NeuN、GFAP表达与WKY大鼠比较,35周龄SHR海马DG区TLR4(t=8.864,P<0.001)、Iba1(t=7.854,P<0.001)、NeuN(t=8.451,P<0.001)、GFAP(t=2.804,P=0.019)表达明显增加,提示海马区小胶质细胞活化、神经元核抗原被激活、星型胶质细胞活化。结果见图5、6。
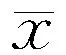
表1 12周龄各组大鼠学习能力逃避潜伏期比较 (±s,s)

注:TLR4:Toll样受体4,图4~6同 图 3 各组大鼠海马组织TLR4蛋白表达水平(Western blot)
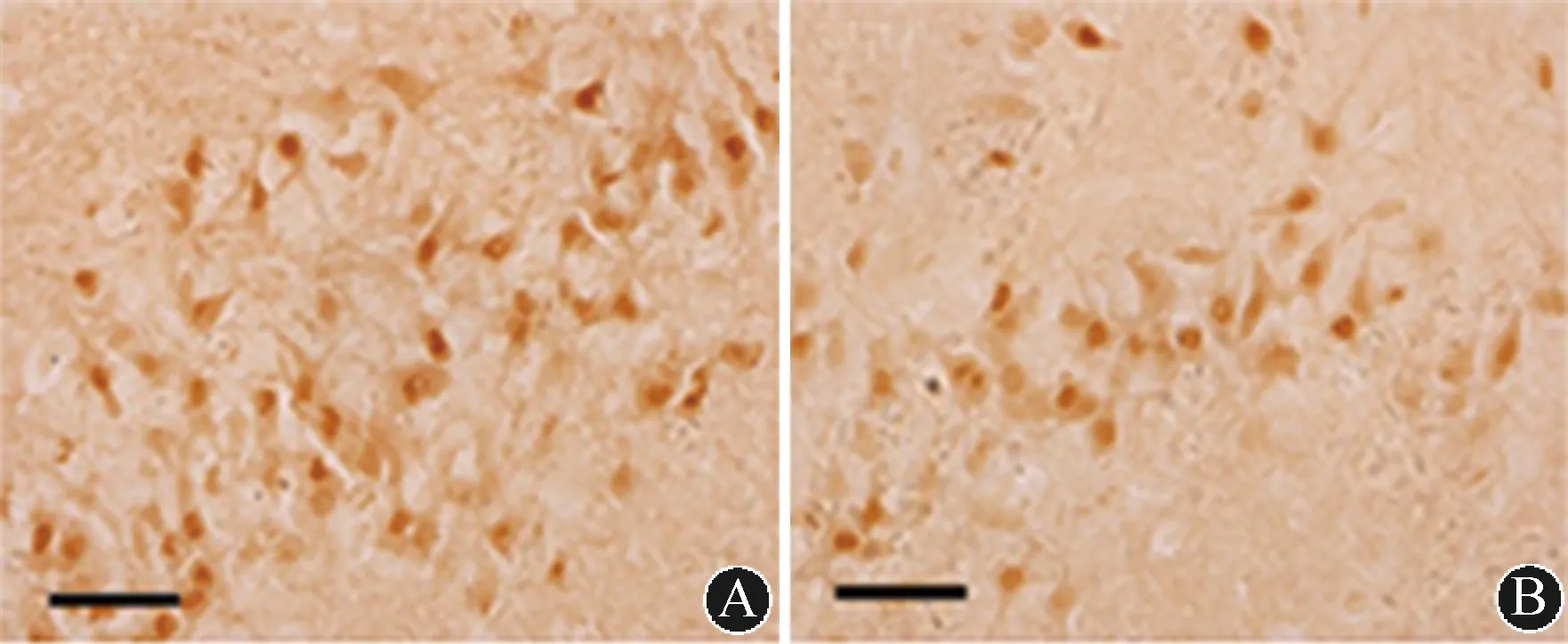
注:A:SHR大鼠;B:WKY大鼠 图 4 各组大鼠海马DG区TLR4阳性细胞数(免疫组化,比例尺=20 μm)

注:Iba1:小胶质细胞蛋白抗体;NeuN:神经元核抗原;GFAP:星型胶质纤维酸性蛋白;图6同 图 5 免疫荧光技术检测各组大鼠海马TLR4(A)、Iba1(B)、NeuN(C)及GFAP(D)阳性细胞数(比例尺=50 μm)

注:aP<0.05,bP<0.01 图 6 免疫荧光技术检测各组大鼠海马DG区TLR4、Iba1、NeuN及GFAP表达
3 讨论
很多研究结果表明,高血压不仅加速了颅内外供血动脉的粥样硬化,还可诱导血管壁胶原蛋白和纤维连接蛋白的沉积以及弹性蛋白分裂,导致大脑动脉硬度增加,引起供应大脑皮层及基底节区的小动脉及微动脉发生典型改变,从而导致脑血管病。在动物模型中大脑微血管的损伤是大动脉硬化和脉压增加共同作用的结果,高血压会加速小血管壁的重塑,从而导致血管功能损伤[8]。临床试验中血压增高会减弱由神经活动引起的脑血流量增加,导致脑血流量减少。这种能量供给需求与血流之间的不匹配以及基础脑血流量减少被认为是造成高血压引起认知功能下降的重要原因[9]。海马在学习记忆过程当中起着极其重要的作用,海马受损近期记忆出现损伤。本研究水迷宫实验结果证实SHR大鼠随着年龄增长会出现不同程度的认识损害,提示长期高血压可能引起脑血管损伤和脑血流减少,进而导致海马区神经细胞损伤和认知下降。
炎性反应在脑缺血的病理机制中扮演重要角色,并且在脑缺血和再灌注损伤的进展中起重要作用[10]。TLR4是固有免疫系统启动的重要组成部分,在鼠类动物脑组织神经元和胶质细胞中均有表达[11],它不仅介导固有免疫反应,还参与了炎性反应和神经退行性病变[12-13]。在TLR4信号介导途径中,活化的TLR4使下游激酶p-IKKα/β磷酸化,继而诱导p-IκBα磷酸化,引起核因子-κB(NF-κB)的核易位导致细胞因子和趋化因子合成释放[14]。研究发现,TLR4表达增多加剧了海马区相关炎性细胞因子水平的增加,可能进一步通过激活小胶质细胞、星形胶质细胞等激发神经炎性反应,最终导致神经元损伤认知下降。本研究结果显示,SHR大鼠海马区TLR4表达较WKY明显升高,且Iba1、GFAP、NeuN的表达亦升高,提示长期慢性炎性损伤可以引起海马区神经细胞损伤,包括胶质细胞活化、NeuN激活,SHR大鼠认知功能的下降一部分可能归因于TLR4的过度表达。这点在国外文献[15]中亦有提到。因此,作者推测TLR4作为固有免疫炎性反应介导因子可能介导炎性反应因子过度释放引起神经细胞损伤,长期过度的损伤导致认知功能下降。
综上所述,本研究结果显示SHR大鼠认知功能下降,其海马区TLR4、Iba1、GFAP及NeuN表达较WKY大鼠升高,推测高血压在大鼠认知功能损伤的过程中起重要作用。长期慢性高血压一方面引起固有免疫系统反应,另一方面刺激炎性反应因子过度表达,从而对神经元细胞产生损伤,两者共同作用导致神经功能受损,最终引起认知功能损害。TLR4作为固有免疫炎性反应介导因子,在细胞损伤过程发挥重要作用,通过阻断TLR4信号可能延缓细胞炎性损伤的过程。
