白藜芦醇对缺氧诱导胃癌细胞的上皮间质转化的抑制作用及其可能机制
2018-08-29陈四喜陈瑞红包春宇徐刚
陈四喜 陈瑞红 包春宇 徐刚
胃癌是世界上最常见的原发性胃肠道恶性肿瘤之一[1],尽管目前在诊断方法上有所改进,但胃癌患者的预后仍然极差,且大多数癌症患者的死因不是原发肿瘤而是肿瘤转移。肿瘤转移的发生需要上皮细胞的迁移和侵袭,而上皮间质转化是上皮细胞转移的基础[2]。研究表明,缺氧可能是EMT的诱发因素之一,介导这一反应的关键转录因子之一即缺氧诱导因子1α(HIF-1α),且HIF-1α与细胞增生、转移、血管生成、上皮间质转化(epithelial-mesenchymal transition,EMT)及肿瘤进展密切相关[3]。已有大量研究结果表明白藜芦醇能显著的抑制多种肿瘤细胞的上皮间质转化过程,但在不同的肿瘤细胞中,其机制却有所不同[4-5]。本研究目的在于探讨白藜芦醇是否对缺氧诱导的胃癌细胞上皮间质转化过程具有抑制作用,为胃癌的治疗提供一种新的思路。
1 材料与方法
1.1 细胞株 胃癌SGC-7901细胞由河南省信阳市解放军第一五四医院实验室保存。
1.2 主要试剂 胎牛血清:浙江天航生物科技有限公司;RPMI 1640培养基:美国Hyclone公司;MTT粉、CoCl2粉:美国Sigma公司;TRIzol试剂:美国Invitrogen公司;RNA逆转录试剂盒:美国Fermentas公司;2×Tag Mix:北京威格拉斯生物技术公司;RNA引物:上海生工生物工程有限公司;HIF-1α、Snail、E-cadherin及vimentin兔抗人单克隆抗体:美国Cell Signaling Technology公司;HRP标记山羊抗兔二抗:北京中杉金桥有限公司。
1.3 方法
1.3.1 MTT试验 复苏胃癌细胞SGC-7901置于37℃ 5%CO2的培养箱中培养24 h,取处于对数生长期的细胞,接种于96孔板中,分别配制白藜芦醇浓度为300、200、150、100、50、25、12.5和6.25 μmol/L的培养液,加入96孔板中,放入培养箱中培养24 h后,每孔中再加入浓度为5 mg/mL的MTT液20μL,继续放入培养箱中培养4 h后,吸去上清液,每孔中加入100 μL DMSO试剂进行溶解,将96孔板放在酶标仪上,对各孔在490 nm处的吸光值进行测定。取每组6个平行孔吸光值的均数,按照公式计算细胞生长抑制率(inhibition rate,IR):IR=(1-加药组吸光值均数/对数组吸光值均数)×100%。然后根据IR值计算出白藜芦醇对胃癌细胞的半数抑制浓度(IC50值),后续实验中白藜芦醇浓度均参照该浓度。
1.3.2 细胞划痕试验 取处于对数生长期的胃癌细胞,接种于六孔板中,分别设立对照组(普通培养基)、白藜芦醇组(含白藜芦醇的培养基)、缺氧组(含CoCl2的培养基)、白藜芦醇+缺氧组(含白藜芦醇和CoCl2的培养基),放入培养箱中培养24 h后,用10 μL枪头沿板底垂直划痕,再用PBS液进行冲洗3次,去除划下的细胞,再将六孔板放培养箱中培养24 h,在光学显微镜下进行观察,取样拍照。
1.3.3 荧光定量PCR试验 将四组细胞培养24 h后进行收集,按照TRIzol试剂说明书上的步骤,提取出各组胃癌细胞的总RNA,然后按照反转录试剂盒说明书上的步骤将总RNA反转录为cDNA,参照引物序列,使用ABI 7300 Real-time PCR System对cDNA进行扩增,然后对扩增的结果进行分析(引物序列表1)。将反转录后的cDNA稀释后,取2 μL作为模板,配置好反应体系。按照初始变性95 ℃ 10 min,变性95 ℃ 15 s,退火/延伸60 ℃ 31 s,进行40个循环。每份cDNA样品在相同的条件下按以上步骤进行基因表达水平的检测,所有的样品均重复试验3次,采用相对定量2-△△Ct法计算目的基因的mRNA表达水平。

表1 RT-qPCR引物序列及扩增片段大小
1.3.4 Western Blot试验 将对照组、白藜芦醇组、缺氧组、白藜芦醇+缺氧组四组细胞分别培养24 h后进行收集。使用细胞裂解液提取出总蛋白,制备成蛋白样品后,在电泳仪上依次进行灌胶、上样、电泳,在转膜仪上进行转膜,结束后将膜泡在封闭液(5%的牛奶)里在室温条件下封闭1 h,再将膜泡在一抗稀释液中,杂交袋封闭,4℃过夜,进行一抗孵育。用TBST溶液在室温下对孵育后的膜进行脱色。用同上方法进行二抗孵育,然后依次化学发光、显影、定影。将定影后的胶片进行拍照,通过Image J软件测定的特异性蛋白条带的密度。
1.4 统计学处理 以上试验均重复3次,采用SPSS 16.0软件对实验的结果进行统计分析,计量资料结果均采用(±s)表示,组间比较采用t检验,多组均数间比较采用方差分析方法比较。P<0.05表示差异具有统计学意义。
2 结果
2.1 MTT试验检测 MTT试验结果显示在相同培养条件下,白藜芦醇对正常组和缺氧组胃癌细胞SGC-7901的增生均有显著的抑制作用,且随着白藜芦醇浓度的增加,抑制作用逐渐增强。在缺氧和正常条件下,白藜芦醇对SGC-7901细胞的IC50值分别为(42.69±2.04)μmol/L和(40.57±1.83)μmol/L(图1),综合考虑,我们将白藜芦醇浓度40 μmol/L作为后续试验的药物浓度。

图1 MTT试验检测白藜芦醇对缺氧诱导的胃癌细胞SGC-7901的增生抑制作用
2.2 细胞划痕试验结果 在显微镜下观察并测量各组细胞划痕间宽度,在胃癌细胞SGC-7901中,结果均显示划痕宽度白藜芦醇组>对照组>白藜芦醇+缺氧组>缺氧组,提示缺氧诱导胃癌细胞后(缺氧组)细胞的侵袭能力明显增强,而白藜芦醇作用后(白藜芦醇+缺氧组)细胞的侵袭能力明显减弱,表明白藜芦醇对缺氧诱导的胃癌细胞SGC-7901的侵袭转移有明显的抑制作用(图2)。

图2 划痕实验检测四组胃癌SGC-7901细胞的迁移侵袭能力×100
2.3 荧光定量PCR试验结果 在胃癌细胞SGC-7901中,各组HIF-1α mRNA的相对表达量无明显升高或降低(差异无统计学意义P>0.05,图3)。而与对照组相比,缺氧组中Snail、vimentin mRNA相对表达水平均明显升高,E-cadherin mRNA表达水平均明显降低,而白藜芦醇+缺氧组表达水平与对照组相似,较缺氧组表达水平明显降低。白藜芦醇组与对照组相比,Snail、vimentin mRNA表达水平下降,E-cadherin mRNA表达水平升高,即缺氧诱导胃癌细胞后,对缺氧诱导因子HIF-1α基因的表达无明显影响,而导致胃癌细胞上皮间质转化相关因子基因表达明显增强,白藜芦醇对缺氧诱导的胃癌上皮间质转化相关因子基因表达有明显的抑制作用(图4)。

图3 荧光定量PCR试验检测各组胃癌细胞中HIF-1α mRNA相对表达量
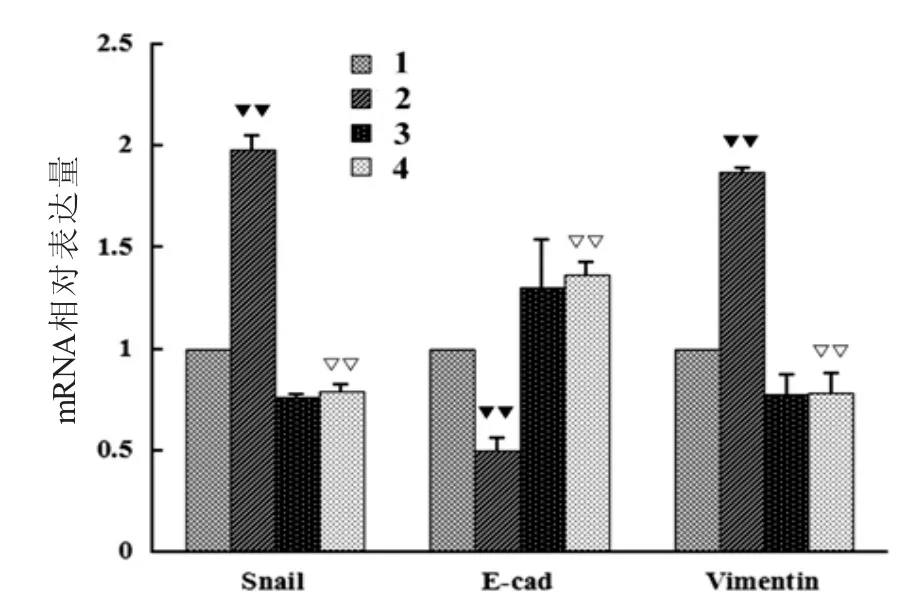
图4 荧光定量PCR试验检测各组胃癌细胞中EMT相关分子mRNA相对表达量
2.4 Western Blot试验结果 在胃癌细胞SGC-7901中,与对照组相比,缺氧组HIF-1α蛋白表达水平明显升高,而白藜芦醇+缺氧组表达水平与对照组相似,较缺氧组表达水平明显降低。白藜芦醇组与对照组相比,HIF-1α蛋白表达水平下降(图5)。与对照组相比,缺氧组Snail、vimentin蛋白表达水平明显升高,E-cadherin蛋白表达水平明显降低,而白藜芦醇+缺氧组表达水平与对照组相似,较缺氧组表达水平明显降低。白藜芦醇组与对照组相比,Snail、vimentin蛋白表达水平下降,E-cadherin蛋白表达水平升高,即缺氧诱导胃癌细胞后,导致胃癌细胞缺氧诱导因子HIF-1α及上皮间质转化相关因子蛋白表达明显升高,而白藜芦醇对缺氧诱导的胃癌上皮间质转化相关因子蛋白表达有明显的抑制作用(图6)。

图5 Western Blot试验检测四组胃癌SGC-7901细胞内HIF-1α蛋白的表达情况
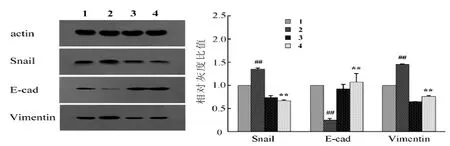
图6 Western Blot试验检测四组胃癌SGC-7901细胞内Snail、E-cadherin和vimentin蛋白的表达情况
3 讨论
白藜芦醇是一种低分子的植物抗毒素,是植物在应对某些外界刺激时所产生的一种代谢产物。研究表明,在多种恶性肿瘤如前列腺癌、乳腺癌及结肠癌中,白藜芦醇表现出了较好的抗肿瘤活性[6]。
微环境缺氧是实体肿瘤的一种常见特性,其导致肿瘤微血管系统的异常及肿瘤的快速生长。随着实体肿瘤的不断生长,对脉管系统氧供需求增大,肿瘤内出现缺氧状态,诱发肿瘤细胞内的缺氧反应体系,HIF-1α是肿瘤细胞为了耐受缺氧而表达的一种因子,在常氧状态时被泛素化降解。当肿瘤细胞处于缺氧状态时,泛素化降解过程被阻断,HIF-1α在细胞内逐渐累积。在多种实体肿瘤中均可发现HIF-1α的高表达和累积[7-9]。本研究显示,缺氧条件下,HIF-1α在胃癌细胞中存在累积。
上皮间质转化是原发肿瘤上皮癌细胞失去细胞极性和细胞间黏附,并增加迁移和侵袭特性,从而成为间充质细胞的一种生物学过程。肿瘤细胞发生转移的关键步骤之一是上皮间质转化[10],因此通过阻止其上皮间质转化从而抑制肿瘤的侵袭转移已成为目前肿瘤治疗的新策略之一。上皮间质转化的诱导因素很多,缺氧也被认为是其中重要的诱导因素之一。缺氧诱导肿瘤细胞的EMT过程主要是通过HIF-1α介导的[11]。在缺氧状态下,HIF-1α通过上调Snail基因的转录,促进Snail的表达从而引起肿瘤细胞发生上皮间质转化[12]。本研究显示,缺氧可以诱导人胃癌SGC-7901细胞的EMT,主要表现为相关因子vimentin的表达增加和E-cadherin的表达减少。
本研究发现,缺氧通过引起胃癌细胞中HIF-1α的累积,诱导胃癌细胞的EMT过程,表现为EMT相关因子Snail、vimentin表达的上调和E-cadherin表达的下调,同时表现为胃癌细胞的迁移能力明显增强,而白藜芦醇能显著抑制这一过程,且白藜芦醇抑制HIF-1α蛋白的累积而对HIF-1α mRNA水平无影响,具体机制还需进一步深入研究。
有研究显示,白藜芦醇是组蛋白去乙酰化酶Sirtuin1(SIRT1)最有效的激活剂,且白藜芦醇的多种活性都是通过SIRT1介导的,SIRT1可以使肿瘤细胞内信号通路转录因子和其他蛋白去乙酰化而失去活性[13]。已有研究证实,组蛋白乙酰化酶PCAF可以通过对HIF-1α的乙酰化作用使其激活,同时被激活的HIF-1α又可以在SIRT1的去乙酰化作用下失去活性,PCAF和SIRTl分别通过乙酰化和去乙酰化作用来调控HIF-1α的活性[14-15],这表明,白藜芦醇可以通过SIRT1对HIF-1α的去乙酰化作用使HIF-1α失去活性。
综上所述,本研究表明,白藜芦醇对胃癌细胞侵袭和转移的影响是通过抑制HIF-1α的累积从而抑制胃癌细胞的上皮间质转化介导的,尽管其具体机制还有待进一步研究,但这一结果为胃癌的靶向化疗提供了新的方向,同时白藜芦醇是否通过SIRT1的去乙酰化作用抑制HIF-1α的累积从而抑制胃癌细胞的EMT过程还有待进一步研究证实。
