加味地黄饮子对衰老小鼠肾脏组织P21、P53蛋白及其mRNA表达的影响
2018-08-29蔡国锋唐伟懿
高 山,庄 哲,刘 钊,蔡国锋,谢 宁,唐伟懿,马 嫡,付 宇
(1.黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040; 2.黑龙江中医药大学附属第二医院,黑龙江 哈尔滨 150001; 3.黑龙江中医药大学,黑龙江 哈尔滨 150040)
衰老是所有生物都会发生的随时间出现的增龄性变化,从微观的细胞改变到宏观的器官衰老、功能下降,包括人体的全部生理病理变化[1]。老龄导致的生理改变与某些疾病的初期病理变化在时间上无明显分界,老龄化导致的器官功能衰竭逐渐演变成临床疾病。在中国,11%的65岁以上老年人存在慢性肾脏疾病,衰老肾脏对外界环境的刺激缺乏抵抗能力,易遭到破坏[2-3]。因而,研究肾脏衰老机制及探究衰老肾脏的保护方法具有重要的意义。
加味地黄饮子源自古方地黄饮子。课题组针对疾病谱系和现代人的体质,对其进行加减化裁,在临床应用和前期研究中发现其具有良好的延缓衰老作用。目前,对中医药延缓衰老的深层机制的研究较少[4-5]。本研究从衰老基因表达的角度,探讨加味地黄饮子延缓肾脏衰老的作用机制,为其广泛应用提供理论依据。
1 材料
1.1 动物 清洁级ICR雄性小鼠40只,2月龄10只,体质量20~25 g,18月龄30只,体质量35~40 g,由黑龙江中医药大学动物实验中心[动物生产许可证号为SCXK(黑)2012-001]提供。饲养条件:20~25 ℃,自然照明,自由饮水和进食。
1.2 药物、试剂与仪器 加味地黄饮子水煎液(生药浓度为0.26 g/mL):黑龙江中医药大学附属第一医院中药局;水溶性维生素E(批号 1420006707):北京博奥拓科技有限公司;P21单克隆抗体(批号 028359):美国Santa Crcz公司;P53单克隆抗体(批号 029457):美国Thermo公司;β-actin鼠单克隆抗体(批号 040521):武汉博士德公司;逆转录试剂盒(批号 1601259):上海默联生物科技有限公司。
7050型全自动生化分析仪:日本日立公司;超声碎裂仪:美国Sonic公司;EnVision®多功能酶标仪:上海珀金埃尔默有限公司;DNA电泳仪:美国BR公司;Image Plus version 5.0图像分析系统:美国Gybernetics公司。
2 方法
2.1 分组与给药 将2月龄小鼠10只设为青年组。18月龄小鼠被随机分为老年组、维生素E组、加味地黄饮子组,每组10只。青年组和老年组按每日10 mL/kg剂量灌胃生理盐水,维生素E组按每日250 mg/kg剂量灌胃维生素E水溶液,加味地黄饮子组按每日2.6 g/kg剂量灌胃加味地黄饮子水煎剂。以上各组连续灌胃60 d。
2.2 标本采集与处理 实验结束后麻醉小鼠,腹主动脉取血,收集血液标本。处死小鼠,收集肾脏标本并称质量,一部分石蜡包埋处理,另一部分液氮冷冻后在-80 ℃冰箱中保存。
2.3 一般状况观察和肾脏指数检测 观察实验前后各组小鼠毛色、运动、反应、体质量等一般状况。计算各组小鼠平均肾脏指数。计算公式:肾脏指数=肾脏质量(mg)/体质量(g)×100%。
2.4 血清肌酐(serum creatinine, SCr)、尿素氮(blood urine nitrogen, BUN)检测 采用日立7050生化分析仪检测各组小鼠SCr、BUN水平。
2.5 肾脏组织病理学观察 制备肾脏组织石蜡切片(厚度2~3 μm),常规脱蜡,苏木精-伊红(hematoxylin-eosin, HE)染色,观察肾小球、肾小管、基质等病理改变。
2.6 肾脏组织超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)水平检测 将肾脏组织匀浆,离心后收集上清液,以酶学方法检测SOD、GSH-Px水平,以硫代巴比妥酸法检测MDA水平。
2.7 RT-PCR法测定P21、P53 mRNA的表达 引物由上海生工生物工程有限公司合成,引物序列见表1。按RT-PCR试剂盒提供方法操作,以Trizol提取总RNA,逆转录合成cDNA,采用实时荧光定量PCR法检测。反应体系:cDNA 2 μL,上下游引物各2.5 μL,总反应容积为20 μL。反应条件:95 ℃预变性1 min,95 ℃变性15 min,60 ℃退火1 min,70 ℃延伸30 s,40个循环。
2.8 Western blot法测定P21、P53蛋白的表达 采用BCA法检测肾脏组织蛋白浓度。每孔上样50 μg蛋白样本,SDS-PAGE电泳、分离、转印,转膜封闭,经过一抗、二抗孵育处理,洗膜后曝光。以同一膜上GAPDH作为内参,在凝胶成像处理系统内进行图像分析。
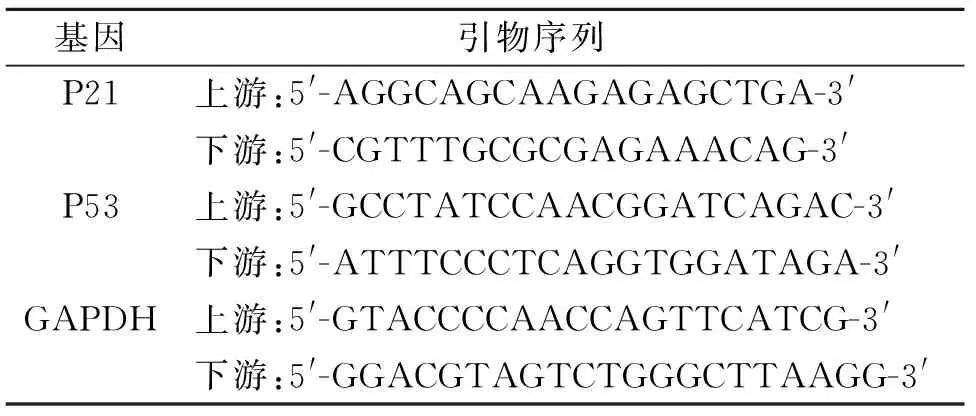
表1 RT-PCR引物序列
3 结果
3.1 各组小鼠一般状况及肾脏指数变化 实验前,青年组小鼠毛色洁白,运动活跃,反应迅速;老年组与维生素E组和加味地黄饮子组小鼠毛色白,运动平稳,反应灵敏。60 d后,青年组小鼠毛色、运动、反应无明显变化,体质量增加明显;老年组小鼠毛色淡黄,运动缓慢,反应迟钝,体质量略增加;维生素E组与加味地黄饮子组小鼠毛色淡黄,运动平稳,反应灵敏,体质量略增加,且加味地黄饮子组小鼠运动、反应表现优于维生素E组。
与青年组比较,老年组小鼠肾脏指数显著升高(P<0.05);与老年组比较,维生素E组肾脏指数无明显差异,加味地黄饮子组肾脏指数明显降低(P<0.05)。与维生素E组比较,加味地黄饮子组肾脏指数明显降低(P<0.05)。见表2。
表2 各组小鼠体质量及肾脏指数比较
注:与青年组比较,*P<0.05;与老年组比较,#P<0.05;与维生素E组比较,△P<0.05
3.2 各组小鼠SCr、BUN水平比较 与青年组比较,老年组SCr、BUN水平显著上升(P<0.05);与老年组比较,维生素E组小鼠SCr、BUN水平无明显变化,加味地黄饮子组小鼠SCr、BUN水平显著降低(P<0.05);与维生素E组比较,加味地黄饮子组小鼠SCr、BUN水平显著降低(P<0.05)。见表3。
3.3 各组小鼠肾脏病理学变化 青年组小鼠无肾小球硬化、肾小管萎缩、系膜基质增生、炎性细胞浸润表现。老年组小鼠出现肾小球硬化、肾小管萎缩、系膜基质增生、炎性细胞浸润。与老年组比较,维生素E组和加味地黄饮子组硬化肾小球数目减少,肾小管萎缩、系膜基质增生、炎性细胞浸润减轻,加味地黄饮子组病理变化的改善情况优于维生素E组。见图1。

表3 各组小鼠SCr、BUN水平比较
注:与青年组比较,*P<0.05;与老年组比较,#P<0.05;与维生素E组比较,△P<0.05
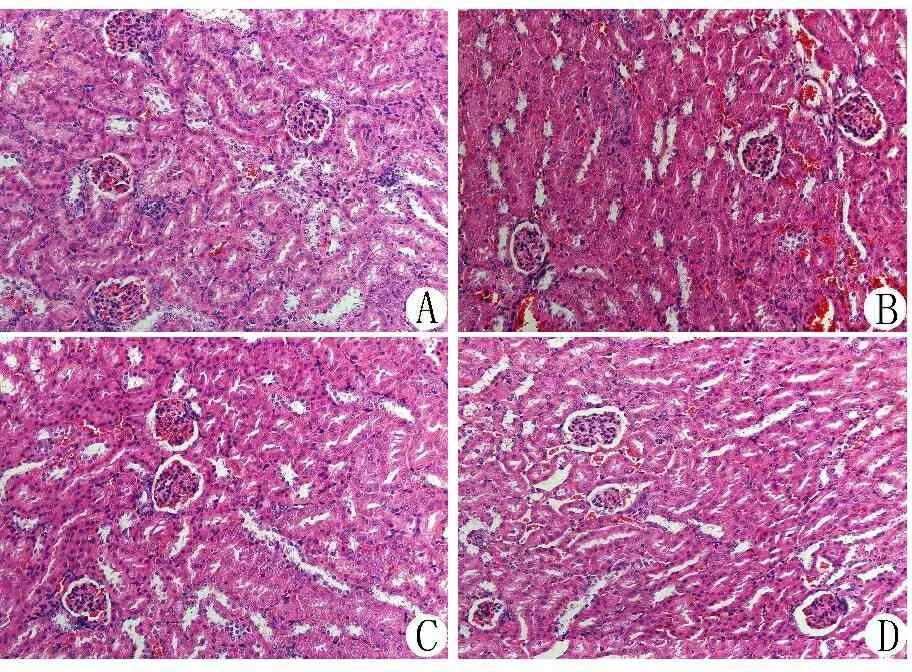
注:A.青年组;B.老年组;C.维生素E组;D.加味地黄饮子组
图1各组小鼠肾脏组织病理学变化比较(HE染色,10×20倍)
3.4 各组小鼠肾组织SOD、MDA、GSH-Px水平比较 与青年组比较,老年组小鼠肾组织SOD、GSH-Px水平显著下降,MDA水平显著上升(P<0.05)。与老年组比较,维生素E组小鼠肾组织SOD水平明显上升(P<0.05),GSH-Px、MDA水平无明显变化(P>0.05);加味地黄饮子组SOD、GSH-Px水平显著上升,MDA水平明显降低(P<0.05)。与维生素E组比较,加味地黄饮子组SOD、GSH-Px水平显著上升,MDA水平显著降低(P<0.05)。见表4。

表4 各组小鼠肾组织SOD、MDA、GSH-Px水平比较
注:与青年组比较,*P<0.05;与老年组比较,#P<0.05;与维生素E组比较,△P<0.05
3.5 各组小鼠肾组织P21、P53及其mRNA表达水平比较 与青年组比较,老年组小鼠肾组织P21、P53及其mRNA表达水平显著升高(P<0.05)。与老年组比较,维生素E组和加味地黄饮子组小鼠肾组织P21及P21 mRNA、P53 mRNA表达水平明显降低(P<0.05)。加味地黄饮子组P21、P53及其mRNA表达水平明显低于维生素E组(P<0.05)。见表5和图2。

表5 各组小鼠肾组织P21、P53及其mRNA相对表达水平比较
注:与青年组比较,*P<0.05;与老年组比较,#P<0.05;与维生素E组比较,△P<0.05

注:A.青年组;B.老年组;C.维生素E组;D.加味地黄饮子组
图2各组小鼠肾组织P21、P53蛋白表达水平比较(Western blot法)
4 讨论
WTO将亚太地区60岁以上者划分为老年人。随年龄增长,人体各器官都会逐渐衰老,肾脏是较早衰老的器官之一。衰老后的肾脏解剖结构、生理代谢方面发生退行性变化,导致肾脏发生老年性功能改变[6]。但通常状态下,老年肾脏仍能维持稳态,可是一旦出现某些疾病使肾脏负荷加重,使内环境不稳定,老年人的肾脏功能就会出现异常,甚至衰竭。近年来中国才开始研究肾脏衰老,其意义受到日益广泛的关注。
地黄饮子原方出自《黄帝素问宣明论方》,由熟地黄、山茱萸、石菖蒲、巴戟天、五味子、石斛、远志等组成。本方具有滋补肾阴肾阳、化痰开窍的功效,主治下元虚衰、阴阳两虚、痰浊上犯之证。熟地黄滋阴养血、益髓补精,主补血气、滋肾水、益真阴。山茱萸平补阴阳,壮元气,秘精。巴戟天为补肾要剂,可强阳益精。本课题组结合现代人体质特点化裁原方,去掉附子等过于温热的药物。研究发现,地黄饮子可以升高胆碱乙酰转移酶(choline acetyltransferase,ChAT)的表达,减轻胆碱能系统的损害[7-8]。宫健伟等研究发现,地黄饮子具有明显升高大鼠血清中SOD、CAT、GSH-Px和抑制MDA的作用,减少自由基的产生,减轻脂质过氧化反应,具有良好的抗氧化损伤作用[9]。程小丽等[10]研究发现,加味地黄饮子具有上调热休克蛋白和核转录因子的作用。刘莹等[11]研究表明,地黄饮子可以调控蛋白激酶B、果蝇雷帕霉素靶蛋白的表达而干预果蝇细胞的凋亡。
课题组前期研究发现,地黄饮子加减方具有抗海马组织衰老的作用[12]。本实验是在前期研究基础上的延伸性研究。地黄饮子加减方可调节脑组织SOD、MDA、GSH-Px含量,表现出较明显的抗氧化作用,其作用机制与抑制氧化应激有关,故以维生素E组作为对照组。本实验结果显示,自然衰老的老年组小鼠出现明显的衰老性外观变化,肾脏指数上升,肾功能及反映机体衰老的SOD、GSH-Px、MDA酶学指标发生改变,病理学观察发现小鼠肾小球硬化数量增多,肾小管萎缩,间质大量增生,说明这一模型充分模拟了衰老的人体内环境。加味地黄饮子组小鼠的外观性变化,肾脏指数,肾功能以及酶学指标SOD、GSH-Px、MDA的改善显著优于老年组和维生素E组,肾小球硬化数量减少,肾小管萎缩、肾间质增生减轻,说明加味地黄饮子可以对小鼠肾脏组织的衰老产生干预作用。
与生化指标、病理学改变相对应,衰老标志物P21、P53及其mRNA表达在加味地黄饮子组明显下降,说明其可能通过干预细胞调控因子,影响细胞增殖周期,而发挥抗衰老作用。P21、P53是细胞周期调节因子,其蛋白表达与衰老直接相关[13]。当细胞受到某种外界刺激时,P53蛋白应激性快速上调,进一步激活P21蛋白,使P21蛋白磷酸化受到抑制,正常细胞周期受阻,产生细胞衰老[14-15]。本研究结果表明,加味地黄饮子干预后小鼠P21、P53 mRNA表达水平明显降低,推测加味地黄饮子可能通过下调P21、P53基因表达来延缓衰老。
综上,本研究表明,加味地黄饮子可以干预小鼠衰老肾脏组织结构,调节P21、P53蛋白及其mRNA表达,可初步揭示其抗衰老的作用机制。
