小麦籽粒清蛋白和球蛋白条件和非条件QTL分析
2018-08-28李珊珊张树华杨学举
周 梦,赵 勇,李珊珊,徐 渴,张树华,杨学举
(1.河北农业大学农学院,河北保定 071001; 2.河北农业大学生命科学学院,河北保定 071001)
小麦(TriticumaestivumL.)籽粒中蛋白组分含量直接反应小麦品质,决定小麦最终用途。根据蛋白溶解特性,Osborne等[1]将蛋白质分为溶于水的清蛋白(albumin)和溶于稀盐的球蛋白(globulin)等,分子量约为l.2~20 kDa。与小麦其他籽粒蛋白相比,清蛋白和球蛋白由于富含赖氨酸和蛋氨酸,而被认为是高营养价值的蛋白组分[2]。α-淀粉酶/胰蛋白酶、丝氨酸、蛋白酶抑制剂和嘌呤霉素的主要成分为清蛋白和球蛋白,它们是胚胎萌发的营养物质,并能保护其免受昆虫和病原体的侵害[3]。但小麦籽粒蛋白质组分含量的遗传基础复杂,是受多基因控制的数量性状[4],且清蛋白和球蛋白的含量在整个灌浆期不断变化,故难以用传统的遗传学来研究基因效应。
过去应用QTL研究小麦蛋白质组分通常是在收获后测定表型值,只有终端表达情况。吴为人等[5]提出了动态QTL,揭示不同发育阶段与蛋白合成有关的QTL动态表达,并与非条件QTL结合分析,提高了QTL定位的灵敏度和准确度。动态条件QTL定位分析已经在小麦中得到广泛应用,如:Zhang等[6]对小麦叶片中叶绿素含量进行了发育动态的QTL分析,刘 宾等[7]对小麦株高进行了发育动态的非条件QTL和条件QTL分析,Wu等[8]、Wang等[9]也分别对小麦株高进行了发育动态的QTL分析。
在小麦中,对蛋白质组分含量QTL定位的研究也有一些报道,石培春等[10]以RIL群体为材料,对小麦籽粒蛋白质组分含量进行了非条件QTL分析,分别检测出与清蛋白含量和球蛋白含量有关的位点各1个。孙海艳等[11]利用“川35050×山农483”构建的含131个家系的RIL群体,对小麦蛋白和淀粉相关品质性状进行了QTL分析,发现3个与蛋白含量相关的QTL,分别位于3B、5A和6A染色体。Zhang等[12]以PH82-2和内乡188为亲本获得的含有240个家系的RIL群体为材料,检测到8个与谷蛋白含量相关的QTL,分布于1A、1B、1D、3A、4A和5D染色体。Li等[13]以两个分别含有485和229个家系的RIL群体为材料,共检测出21个与蛋白含量相关的位点,其中在5A染色体上检测到一个控制蛋白含量的主效位点,贡献率为53.04%。
然而,到目前为止,尚未利用条件QTL和非条件QTL分析方法对小麦籽粒灌浆期清蛋白和球蛋白含量进行动态QTL分析。本研究以小麦DH群体为材料,在2年3点6个环境下测定灌浆期5个阶段小麦籽粒中两种蛋白含量,利用相关作图方法分析两种蛋白含量的发育动态的条件和非条件QTL,以期为剖析小麦蛋白质组分动态积累遗传基础,同时为进一步开发主效基因的分子标记、改善小麦品质奠定理论基础。
1 材料与方法
1.1 试验材料
以小麦品种花培3号与豫麦57杂交,经花粉培养和染色体加倍获得168个DH系,本研究即以这些DH系为材料。花培3号和豫麦57分别于2006年和2004年通过河南省和国家农作物品种审定委员会审定,二者在品质性状上存在较大差异[14-15]。
1.2 试验设计
1.2.1 田间种植
2011年10月,将DH群体及亲本分别种植于河北省保定市农科所育种试验地(38.85°N,115.5°E,环境E1))、邢台市农科院育种试验地(37.13°N,114.68°E,环境E2)和沧州市青县原种场(38.58°N,116.82°E,环境E3)。采用随机区组设计,设置3次重复,3行区,行长3 m,行距25 cm,株距10 cm。2012年10月,在上述3地点重复种植DH群体,环境代号分别为E4、E5和E6。
1.2.2 蛋白组分含量的测定
分别在花后12 d(T1)、17 d(T2)、22 d(T3)、27 d(T4)和32 d(T5)取样,每次取5株麦穗。取穗烘至恒重,手工脱粒,并用粉碎机(Perten hammer mill 3100,瑞典波通)制成全麦粉,过80目筛,保存备用。
参考何照范[16]的方法提取蛋白。利用B-324全自动凯氏定氮仪(Buchi公司,瑞士)测定蛋白质组分含量,折算成样本百分率。
1.3 数据分析
利用SPSS 13.0软件进行表型分析及正态分布检测。利用ICIMapping 3.3以及QGAstation 2.0软件分析QTL效应;在ICIMapping3.3软件中,采用2.5的LOD临界值,参照Mcintosh等[17]的方法命名QTL,即:“ Q+性状名称缩写+染色体编号 ”。
2 结果与分析
2.1 小麦DH群体及亲本清蛋白和球蛋白含量的表型分析
在不同环境、不同时期,花培3号和豫麦57中清蛋白和球蛋白含量的差异均较大,且存在相同的变化趋势(表1)。在6个环境下,T1、T2和T3时期,父本豫麦57中两种蛋白的含量明显大于母本花培3号;而T4和T5时期,花培3号则大于豫麦57。且双亲之间两种蛋白含量的差异均达到显著(P<0.05)或极显著(P<0.01)水平,但E1环境T2时期的清蛋白含量除外。每个时期DH群体各株系两组分含量差异明显,存在显著的超亲现象,群体分离连续性符合正态分布,适合做进一步的QTL定位分析。

表1 不同环境条件下小麦亲本及DH群体的清蛋白和球蛋白含量Table 1 Albumin and globulin content of DH population and its parents in different environments
/前后的数值分别代表清蛋白和球蛋白含量;*和**分别表示与豫麦57号在0.05和0.01水平差异显著。
The values before and after / represent albumin and globulin content,respectively.* and ** represent significant differences at the 0.05 and 0.01 levels,respectively.
2.2 清蛋白条件和非条件QTL定位及遗传效应分析
2.2.1 清蛋白非条件QTL定位
在6个环境的5个时期共检测到18个影响清蛋白含量的非条件加性QTL,分别位于1B、2A、2B、3A、6A、6B、7B和7D染色体上(表2),贡献率为6.66%~21.67%。贡献率大于10%的QTL有8个,分别为 QAlu1B、 QAlu1B-1、 QAlu1B-3、 QAlu1B-4、 QAlu6A、 QAlu6A-1、 QAlu7B和 QAlu7B-1,其中6个分布在B染色体组上,2个分布在A染色体组上。贡献率最大(21.67%)的QTL为 QAlu1B-4。
QAlu1B-3在6个环境的T4和T5时期均被检测到,其增效基因来自于母本花培3号。 QAlu7B-1在5个环境的T2时期和3个环境的T3时期均被检测到,其增效基因来自父本豫麦57。 QAlu1B-1在5个环境的T4时期均被检测到, QAlu2B和 QAlu6A分别在4个环境的T5和T1时期被检测到, QAlu1B在3个环境的T3时期被检测到, QAlu2A在2个环境的T1时期被检测到,其余QTL只在1个环境中被检测到。
2.2.2 清蛋白条件QTL定位
在6个环境的4个动态发育时期共检测到11个影响清蛋白含量的条件加性QTL,分别位于1B、2B、3A、6A、7B和7D染色体上(表3),贡献率为6.44%~16.85%。贡献率大于10%的QTL有7个,分别为 QAlu1B、 QAlu1B-3、 QAlu2B、 QAlu6A-1、 QAlu7B、 QAlu7B-1和 QAlu7B-2,其中5个分布在B染色体组上,1个分布在A染色体组上。贡献率最大(16.85%)的QTL为 QAlu1B-4。
QAlu1B-3在6个环境的T3-T4和T4-T5时期均被检测到,其增效基因来自母本花培3号(但E6的T3-T4时期除外)。 QAlu1B-1和 QAlu7B-1分别在5个环境的T3-T4和T1-T2时期均被检测到, QAlu2B在4个环境的T4-T5时期均被检测到, QAlu1B和 QAlu7B-2在3个环境的T2-T3时期均被检测到, QAlu6A-1在E2的T1-T2时期和E5的T2-T3时期被检测到。
2.2.3 清蛋白条件QTL和非条件QTL联合分析
从条件和非条件加性QTL综合分析可以看出,在T2时期, QAlu7B-1、 QAlu6A和 QAlu6A-1在非条件和条件分析中都能检测到, QAlu7B-1遗传效应明显减小,表明该QTL为连续表达的基因,在该段时间(T1-T2)内既有净遗传效应,也有累加效应,但不是新的QTL。后两个位点效应值变化不大,则在该时段(T1-T2)的表达主要为净遗传效应,为T2时期检测到的新基因的表达。在T3时期, QAlu1B和 QAlu7B在非条件和条件分析中都能被检测到,但 QAlu1B遗传效应变化明显,表明该QTL为连续表达的基因,在该段时间(T2-T3)内既有净遗传效应,也有累加效应,但不是新的QTL; QAlu6A-1只在条件分析中检测,说明该QTL全部为净遗传效应,但是效应值较小,未在非条件分析中被检测出。在T4时期, QAlu1B-1和 QAlu1B-3在非条件和条件分析中都能检测到,但条件QTL遗传效应明显变化,说明该QTL为连续表达的基因,在该段时间(T3-T4)内既有净遗传效应,也有累加效应,但不是新的QTL。在T5时期,检测到6个QTL,其中 QAlu1B-3、 QAlu2B和 QAlu3A在非条件和条件分析中都能被检测到,条件QTL遗传效应变化明显,说明该QTL为连续表达的基因,在该段时间(T4-T5)内既有净遗传效应,也有累加效应,但不是新基因。 QAlu1B-2、 QAlu1B-4和 QAlu6B只出现在非条件分析中,说明该基因在该时期(T4-T5)没有表达,无净遗传效应。
2.3 球蛋白条件和非条件QTL定位及遗传效应分析
2.3.1 球蛋白非条件QTL定位
在6个环境的5个时期共检测到22个影响球蛋白含量的非条件加性QTL,分别位于1B、1D、2A、2B、2D、3A、3B、4A、4B、5A、6A、6B、6D、7B和7D共15条染色体上(表4),贡献率为6.72%~25.13%。贡献率大于10%的QTL共有7个,分别为 QGlo1B、 QGlo1B-2、 QGlo1B-3、 QGlo3A、 QGlo3B-1、 QGlo4B-1和 QGlo6B,其中6个分布在B染色体组上,一个分布在A染色体组上。贡献率最大(25.13%)的QTL为 QGlo1B-2。
QGlo1B-3在4个环境的T1和T2时期被检测到,其增效基因来自父本豫麦57。 QGlo6A、 QGlo2A和 QGlo6B分别在4个环境的T2、T4和T5时期被检测到。 QGlo1B-2和 QGlo3B-1均在2个环境的T3时期被检测到, QGlo7D-1在2个环境的T4时期被检测到,其余QTL只在一个环境中被检测到。

表2 小麦籽粒清蛋白含量非条件加性QTL效应Table 2 Additive effects of unconditional QTLs for albumin

表3 各时期小麦籽粒清蛋白含量条件加性QTL效应Table 3 Additive effects of conditional QTLs for albumin at different periods
2.3.2 球蛋白条件QTL定位
在6个环境的4个动态发育时期共检测到21个影响球蛋白含量的条件加性QTL,分别位于1B、1D、2A、2D、3A、3B、4A、4B、6A、6B、6D和7D共12条染色体上(表5),贡献率为6.53%~24.21%。贡献率大于10%的QTL共有8个,分别为 QGlo1B、 QGlo1B-2、 QGlo1B-3、 QGlo1B-4、 QGlo3B-1、 QGlo4A、 QGlo4B-1和 QGlo6B,其中7个分布在B染色体组上,1个分布在A染色体组上。贡献率最大(24.21%)的QTL为 QGlo1B-2。
QGlo6B在4个环境的4个动态发育时期均被检测到,其增效基因来自于父本豫麦57。 QGlo1B-3、 QGlo2A和 QGlo6A分别在4个环境的T1-T2、T3-T4和T1-T2时期被检测到, QGlo1B-2、 QGlo3B-1、 QGlo7D和 QGlo7D-1分别在2个环境的T2-T3、T2-T3和T3-T4时期被检测到,其余的条件QTL只在1个环境中被检测到。
2.3.3 球蛋白条件QTL和非条件QTL联合分析
综合分析各时期检测到的条件和非条件加性QTL,可以看出,在T2时期,检测到6个QTL。其中 QGlo1B-3、 QGlo2D、 QGlo6A和 QGlo6D在非条件和条件分析中都能检测到,但条件QTL遗传效应发生变化,说明该QTL为连续表达的基因,在该段时间(T1-T2)内既有净遗传效应,也有累加效应,但不是新QTL; QGlo1B和 QGlo6B只出现在条件分析中,说明该QTL全部为净遗传效应,但是效应值较小,未在非条件分析中被检测出。在T3时期,检测到 QGlo3A-1和 QGlo6B只出现在条件分析中,说明该QTL全部为净遗传效应,但是效应值较小,未在非条件分析中被检测出。其余的QTL在非条件和条件分析中都能检测到,但条件QTL遗传效应变化,则该QTL为连续表达的基因;在该段时间(T2-T3)内既有净遗传效应,也有累加效应,但不是新QTL;在T4时期检测到10个QTL,其中, QGlo2A、 QGlo3A、QGlo4A和 QGlo7D-1在非条件和条件分析中都能被检测到,但条件QTL遗传效应变化明显,说明该QTL为连续表达的基因,在该段时间(T3-T4)内既有净遗传效应,也有累加效应,但不是新QTL; QGlo5A和 QGlo7D-2只出现在非条件分析中,说明该基因在该时期(T3-T4)没有表达,无净遗传效应; QGlo6B、 QGlo6D-1和 QGlo7D只出现在条件分析中,说明该QTL全部为净遗传效应,但是效应值较小,未在非条件分析中被检测出。在T5时期检测到1个QTL,即 QGlo6B该QTL在非条件和条件分析中都能检测到,但条件QTL遗传效应变化,说明该QTL为连续表达的基因,在该段时间(T4-T5)内既有净遗传效应,也有累加效应,但不是新QTL。
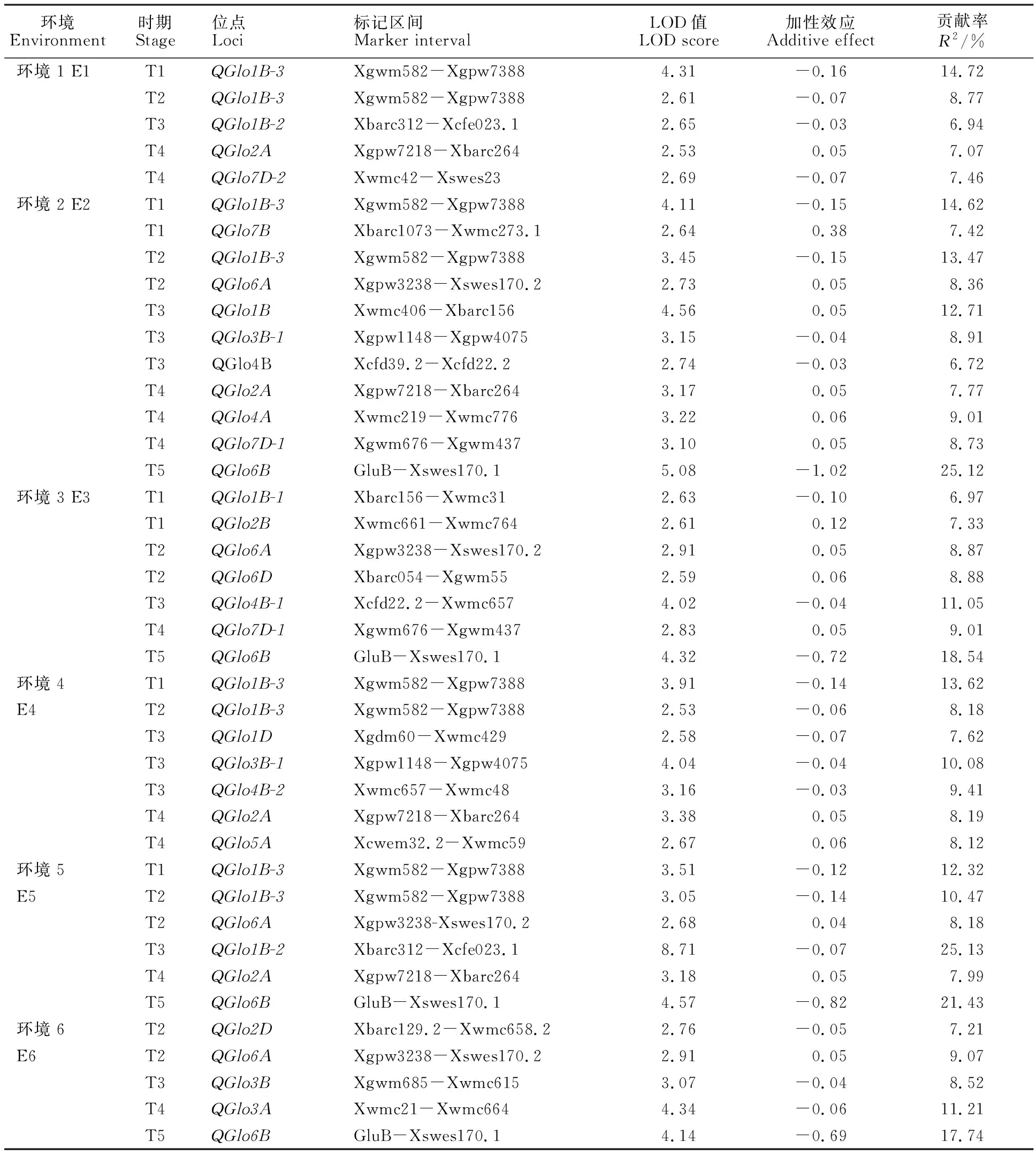
表4 各时期小麦籽粒球蛋白含量非条件加性QTL效应Table 4 Additive effects of unconditional QTLs for globulin at different periods

表5 各时期小麦籽粒球蛋白含量的条件加性QTL效应Table 5 Additive effects of conditional QTLs for globulin at different periods
3 讨 论
非条件QTL分析是根据作物生长发育终端的表型数据进行QTL分析,最终体现的是基因的累加效应,而条件QTL则根据作物生长过程中不同阶段,或在给定某种条件下,对性状的净增加值进行基因定位;可针对同一性状,在不同生长阶段,检测表达的QTL或同一位点在各种环境下表达的QTL,解释基因表达的净遗传效应[18]。本研究将条件QTL和非条件QTL结合使用,可以检测到在特定时期和时间段内表达的QTL,能更综合、更全面地掌握控制性状的基因的表达动态。
研究结果表明,两者定位结果不完全一致,控制清蛋白和球蛋白积累的基因的表达具有明显的时空性。在5个取样时期,检测到影响清蛋白和球蛋白含量的非条件QTL共有40个,条件QTL共有32个。未检测出在整个灌浆期都表达的位点,说明控制小麦籽粒蛋白质组分含量的基因有选择性表达,这与发育遗传学理论是一致的[19]。但 QAlu-1B-3、QAlu-7B-1、QAlu-6A-1和 QGlo-1B-3在整个灌浆过程中的多个阶段被检测出,并在不同中环境得到表达,为持续表达基因。条件加性QTL的定位结果显示,条件加性QTL位点 QGlo6B在灌浆的后4个时期连续出现,但 QGlo6B只在最后1个时期才被检测到非条件加性QTL,说明在发育开始的前3个时期, QGlo6B的表达全部为净遗传效应,而 QGlo6B在最后1个时期的非条件QTL分析中出现,说明其微效效应值积累到一定程度就可以被检测出。由此可见,条件QTL可以检测出被非条件QTL忽视的微效基因,通过两种方法结合,可以获得更加准确和完整的结果,以帮助揭示表达基因数量及其各种发育功能。
朱占玲等[20]对小麦籽粒蛋白质含量进行了发育动态QTL分析,检测到一些相同区域,例如Xwmc222-Xgdm60、Xgwm295-Xgwm676、Xgdm60-Xwmc429和Xgdm67-Xwmc634等,其中 QGpc1D位于标记区间Xgdm60-Xwmc429,在籽粒灌浆的三个时期检测到,本研究中检测到控制球蛋白含量的 QGlo1D同样标记在此位点,可能是一因多效。Zhao等[21]检测到1个与球蛋白含量相关的位点位于3A染色体的 Xbarc86-Xwmc21区间内,在本研究中定位的 QGlo3A位点,标记在与之相邻的Xwmc21-Xwmc664区间内。本研究结果与前人的研究并没有找到控制相同性状的同一位点,可能是我们采用的群体和标记不同。
在植物中,不仅基因与基因间存在互作效应,在基因与环境间也存在互作效应,在不同的遗传背景和不同的环境条件下,找到稳定表达的QTL是十分困难的[22-23]。一些可在多年多点都可以检测到且贡献率大于10%的稳定QTL,可以应用于小麦分子标记辅助选择育种和聚合育种。其中,非条件 QAlu7B-1在5个环境下的T2时期被检测出,3个环境的T3时期被检测, QAlu1B-3在6个环境下的T4和T5时期均被检测出。条件 QAlu1B-3在6个环境的2个时期中被检测到。球蛋白的定位结果中,非条件QTL位点在4个环境下的第1个时期被检测出,增效基因来自父本豫麦57,同时在条件QTL中有4个环境中被检测到。说明, QAlu1B-3和 QGlo1B-3可作为主效位点进行后期验证。
