不同养分条件下太子参根部土壤环境变化及综合评价*
2018-08-27刘帮艳李金玲曹国璠王华磊
刘帮艳 李金玲,2 曹国璠† 郑 听 何 兵 赵 致,2 王华磊,2
(1 贵州大学农学院,贵阳 550025)
(2 贵州省药用植物繁育与种植重点(工程)实验室,贵阳 550025)
土壤环境是作物赖以生存的基本环境,其物理结构、化学成分、酶活性、微生物种群结构及水、热条件等,无不作用于作物生长。作为根类药材的太子参,对土壤环境要求较为严格,且目前太子参连作对土壤环境也有较大影响,造成太子参连作障碍问题凸显,极大影响太子参栽培生产。也有较多研究表明,烟草、蔬菜以及多数药用植物等因连作而改变土壤环境,制约自身生产[1-3]。目前研究将连作障碍主要原因分为三大类:(1)作物根部化感物质的自毒作用;(2)土壤微生物结构失衡,微生物种类减少,病原微生物增加;(3)土壤养分亏缺,造成作物生长不良,耐、抗性降低。太子参作为广泛药用根类药材,其产量与品质受连作障碍限制这一问题日益突出[4]。
土壤养分是土壤肥力重要指标,土壤养分的亏缺导致土壤肥力退化和作物产量下降,通过合理施肥调节土壤养分的循环和平衡是提高土壤肥力的主要手段[5-6]。赵庚星等[7]研究表明,耕地利用对土壤养分种类及含量有影响;李建军等[8]研究认为,土壤养分含量及其比例很大程度上决定水稻单产高低和水稻土土壤肥力状况。土壤养分不同,为作物提供养分的能力及对作物消耗养分引起的养分亏缺的缓冲能力也将不同。
目前,关于太子参根部土壤环境随其生长的动态变化情况鲜见系统研究,故本研究以不同土壤养分条件下栽培太子参的根部土为研究对象,从引起连作障碍问题的土壤养分亏缺及微生物结构失衡入手,于太子参不同生长时期测定其根部土壤有机质、碱解氮、全氮、全磷、有效磷、缓效钾、速效钾等化学指标含量及土壤多酚氧化酶、酸性磷酸酶等土壤酶活性与真菌、细菌等微生物群体数量变化,并进行综合评价,探究太子参生长过程中根部土壤环境的时间动态变化情况,综合评价土壤养分对太子参根部土壤环境的影响,拟为指导太子参高效栽培提供理论支撑。
1 材料与方法
1.1 试验区概况
试验地位于贵州省六盘水钟山区大河镇大菁村(26°43′32″N,104°49′49.1″E)。该区域属北亚热带湿润季风气候区,年平均温度12.3℃,最热月(7月)平均温度24.6℃,最冷月(1月)平均温度-0.1℃,年平均总积温在4 410℃~4 806℃;年均降水量1 182 mm,降水量最少月(1月)为17.6 mm,降水量最多月(6月)为243.7 mm;年均相对湿度81%;年日照时数1 200 ~1 600 h,日照百分率28%~36%。
1.2 试验材料
试验栽培品种为太子参施太1号,种根进行栽培,栽培材料经贵州大学农学院王华磊教授鉴定为石竹科孩儿参(Pseudostellaria heterophylla(Miq.) Pax ex Pax et Hoffm.)的种根。
所用试剂抗坏血酸、钼酸铵、酒石酸氧锑钾、HClO4、H2SO4、NaOH、NH4F、HCl、NH4OAc、HNO3及K2Cr2O7均为分析纯。营养琼脂培养基、孟加拉红琼脂培养基和高氏一号培养基均购自上海博微生物科技有限公司。
1.3 田间试验设计
试验地土壤类型为黄棕壤。试验于同一缓坡面选取3个不同土壤养分地块Ⅰ、Ⅱ、Ⅲ,其中,地块Ⅰ土壤养分最高,地块Ⅱ土壤养分其次,地块Ⅲ土壤养分最低(具体土壤养分状况见表1)。采取随机区组设计,不同土壤养分地块各划分3个小区,共9个小区,小区面积为1.2 m×10 m,太子参种根用种量为1 200 kg hm-2,均匀散播。于2015年12月进行播种,底肥为有机肥1 500 kg hm-2,复合肥(N︰P︰K=15︰15︰15)600 kg hm-2,钙镁磷肥(P2O5≥15.0%)1 125 kg hm-2,硫酸钾肥(K2O≥51.05%,Cl≤1.5%,S≥17.5%)150 kg hm-2,其他田间管理均一致。
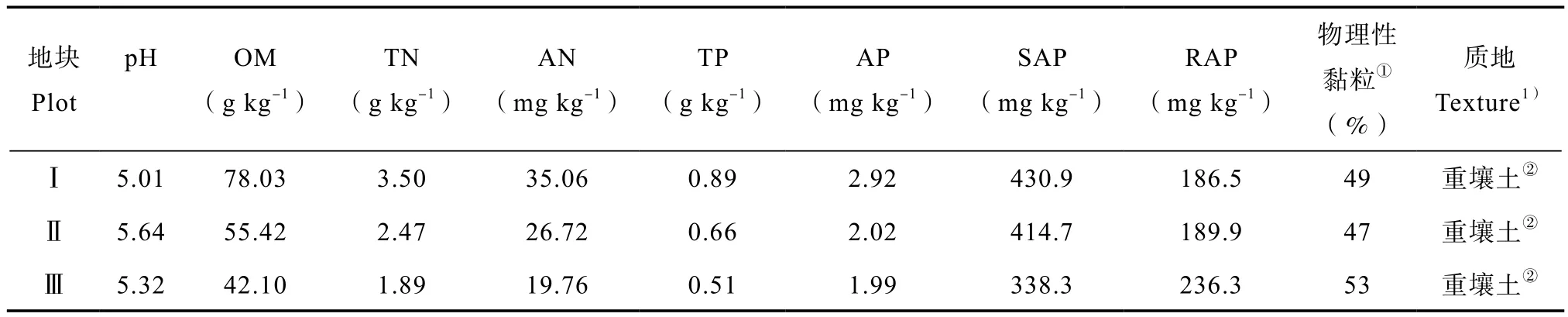
表1 不同土壤养分地块的具体状况Table 1 Soil conditions of the 3 plots different in soil nutrient
1.4 土壤样品采集及处理
太子参苗齐后,视太子参生长状况,每半个月至1个月进行1次采样。每次采样每个小区采用五点法随机选取5个点,挖取太子参植株0~20 cm土层;完整挖取太子参块根后,将挖取的根部土壤完全收集,混匀,去除石头、枯叶等杂质,作为太子参根部土壤。部分鲜土4℃储存,做微生物测定用;部分土样风干,研钵研磨,分别过20目、50目和100目筛,做土壤酶及土壤化学指标测定用。
1.5 测定方法
土壤化学性质测定方法:有机质采用重铬酸钾容量法[9];全氮采用凯氏定氮仪法[10];碱解氮采用碱解扩散法[9];全磷采用HClO4-H2SO4消煮—钼锑抗比色法测定[9];有效磷采用 NH4FHCl浸提[12],ICP-OES测定(OptimaTM8000型,Perkin公司,美国);缓效钾采用热硝酸浸提[9],ICP-OES测定;速效钾采用NH4OAc浸提[9],ICP-OES测定;pH采用电位法测定[11]。
土壤酶活性测定:土壤过氧化氢酶(S-CAT)、土壤多酚氧化酶(S-PPO)、土壤脲酶(S-UE)、土壤酸性磷酸酶(S-ACP)活性分别使用南京建成生物工程研究所土壤过氧化氢酶试剂盒、土壤多酚氧化酶试剂盒、土壤脲酶试剂盒、土壤酸性磷酸酶试剂盒进行测定,土壤酸性转化酶(S-AI)活性使用北京索莱宝科技有限公司土壤酸性转化酶试剂盒测定。S-CAT以每天每克风干土催化1 µmol H2O2降解定义为一个酶活性单位;S-PPO以每天每克风干土产生1 mg紫色没食子素定义为一个酶活性单位;S-UE以每天每克土样中产生1 µg NH3-N为一个酶活性单位;S-ACP以37℃中每克土样每天释放1 µmol酚为一个酶活性单位;S-AI以每天每克土样产生1 mg还原糖定义为一个酶活性单位。
土壤微生物测定:细菌、真菌和放线菌数量均采用平板计数法进行测定[12]。细菌用营养琼脂培养基培养,配方为(g L-1):蛋白胨10.0,牛肉膏粉3.0,氯化钠5.0,琼脂15.0,pH 7.0~7.4;真菌用孟加拉红琼脂培养基培养,配方为(g L-1):蛋白胨5.0,葡萄糖10.0,磷酸氢二甲1.0,硫酸镁0.5,孟加拉红0.0333,琼脂20.0,氯霉素0.1,pH 7.0~7.4;放线菌用高氏一号培养基培养,配方为(g L-1):可溶性淀粉20.0,硝酸钾1.0,氯化钠0.5,磷酸氢二钾0.5,硫酸镁0.5,硫酸亚铁0.01,琼脂15.0,pH 7.1~7.5。
1.6 数据处理
使用E x c e l 2 0 1 6进行数据记录及整理,SPSS19.0进行多重比较、相关性及主成分分析,多重比较采用最小显著差异法(LSD法)进行分析。
2 结 果
2.1 不同养分条件下太子参根部土壤化学性状变化的时间动态
由表2知,4 — 8月,不同土壤养分条件下太子参根部土壤变异度较大的化学指标为全磷、有效磷、缓效钾及速效钾含量,其中地块Ⅰ的变异系数分别为12.77%、34.22%、32.25%和47.81%,以速效钾含量变异最大;地块Ⅱ的变异系数分别为20.47%、24.78%、26.92%和25.89%,这4个化学指标变异度相当;地块Ⅲ的变异系数分别为28.04%、48.73%、27.71%和26.84%,以有效磷含量变异度最大。说明土壤养分不同,对磷素与钾素的调节及缓冲能力不同。根部土壤有机质及全氮含量在太子参生育期内的变异系数随土壤养分的降低而增加,地块Ⅰ~Ⅲ根部土壤有机质含量的变异系数分别为3.11%、9.96%、14.91%;全氮含量变异系数分别为4.58%、8.97%、13.51%。太子参整个生长时期,碱解氮含量和pH的变异度以低养分地块Ⅲ为最大,地块Ⅰ、Ⅱ相对较小,差异不显著,地块Ⅰ~Ⅲ土壤碱解氮含量变异系数分别为12.70%、10.80%、16.69%;pH变异系数分别为2.82%、2.68%、3.81%。综合得知,太子参根部土壤属酸性土,磷、钾元素含量变异度较大,有机质、氮素含量及pH变化范围较小。
2.2 不同养分条件下太子参根部土壤酶活性变化的时间动态
4 — 8月,各土壤养分条件下太子参根部土壤酶活性变异度大小顺序均为S-AI > S-CAT >S-PPO > S-ACP > S-UE,证明太子参根部土壤酶活性的变异度不受土壤养分高低的影响。由表3知,整个生长时期内,地块Ⅰ的太子参根部土壤S-ACP 、S-AI、S-UE、S-PPO、S-CAT活性均值分别为23.44、37.60、1.34、29.36、26.05 U g-1;高土壤养分条件下,太子参根部土壤酶活性的极值集中出现在太子参生长初期及后期。地块Ⅱ太子参根部土壤S-ACP 、S-AI、S-UE、S-PPO、S-CAT活性均值分别为22.08、35.13、1.32、30.07、20.56 U g-1;中等土壤养分下,太子参根部土壤酶活极值较集中出现在太子参生长中期。地块Ⅲ太子参根部土壤S-ACP 、S-AI、S-UE、S-PPO、S-CAT活性均值分别为21.93、35.24、 1.28、29.95、19.53 U g-1;土壤养分低时,太子参根部土壤酶活极值主要出现在太子参生长中期及后期。综合得知,土壤酶作为催化土壤生化反应的专一催化剂,太子参根部土壤酶活性极值在不同土壤养分条件下出现时期有差异,说明土壤酶对太子参养分需求具有较好的调节作用。
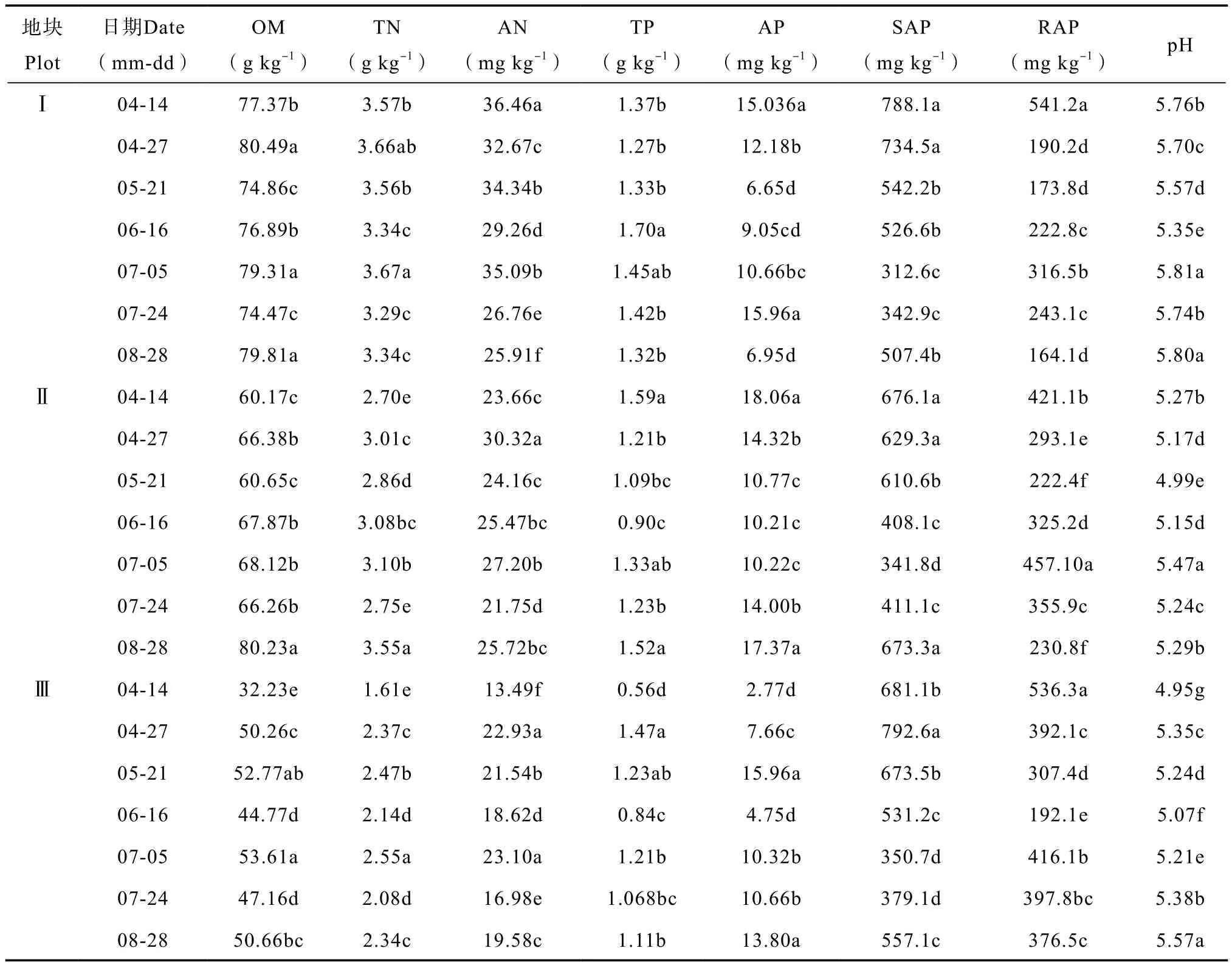
表2 太子参根部土壤化学性状变化Table 2 Variation soil chemical properties in the rhizosphere of Pseudostellaria heterophylla
2. 3 不同养分条件下太子参根部土壤微生物变化的时间动态
由图1可知:4—7月,地块Ⅰ、Ⅱ、Ⅲ太子参根部土壤细菌数量和真菌数量变化趋势一致;7—8月,地块Ⅰ、Ⅲ的土壤细菌菌落和真菌菌落减少,地块Ⅱ的继续增加。整个生长期间,地块Ⅰ、Ⅱ、Ⅲ太子参根部土壤细菌数量变异系数分别为117.8%、108.9%、95.9%,真菌数量变异系数分别为129.5%、124.5%、111.6%。地块Ⅰ、Ⅱ、Ⅲ土壤放线菌数量在整个生长期变化趋势均一致,均为4 — 7月份变化较为平稳,7— 8月急剧增加,变异系数分别为199.2%、208.3%、192.5%。综合可知,太子参种植一茬后微生物种群数发生显著变化,其变异度总体为:放线菌 > 真菌 > 细菌。
2.4 太子参根部土壤各环境指标间的相关性
作物生长中,土壤环境各因子间相互影响,共同作用于作物的生长,具有一定关联性。本研究通过相关分析得出(表4):太子参根部土壤有机质含量、全氮含量、碱解氮含量、全磷含量、pH间呈极显著正相关;有效磷含量与全磷含量呈显著正相关;有机质含量与速效钾含量间呈显著负相关;S-ACP活性与全氮含量、碱解氮含量、S-AI活性呈显著正相关;S-UE活性与有机质含量、全氮含量、碱解氮含量、全磷含量呈显著正相关,与速效钾含量呈极显著负相关;S-CAT活性与碱解氮含量呈显著正相关;细菌数量与有效磷含量、S-UE活性、放线菌数量呈显著正相关,与S-ACP活性呈显著负相关;真菌数量与缓效钾含量呈显著正相关,与速效钾含量呈极显著正相关,与S-UE活性呈显著负相关;放线菌数量与S-AI活性呈显著负相关。可见,太子参根部土壤的化学成分含量、酶活性及微生物种群数量间较多存在显著相关性,直接用这些指标对太子参根部土壤环境进行评价,会出现信息的重叠,影响评价结果的客观性。因此,为进一步了解这些指标间的相关性及其对太子参根部土壤环境的贡献,利用主成分分析方法对太子参根部土壤环境进行综合评价。
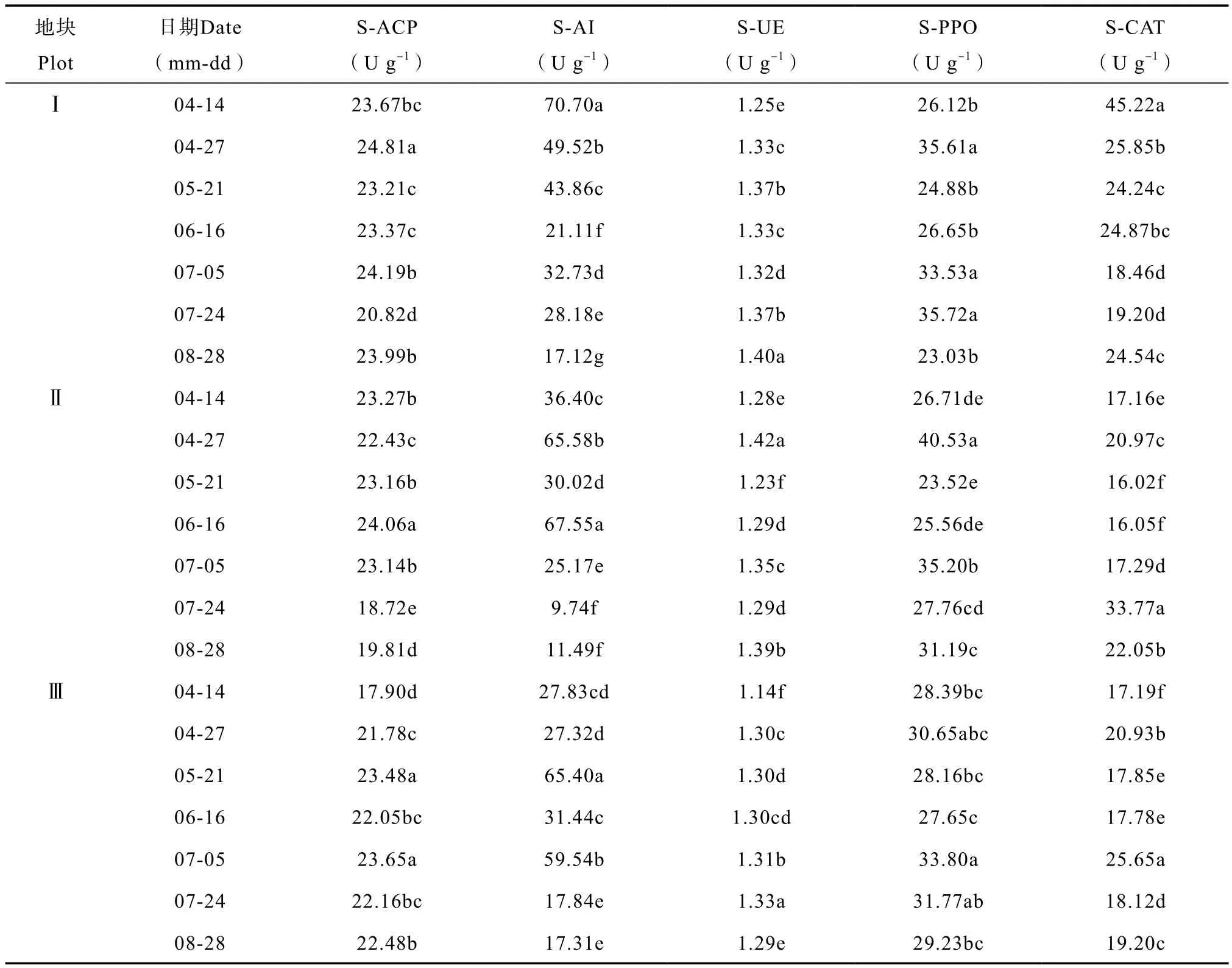
表3 太子参根部土壤酶活性变化Table 3 Variation of soil enzymatic activity in the rhizosphere of Pseudostellaria heterophylla
2.5 太子参根部土壤环境综合评价
将不同养分条件下太子参不同生长时期根部土壤16个环境指标:有机质含量(X1)、全氮含量(X2)、碱解氮含量(X3)、全磷含量(X4)、有效磷含量(X5)、缓效钾含量(X6)、速效钾含量(X7)、pH(X8)、S-ACP活性(X)、S-AI活性(X10)、S-UE活性(X11)、S-PPO活性(X12)、S-CAT活性(X13)、细菌数量(X14)、真菌数量(X15)、放线菌数量(X16)用SPSS19.0进行主成分分析,以基本特征值大于1取得5个主成分,累计贡献率达79.35%,即抽取得到的这5个主成分涵盖了原始数据信息总量的79.35%,能反应太子参根部土壤环境的综合水平。可利用5个主成分作为综合变量来评价太子参根部土壤环境状况。
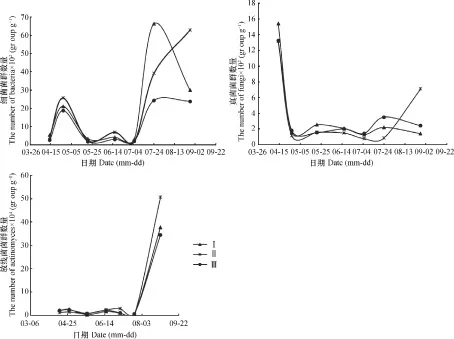
图1 不同养分下太子参根部土壤微生物数量变化Fig.1 Variation of soil microbial community in the rhizosphere of Pseudostellariae heterophylla relative to soil nutrient condition
利用各主成分各指标相对应的特征向量值建立5个主成分的函数表达式,将经过标准化后的数据代入式中,得到不同养分下太子参不同生长时期根部土壤环境在第一主成分至第五主成分的得分;综合得分使用权重法计算,为各成分与相对应的贡献率乘积的总和,即F=F1×32.58%+ F2×16.89% + F3×13.76% + F4×9.35% +F5×6.77%。结果(表5)显示,地块Ⅰ太子参各生长时期的根部土壤综合得分排名均较靠前,在前10名之内,综合得分均值为1.636,说明土壤养分高,对栽培太子参的根部土壤环境具有较好的调节及缓冲作用;地块Ⅱ太子参各生长时期的根部土壤综合得分排名则较居中,综合得分均值为0.0913,说明中等土壤养分对栽培太子参的根部土壤环境具有较好的保护作用;地块Ⅲ太子参各生长时期的根部土壤综合得分排名均较靠后,最后3名均在其中,综合得分均值为-1.727,说明土壤养分低影响栽培太子参根部土壤环境的自我调节,不利于土壤生态系统的持续发展。依据五个主成分得到的综合评分的均值随土壤养分的增加而增加,证明利用抽取的五个主成分进行太子参根部土壤环境综合评价具有可靠性,且更为简化,客观性及实用性强。
3 讨 论
3.1 太子参根部土壤环境变化的时间动态
作物栽培生产过程中,土壤化学性状因作物生长需耗或栽培措施处理而发生改变。朱丹等[13]研究表明,施用谷特菌肥能显著提高土壤全氮、全磷、全钾、有机质、碱解氮、有效磷和速效钾的水平;何进等[14]的研究结果显示,免耕/深松轮耕既可改善土壤理化性状,又可提高作物产量;王玉玲和李军[15]研究认为免耕/深松和深松/翻耕轮耕模式可创造良好的土壤耕层结构,提高土壤养分,促进作物生长发育。综合本研究得知,太子参根部土壤属弱酸性土,pH总体在4.95 ~ 5.81之间,较为稳定。太子参整个生长过程中,土壤有机质、全氮及碱解氮含量变异度较小,较为稳定,但各时期间存在显著差异,且全氮含量均约等于相应时期有机质含量的5%[9]。全磷、缓效钾及有效磷、速效钾含量在太子参生长过程中变异度较大,各时期差异显著,速效钾以高养分地块Ⅰ变异度最大,有效磷以低养分地块Ⅲ变异度最大,中等养分地块Ⅱ能均衡供给和调节太子参根部土壤各种养分。
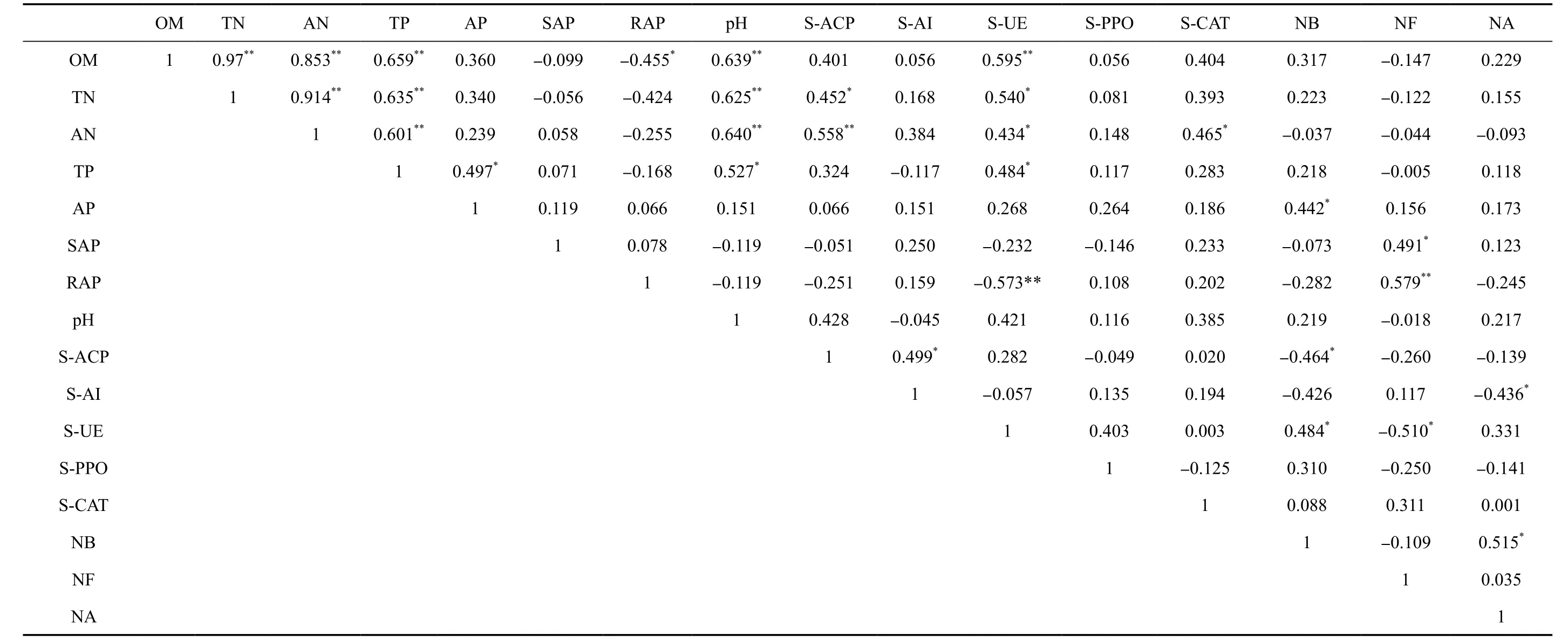
表4 太子参根部土壤各环境指标间的相关系数矩阵Table 4 Correlation coefficient matrix between various soil environmental indices in the rhizosphere of Pseudostellaria heterophylla
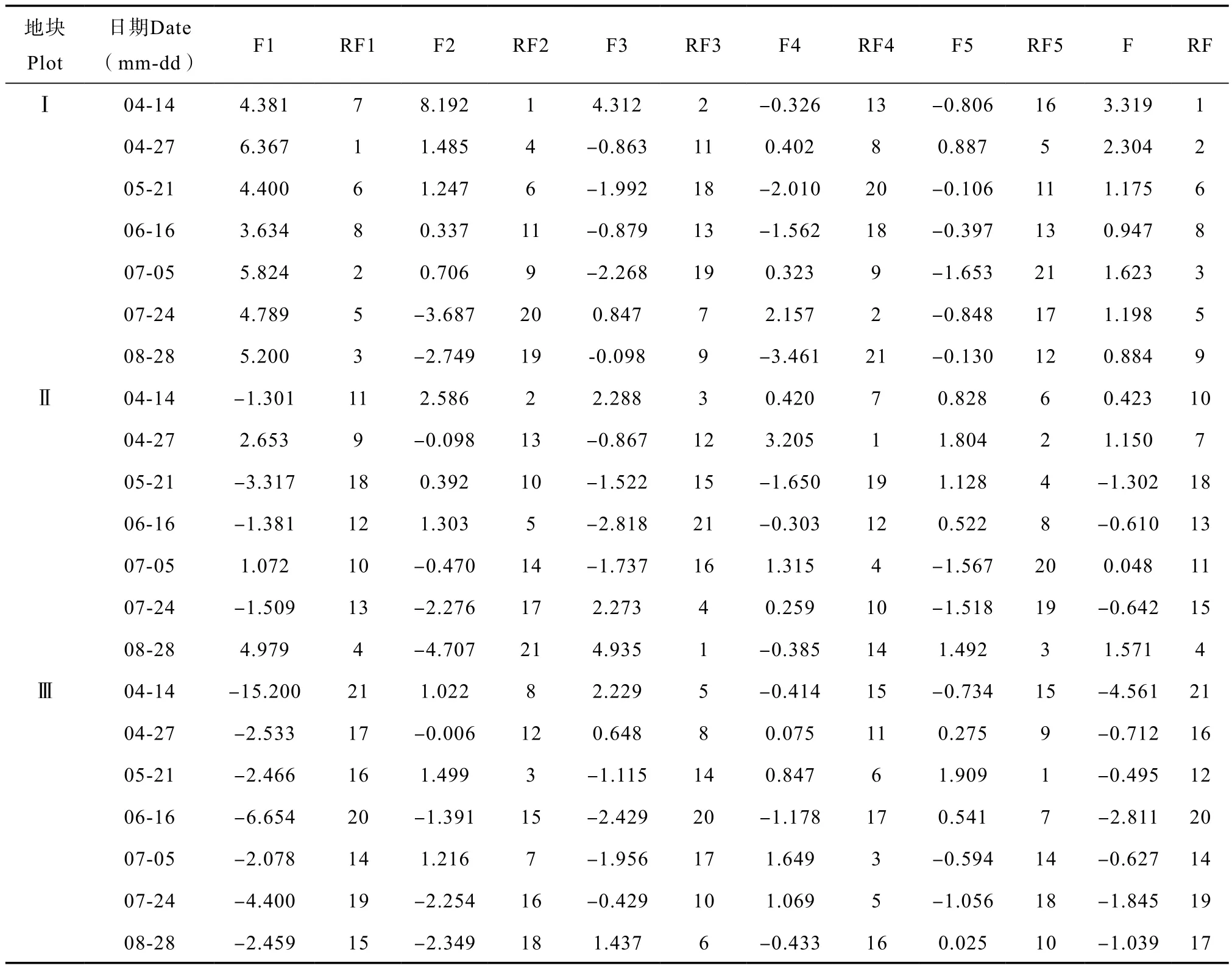
表5 不同土壤养分条件下太子参各时期根部土壤环境指标的各主成分、综合得分及排名Table 5 Principal components, comprehensive scores and ranking of various soil environmental indexes in the rhizosphere of Pseudostellaria heterophylla growing in soils different in soil nutrient condition
土壤酶来源于土壤微生物及动植物活体的分泌,具有催化生物活性的能力[16],其活性可反映土壤中碳、氮分解的方向及强度,通常被视为土壤质量和土壤生物群的指标,也可用于确定农业生态系统的可持续性,特别是土壤理化和微生物过程[17-18]。本研究得出,在太子参生长过程中,土壤S-AI活性变异度最大,变异系数均大于45%,其活性与土壤有机质、氮、磷含量及微生物数量和土壤呼吸强度有关,有效磷含量变异度较大有可能与S-AI活性的变异有关。其次为S-CAT活性变异度较大,S-CAT能促进过氧化氢的分解,利于防止过氧化氢对生物体的毒害作用[19],由结果可知,土壤养分越高,其防止过氧化能力越强。S-PPO能催化土壤中芳香族化合物氧化成醌,醌与土壤中的蛋白质、氨基酸和糖类等反应生成分子量大小不等的有机质和色素[20],而地块Ⅰ~ Ⅲ土壤各时期的S-PPO活性差异不显著,可能为各养分土壤有机质变异度不大的原因之一。S-ACP和S-UE变异度较小,均小于10%,S-ACP能催化土壤有机磷矿化形成无机磷[21-22],结果说明太子参整个生长过程其根部土壤有机磷矿化速度较为平稳;S-UE能催化尿素分解,形成NH+4,从而有利于植物的吸收[22-23],其活性与土壤微生物数量、有机质、全氮和碱解氮含量呈正相关,其变异度与土壤有机质及氮素含量的变异度较为一致。
土壤微生物是土壤生态系统中最活跃的成分,它对有机质分解、营养循环、植物生长的促进或抑制以及各种土壤物理过程发挥着重要作用,土壤环境的变化可改变土壤微生物的种群组成和多样性[24]。本研究发现,土壤微生物种群数量在太子参旺盛生长期变化较小,太子参成熟后微生物种群数量发生改变, 细菌和放线菌菌群显著增加,真菌菌群显著减少,其可能由土壤环境随太子参生长发生变化引起。具体菌种的菌落变化情况有待进一步研究。
3.2 太子参根部土壤环境随时间动态变化的综合评价
土壤环境中的矿质元素、微生物、酶活性及水、气、热等条件间能相互影响,彼此促进或制约,土壤环境的改变是多方面因素多方向作用的结果[25]。本研究通过相关分析得出,太子参根部土壤较多矿质元素含量、酶活性及微生物种群数间存在显著相关性,表明所研究的各土壤环境指标间具有相互作用。其中5种土壤酶以S-UE活性对土壤养分及土壤微生物的影响最大,其活性与有机质、碱解氮、全氮、全磷、速效钾、细菌数及真菌数均呈显著正相关关系,这与刘来等[25]研究结果相一致。因此,人们也常用土壤脲酶活性表征土壤氮素状况。前人研究认为,S-ACP活性与土壤有机质含量、全氮量、土壤pH和微生物数量密切相关[26],本研究得出S-ACP活性与全氮、碱解氮及S-AI活性呈显著正相关,与细菌数呈显著负相关,细菌数还与有效磷呈显著正相关。土壤养分中有机质、全氮、碱解氮、全磷及pH间互相均呈极显著正相关关系。
主成分分析是通过降维将多个指标化为少数几个综合指标的统计分析方法,这些综合指标尽可能地反映了原来变量的信息量,而且彼此之间互不相关[24]。本研究通过主成分分析进行成分提取,得到5个主成分,累计方差贡献率为79.35%,能近似地反映土壤环境的综合情况。成分综合评分的结果显示,地块Ⅰ~Ⅲ的综合得分均值依次为1.636、0.0913、-1.727,说明土壤养分越高,综合得分均值越大,土壤的自我调节及保护能力越强,土壤环境越佳,越利于土壤生态系统的持续性发展。
4 结 论
太子参苗齐后至太子参倒苗期间,不同养分条件下,太子参根部土壤磷、钾元素含量变动均较大,有机质、氮素含量及pH变化范围均较小, pH 4.95~5.81,土壤环境为酸性;太子参根部土壤酶活性的变异度不受土壤养分高低的影响,均表现为S-AI > S-CAT > S-PPO > S-ACP > S-UE;太子参苗齐后,真菌菌落数均显著减少,倒苗后细菌和放线菌菌落数均显著增加。太子参根部土壤的化学性状、酶活性及微生物种群间相关性强;主成分综合评分得出,土壤养分越高,综合得分也越高。
