土壤厌氧消毒对青枯病的控制及土壤细菌群落结构的影响*
2018-08-27伍朝荣林威鹏蔡一霞田纪辉JojiMuramotoCarolShennan蔡昆争
伍朝荣 林威鹏 黄 飞 蔡一霞 田纪辉 吕 顺 Joji Muramoto Carol Shennan 蔡昆争†
(1 华南农业大学资源环境学院,广州 510642)
(2 广西作物遗传改良生物技术重点开放实验室,南宁 530007)
(3 广东省东莞市香蕉蔬菜研究所,广东东莞 523061)
(4 加州大学Santa Cruz分校环境系,CA 95064,USA)
青枯病(Bacterial wilt)是一种由青枯菌(Ralstonia solanacearum)引起的毁灭性土传病害。青枯菌作为一种好氧型细菌,最适生长温度27~35℃,且不含内生孢子和荚膜[1]。它存在明显的菌系差异,根据对不同寄主植物的致病性反应,可分为5个小种,有着广泛的寄主,涉及54个科的450余种植物[2],是世界上危害最大、分布最广、造成损失最大的毁灭性土传病害之一,威胁着热带和亚热带地区的农业生产[3-4]。目前,青枯病的防治主要包括抗病育种、物理防治、生物防治、化学防治、农业管理等,但效果仍不理想。
土壤消毒是一种高效快速杀灭土壤中真菌、细菌、杂草、土传病毒、地下害虫、啮齿动物的技术,是防治设施农业土传病虫害最直接有效的方法之一,主要包括物理消毒、化学药剂消毒和生物熏蒸消毒3大类。周雪青等[5]综合比较了各种土壤消毒方法,认为蒸汽熏蒸技术为最理想的土壤消毒方法,无污染,对任何害虫均有效,但成本太高。目前,化学药剂消毒是使用最广泛、最方便且最有效的方法,但是过度使用会输入大量残留化学物质,造成土壤及水体污染,危及农产品安全,不符合绿色食品和有机食品生产要求。
21世纪初,荷兰[6-7]和日本[8]科学家提出了一种生态替代化学熏蒸控制土传病害的有效方法——土壤厌氧消毒(Anaerobic soil disinfestation,ASD),也称为生物土壤灭菌(Biological soil disinfestations, BSD)或强还原土壤灭菌(Reductive soil disinfestation, RSD)。该方法被应用于各种农作物的土传病害防控,如香蕉、草莓、番茄、芦笋等[9-10]。顾志光[11]和黄新琦[12]等分别运用添加有机物料并淹水来防治辣椒疫病和香蕉枯萎病等真菌性病害,伍朝荣等[13]添加有机物料并覆膜厌氧消毒防控细菌性病害番茄青枯病,均取得良好的防治效果。该方法的基本原理主要是通过向土壤添加易分解的有机碳源,然后灌水和覆膜形成厌氧环境,土壤微生物利用碳源产生大量对土传病原菌有毒有害的分解产物,同时改变微生物群落结构等从而有效防控病虫害。多数研究表明,碳源类型及添加量、土壤类型、温度及处理时长均能直接影响消毒效果[14-15]。Hewavitharana等[16]对比研究了杂草和乙醇作为添加物料对土传病害的影响,发现二者对腐霉属和短体线虫抑制效果无显著差异,产生的挥发性有机化合物(VOC)的量也是同等数量级。Strauss和Kluepfe[17]认为添加量为低于20.2 t hm–2即可形成病菌致命环境,而碳源可以选择当地农作物剩余物。Wen等[18]研究发现,3 t hm–2秸秆添加量及田间持水量厌氧处理与1.5 t hm–2添加量及淹水厌氧处理对镰刀菌抑制无显著差异。此外,厌氧消毒处理时间越长,消毒效果越好[15]。目前,对该方法相关的作用机理尚未清楚,仍需要进一步深入探讨,从而为该项技术的应用提供理论基础和实践参考。Shennan等[10]认为今后应该注重针对不同土传病害防控,优化方法,以及了解并揭示该方法防控病虫害的机理机制。本研究的目的是探索不同碳源ASD对土传病害青枯病防控、土壤改良及土壤微生物群落结构及多样性的影响,从而揭示其对青枯病的防控机理,为实践应用提供参考依据。
1 材料与方法
1.1 供试材料
有机物料:选择市场上容易获得、使用广泛和物料碳氮比差异较大的有机物料作为试验材料。盆栽试验选择米糠、麦麸、茶麸、水稻秸秆,大田试验则为米糠、麦麸、花生麸,均由市场购买,粗粉状,有机物料的碳氮含量及粒径见表1。
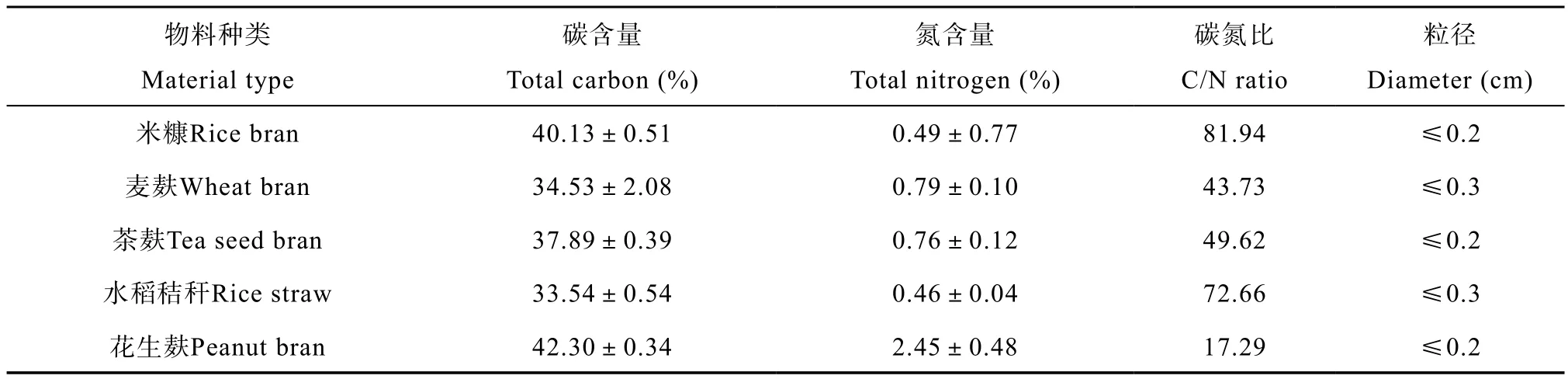
表1 有机物料碳氮含量及碳氮比Table 1 Carbon and nitrogen content and C / N ratio of the organic materials tested
试验土壤:盆栽试验土壤来自广州市增城区 朱村镇朱村(东经113.70°、北纬23.28°)的番茄种植基地,黏性土壤,其土壤特性如下:有机质16.4 g kg-1,全氮0.81 g kg-1,全磷1.12 g kg-1,全钾27.9 g kg-1,碱解氮82.65 mg kg-1,有效磷72.80 mg kg-1,速效钾120.3 mg kg-1,pH4.55,电导率(EC)0.062 mS cm-1。大田试验在东莞市香蕉蔬菜研究所进行,土壤特性如下:pH 5.50,有机质18.32 g kg-1,碱解氮85.35 mg kg-1,有效磷118.3 mg kg-1,速效钾229.17 mg kg-1。
试验番茄品种:盆栽试验选用易感青枯病的品种“台湾红圣女”。大田试验番茄栽培品种为“红艳樱桃番茄”,由广州市农业科学研究院育成。
青枯菌菌种:选用青枯菌生理小种Ⅰ生化型Ⅲ,由华南农业大学园艺学院提供。
1.2 盆栽试验
盆栽试验共设6个处理:对照(CK)、厌氧处理(D)、米糠+厌氧处理(DRB)、麦麸+厌氧处理(DWB)、茶麸+厌氧处理(DTB)、水稻秸秆+厌氧处理(DRS),每个处理6次重复,有机物料添加量均为土重的2%(w/w)。每个处理分别称取2.0 kg供试土壤,20.0 ml青枯菌菌悬液(青枯菌含量108CFU ml-1),相应有机物料40.0 g,分别添加于盆钵中,充分混匀,浇水湿透,转入20 cm×30 cm黑色自封袋中,密封厌氧处理3周。CK处理仅添加菌悬液,D处理不添加有机物料厌氧处理。所有处理于2016年5月8日至5月30日华南农业大学生态农场室外自然温度进行处理,期间日均温度为26.64℃,处理结束取土壤样品待测,并打开自封袋放置数天,排出挥发物。将厌氧处理后的土壤转移至花盆中,每盘移栽2株番茄幼苗。
厌氧处理3周结束,取一份土壤样品测定青枯菌数量,提取土壤全DNA进行微生物高通量测序。另取一份土壤样品测定氧化还原电位(Eh)、电导率(EC)和pH。番茄定植后,定期记录发病率,试验结束后测定番茄植株株高、茎粗、鲜重。
1.3 大田试验
于2016年7月至12月在东莞市香蕉蔬菜研究所内(东经113.41°;北纬23.00°)进行田间试验,供试土壤为番茄青枯病连作障碍土,上茬番茄青枯病发病率达85%以上。试验设置对照(CK)、米糠+厌氧(DRB)、麦麸+厌氧(DWB)和花生麸+厌氧(DPB)4个处理,每个处理3次重复,共12个小区(10 m×1.2 m)。采用随机区组设计,3种有机物用量均按1 kg m-2添加至指定小区,旋耕机充分混匀,铺设滴管并盖膜密闭,灌溉至完全湿透,厌氧处理3周。处理结束,去膜,放置数天,每个小区定植20株番茄幼苗,行距40 cm,株距50 cm。所有处理按照常规进行田间施肥管理,番茄生长前期按照750 kg hm-2施用一次复合肥。在番茄移栽后2、4、6、8周调查番茄青枯病的发病率,成熟期测定番茄株高和产量。
1.4 指标测定方法
土壤青枯菌数量:选用2, 3, 5-氯化三苯基四氮唑培养基[19],采用平板计数法测定土壤中青枯菌数量。
土壤温度:厌氧处理期间,采用红外测温仪于一天中土温最高时段约15:00对土壤表层进行测定,每隔3 d测定一次,共测定5次,取平均值。土壤pH:以1.0 mol L-1KCl作为溶剂土液比1︰5,用雷磁PHS-3C型酸度计测定。土壤电导率(EC):以水土比5︰1提取,SIN CT-TDS3031型电导率仪测定C。土壤氧化还原电位(ORP):采用SX712型ORP计测定。
土壤细菌群落结构及多样性分析:称取0.5 g盆栽试验厌氧消毒处理的土样(6个处理,4个重复,共24个土壤样品),使用试剂盒(MP Biomedical, Santa Ana, USA)提取土壤DNA,用琼脂糖电泳检验提取DNA质量,用微量分光度计Nanodrop1000(Thermo Scientific,USA)测定DNA浓度与纯度,并将其稀释至10 ng μl-1放置于-80℃冰箱中待用。采用带有barcoded 的特异引物341F (5′-CCTAYGGGRBGCASCAG-3′)和806R(5′-GGACTACNNGGGTATCTAAT-3′),扩增16S rDNA的V3+V4区域的片段。PCR体系及程序按照 Phusion High-Fidelity PCR Master Mix(New England Bio labs)说明进行。使用琼脂糖电泳对 PCR产物进行鉴定与分离。使用 Qiagen Gel Extraction Kit (Qiagen, Germany) 对 PCR产物进行回收用于后续建库,产物进行回收用于后续建库,Miseq2500 PE250平台进行测序。
使用Mothurv 1.32[20]对测序序列进行组装,对原始测序数据进行过滤及序列拼接,从24样品总共得到优化序列853597条,优化序列按照97%的相似性,进行OTUs(Operational Taxonomic Units)聚合后,在Green Gene数据库进行比对与注释数据库进行比对与注释[21]。
基于O T U s对细菌α-多样性指数A c e,Chao1,辛普森指数和香农指数进行估算[22-23]。基于样品间OTUs的Unifrac距离,进行主成分分析(Principal component analysis, PCA)[24],为了降低数据噪声,我们使用物种至少在一个样本中包含tags数量达到总tags数量的0.1%作为阈值,对满足该条件的物种进行PCA分析。
1.5 数据处理
不同处理间差异的显著性采用单因素方差分析与LSD法多重比较进行检验(one-way ANOVA,p<0.05),以上统计分析通过SPSS 18.0实现,图和表分别采用Origin 8.0和Office 2010制作。
2 结 果
2.1 土壤厌氧消毒对青枯菌的抑制及番茄生长的影响
由图1可知,除了米糠+厌氧处理(DRB)外,土壤厌氧消毒能有效防控青枯病的发生并促进植株生长。与对照相比,添加有机物料厌氧处理青枯病发病率为0,仅厌氧处理(D)为16.7%。表明土壤厌氧消毒对青枯病防效达100%。除了添加米糠厌氧消毒对番茄生长无显著影响外,其余厌氧处理均显著提高植株鲜重、株高和茎粗。
2.2 土壤厌氧消毒对土壤理化性状的影响
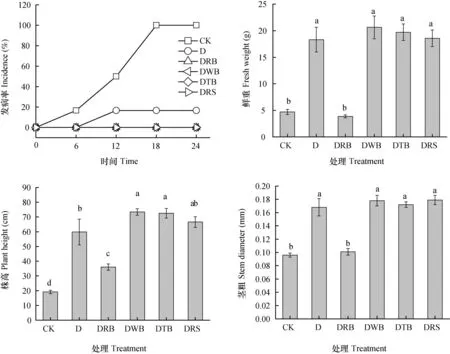
图1 土壤厌氧消毒对盆栽植株发病率及生长的影响Fig. 1 Effect of anaerobic disinfestation of the soil on disease incidence and growth of plants (Pot experiment)
由图2可以看出,所有厌氧处理均显著提高了土壤温度,平均提高6~8℃。与CK相比,单纯的厌氧处理(D)对土壤pH没有显著影响,而不同碳源的ASD处理显著提高土壤pH,提高幅度为8%~13%。厌氧处理均显著降低了土壤Eh,且添加有机物料厌氧处理Eh均为负值,使土壤呈强还原性状态。各处理对EC的影响不一致,与CK相比,添加米糠(DRB)和不添加物料(D)处理EC值无显著变化,而添加麦麸(DWB)、茶麸(DTB)和秸秆(DRS)处理EC值显著提高了10倍以上。
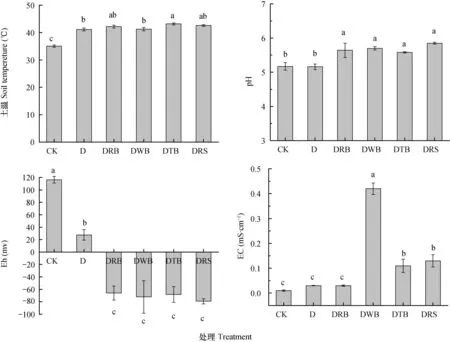
图2 土壤厌氧消毒对土壤理化性质的影响Fig. 2 Effect of anaerobic disinfestation on soil physical and chemical properties
2.3 土壤厌氧消毒对土壤青枯菌数量的影响
由图3可知,与对照相比,添加有机物料的厌氧消毒显著降低了土壤中可培养青枯菌数量,降低幅度为81.0%~96.5%,且降低幅度呈数量级,而单纯的厌氧处理(D)土壤中可培养青枯菌含量与对照无显著差异。
2.4 土壤厌氧消毒对土壤细菌群落结构与多样性的影响
土壤厌氧消毒能显著影响土壤细菌群落多样性。由表2可得,α多样性指数Ace、Chao1、辛普森和香农对不同处理的响应及趋势基本一致,即CK、D和DRB处理均显著高于DWB、DTB和DRS。与对照相比,添加有机物料厌氧处理降低了土壤细0.05 level菌的多样性,降低幅度因添加物料种类而异。
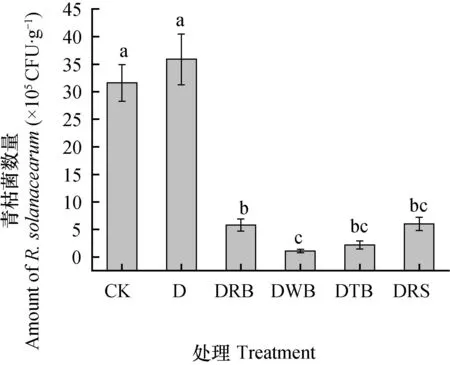
图3 土壤厌氧消毒对土壤青枯菌数量的影响Fig. 3 Effect of anaerobic disinfestation on population of Ralstonia solanacearum in the soil
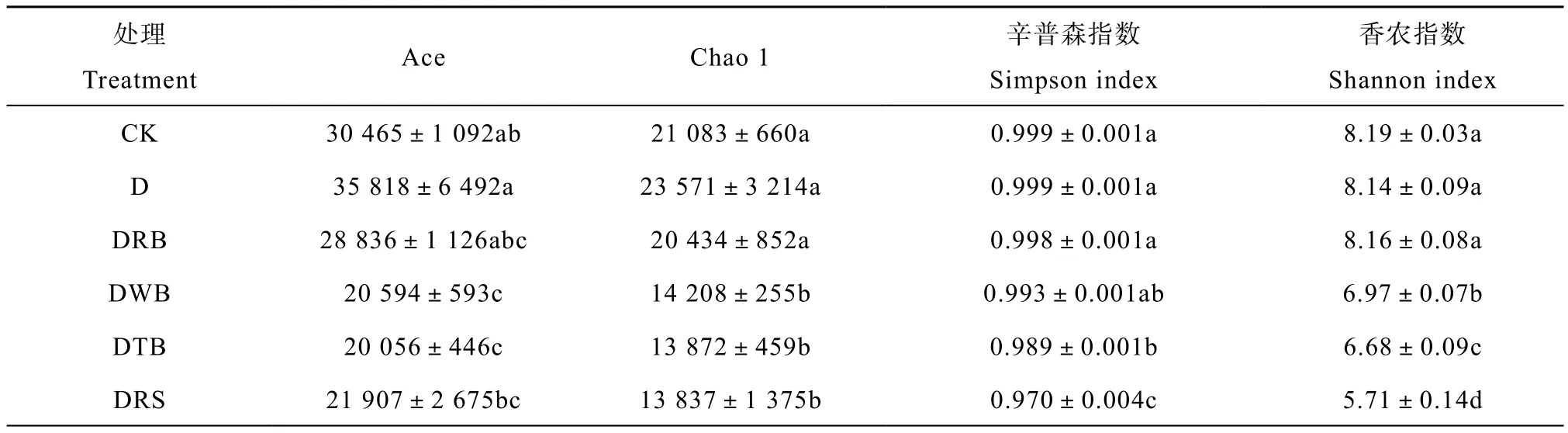
表2 土壤厌氧消毒对土壤细菌群落多样性指数的影响Table 2 Effects of anaerobic disinfestation on soil bacterial diversity index
在门水平下对样品间细菌群落进行主成分分析,以观察不同处理下对微生物影响的相关联性,结果如图4所示。经过PCA降维后,所提取的PC1对总方差的解释率为48.7%,PC2的解释率为15.2%,两者总占比为63.7%。从PC1看,6个处理明显分为两类,第一类在PC1的值为正值,包含DWB(麦麸)、DTB(茶麸)、DRS(秸秆)。第二类在PC1的值为负值,包含CK、D、DRB等。而且有一个非常有趣的现象,6种处理出现两两以Y轴对称分布的现象,CK与DWB对称,D与DTB对称,DRB与DRS对称。

图4 门水平上的主成分分析Fig. 4 Principal component analysis on the phylum level
对不同处理细菌主要门类进行分析,结果如图5。不同处理丰度前10的细菌门类均为泉古菌门(Crenarchaeota)、广古菌门(Euryarchaeota)、酸杆菌门(A c i d o b a c t e r i a)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)、厚壁菌门(Firmicutes)、芽单胞菌门(Gemmatimonadetes)和变形菌门(Proteobacteria),表明厌氧消毒并无改变土壤主要微生物的门类,但能显著改变优势种群的比例。与CK相比,全部厌氧处理的泉古菌门、酸杆菌门、芽单胞菌门及变形菌门细菌相对丰度均有所下降,而添加有机物料厌氧处理组厚壁菌门相对丰度显著增加,其中DWB、DTB和DRS增加最为显著。放线菌门相对丰度在各处理间变化不一,D和 DRB处理较CK显著增加,而DWB、DTB和DRS则显著降低。
厚壁菌门微生物进一步分析表明,厚壁菌门中梭菌科、瘤胃菌科和芽孢杆菌科3个科的细菌变化幅度最大。与对照相比,D、DRB处理组的梭菌科(大部分为厌氧菌)相对丰度无显著差异,而DWB、DTB和DRS显著提高,其中DWB处理数值最高且显著高于其他处理组(图6)。除DTB处理的瘤胃菌科和芽孢杆菌科的相对丰度显著高于CK,其他处理组无显著差异,但总体上表现为DWB、DTB、DRS处理组的相对丰度高于CK、D、DRB。
2.5 土壤厌氧消毒的田间示范效应
由图7可以看出,番茄定植第2周开始发病,CK组发病率始终高于其他厌氧处理组,DRB、D W B、D P B处理番茄发病率较C K分别降低71.2%、55.9%、50.6%。与CK相比,各厌氧处理均显著提高了番茄产量,增幅达2.5倍~4.7倍,其中麦麸+厌氧处理(DWB)产量增幅最大,米糠+厌氧处理(DRB)最小。此外,DWB和DPB能显著提高番茄株高和茎粗,而DRB则无显著影响。值得注意的是,DRB处理组对青枯病防控效果最好,但番茄株高和茎粗均小于CK,植株矮小。
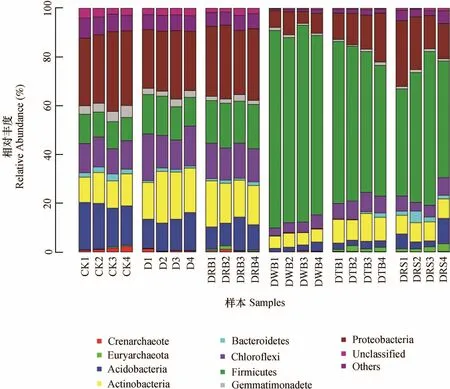
图5 土壤厌氧消毒对土壤细菌群落结构的影响Fig. 5 Effect of anaerobic disinfestation on the bacterial community structure in the soil
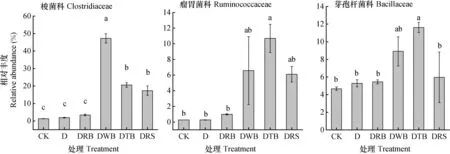
图6 梭菌科、瘤胃菌科和芽孢杆菌科相对丰度变化Fig. 6 Relative abundance of Clostridiaceae, Ruminococcaceae and Bacillaceae
3 讨 论
3.1 土壤厌氧消毒对青枯病的防控作用
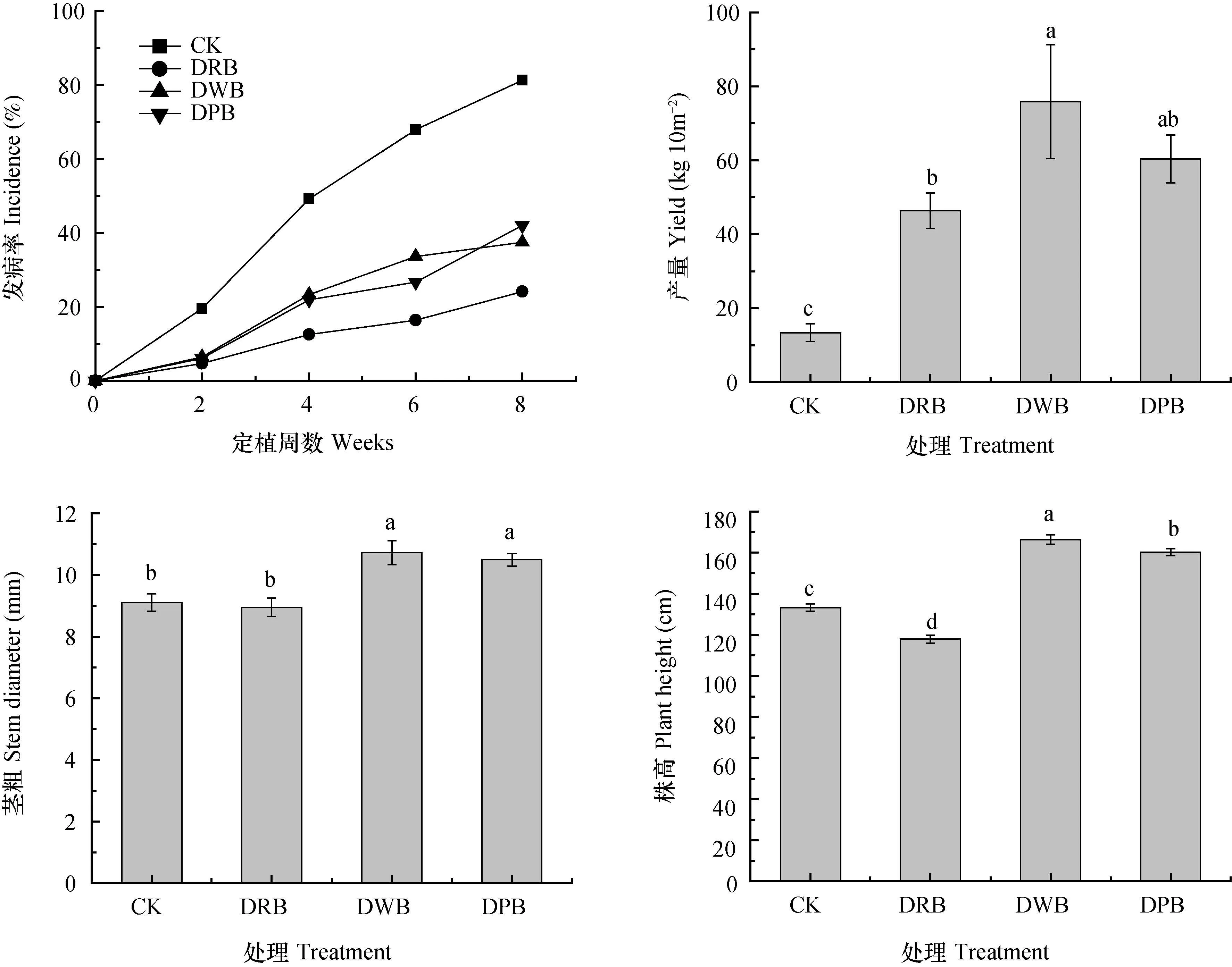
图7 土壤厌氧消毒对大田植株发病率及生长的影响Fig. 7 Effect of anaerobic soil disinfestation on disease incidence and plant growth (Field experiment)
以往研究表明[25],ASD处理能够有效抑制50%~94%的病原细菌、卵菌(oomycete)和真菌,对线虫抑制率达15%~56%,对杂草抑制率达32%~81%,并能显著提高作物的产量。van Overbeek等[26]运用ASD长时间处理青枯菌病土,能使土壤中青枯菌数量降低99.4%以上。伍朝荣等[13]研究发现,ASD对番茄青枯病的防控效果达90%以上,且显著促进了番茄生长。本研究中,盆栽和大田试验结果均表明,不同有机物料(米糠、麦麸、茶麸、秸秆)ASD处理对番茄青枯病具有较好的防控效果,且能促进作物的生长(除DRB外),提高番茄产量。不同碳源添加对青枯菌的抑菌效果与碳源C/N有关(图3),DWB(C/N=43.7)和DTB(C/N=49.6)杀菌效果优于DRS(C/N=72.7)和DRB(C/N=81.9),这与Liu等[27]报道的有机物料C/N与RSD杀菌效果之间存在负相关的结论一致,也是本试验选择不同C/N有机物料的原因。盆栽和田间试验发病率ASD处理均显著低于对照,但田间试验仍呈高状态,原因可能包括:(1)大田作为一个开放状态,ASD处理过程中难以形成与盆栽相对密封厌氧状态;(2)灌溉方式、农用机械工具、人工修剪等病原菌传播,从而影响了实际处理效果。
3.2 土壤厌氧消毒对土壤特性的影响
ASD通过添加有机物料和厌氧发酵,能在短时间内显著改变土壤理化性质,主要包括pH,Eh和EC等的变化。土壤pH变化与添加物料种类和土壤类型有关,大多数研究发现ASD能产生有机酸,使pH小幅度降低[28-29]。本研究土壤pH升高可能与试验用土pH(4.55)较低有关。ASD处理使Eh则由正值快速降低至负值,并持续整个厌氧处理过程,该指标能间接显示土壤已形成厌氧环境[30]。而青枯病原菌是一种好氧型细菌,厌氧条件下,其生长生理等方面可能受到极大的抑制。ASD处理下EC总体上也是呈增长态势,主要是ASD处理过程释出部分正负离子[31]。本试验Eh显著降低和EC的提高均与前人研究结果类似。
3.3 土壤厌氧消毒对土壤微生物群落结构的影响
ASD能在短时间内形成厌氧、强还原性、高温等环境,并能产生挥发性气体、有机酸、低价重金属等各类有毒物质,这导致土壤微生物群落结构也发生变化。土壤微生物群落结构的变化可能是土壤厌氧消毒防控土传病害的机理之一[17]。如病原菌数量减少或致病力降低可以达到防控病害的效果。研究表明,ASD处理能诱导土壤微生物群落结构发生显著变化,增加土壤中的拮抗菌数量从而降低病原菌的危害[6,32-34]。
本研究的土壤微生物高通量测序结果显示,添加不同有机物料(DRB、DWB、DTB和DRS)土壤厌氧消毒中厚壁菌门(Firmicutes)相对丰度大幅提高,其中DWB、DTB和DRS处理的厚壁菌门的相对丰度占主导。该门下的梭菌科和瘤胃菌科(大部分为厌氧菌)、芽孢杆菌科(耐性强)的相对丰度也大幅提升,这与Mowlick[33]结果相似,这些细菌种类可能对青枯菌产生拮抗作用,但仍需进一步验证。比如Ueki等[35]从土壤厌氧消毒处理中分离到梭菌属(Clostridium)的两株厌氧型菌株(H110和TB8)能破坏镰刀菌细胞壁,达到致死该病原菌的作用。Strauss等[36]研究结果显示ASD能改变土壤细菌群落结构,影响致死病原农杆菌和腐霉菌。不同有机碳源的ASD 处理微生物群落结构变化存在一定差异,优势群落相对丰度的增加总体趋势一致。因此,土壤厌氧消毒通过提高厚壁菌门细菌群落丰度,促进厌氧型和耐受型等细菌生长,从而抑制包括病原菌等其他细菌群落生长,达到控制病害的效果。
Tomihama等[37]研究表明农田添加米糠能有效提高土壤中放线菌相对丰度,放线菌含大部分拮抗菌,从而对马铃薯疮痂病的防控有促进作用。本试验添加米糠的厌氧消毒(DRB)番茄株高、茎粗和鲜重等指标均低于CK,但防控青枯病效果较佳,这可能与该处理放线菌相对丰度显著高于CK有关。本研究还初步发现,不同有机物料添加产生的挥发性气体均能有效抑制青枯菌的生长。虽然不同有机物料厌氧消毒产生的杀菌物质不尽相同[16],但也有相同物质产生,有研究发现ASD处理产生的氨气、乙酸和丁酸能大幅度抑制土壤茄劳尔氏菌的数量[28,38]。此外,本实验及相关研究表明ASD处理土壤氧化还原电位变为负值、温度升高、pH升高等引起的厌氧环境的变化,可能不利于青枯菌生长。总之,ASD防控番茄青枯病的机理包括多个方面,而改变土壤微生物群落结构,可能是重要机理之一。
4 结 论
盆栽条件下,通过添加不同碳源ASD处理均能提高土壤pH、土温,形成还原性(厌氧)环境,土壤细菌多样性指数降低,部分厌氧型、耐性强的细菌相对丰度也大幅提升,成为优势种群。这有效抑制了土壤中青枯病原菌数量及其对番茄的侵染,大大降低青枯病发病率。ASD田间示范,同样表现出能显著降低番茄青枯病的发生,促进植株健康生长,大幅提高番茄产量。研究表明,该方法对防控青枯病具有较好效果,值得进一步推广应用。
