山梨酸盐与钙胁迫对甜樱桃灰霉病抗性的诱导作用
2018-08-24徐乐艺张丽媛郭宇欢颜佳薇陈红梅何绪生
徐乐艺,张丽媛,郭宇欢,颜佳薇,陈红梅,何绪生,何 玲*
(西北农林科技大学园艺学院,陕西 杨凌 712100)
甜樱桃(Prunus avium)采收于鲜果淡季,因其风味香甜可口而深受消费者的青睐。此外,果肉中含铁量比苹果高20~30 倍,加之富含褪黑素[1]、维生素、花青素等抗氧化生物素,有“水果中的钻石”的美誉。但甜樱桃皮薄肉软,采收正值高温高湿季节,在贮运过程中极易受致病性微生物侵染而滋生病害导致褐变与腐烂。灰霉病是甜樱桃采后常见的侵染性病害之一,其病原菌灰葡萄孢菌(Botrytis cinerea)具有低温致病的优势,在低温贮运中发病率仍然较高[2]。研究表明,灰霉病与果实中钙含量密切相关,钙处理能够激活果实自身的防御系统及固有的抗菌物质活性,诱导果实产生抗性,降低和抑制病原菌的侵染[3-5]。山梨酸是国际公认的高效、绿色、安全的防腐剂[6],其钾盐山梨酸钾易溶于水,具有广谱的抑菌效果,对霉菌及好氧性细菌均有效强的抑制作用[7]。目前已有报道山梨酸钾对苹果[8]、葡萄[9]、柑橘[10]等果实的多种病害具有良好的诱导抗性效果,但对樱桃灰霉病的抑制效果却鲜有报道。
本实验通过离体实验筛选出山梨酸钾及CaCl2处理的最佳质量浓度,再将采前喷钙和采后山梨酸钾处理相结合,探讨该处理诱导樱桃果实对灰霉菌产生抗性的效果,为甜樱桃贮运保鲜提供新的解决方案。
1 材料与方法
1.1 材料与试剂
‘秦樱1号’甜樱桃于2016年5月18日采收于西北农林科技大学铜川樱桃实验站。采收时尽量保持色泽、大小一致,且无明显机械损伤及病虫害,装在聚乙烯(polyethylene,PE)包装袋(厚度0.03 mm)放入塑料箱中运回冷库,在(0±1)℃条件下预冷24 h后备用。
灰葡萄孢霉购自西北农林科技大学植保学院。
山梨酸钾、CaCl2、葡萄糖、琼脂、磷酸二氢钠、磷酸氢二钠、次氯酸钠、邻苯二酚、愈创木酚、过氧化氢等均为国产分析纯,购买于上海源叶生物科技有限公司。
1.2 仪器与设备
BD-11D型冰箱 安徽中科都菱公司;HHW-21CU-600型恒温水浴锅 国华电器有限公司;SX-500高压蒸汽灭菌锅 日本TOMY公司;DC1212型高速冷冻离心机 北京时代北利离心机有限公司;UV2002型紫外-可见分光光度计 北京普析通用仪器公司;LR250恒温生化培养箱 上海轧艮仪器设备有限公司;WCLL-230BE电热鼓风干燥箱 天津市泰斯特仪器有限公司;电子数显游标卡尺 桂林广陆数字测控股份有限公司;JSM-6360LV扫描电子显微镜 日本电子株式会社;SW-CJ-2FD型双人单面净化工作台 苏州苏净有限公司。
1.3 方法
1.3.1 孢子悬浮液的制备
灰霉菌在23 ℃ PDA培养基上培养7 d后挑取灰霉菌孢子,加入无菌水充分搅拌后过滤。在红血球计数板上调整菌悬液的孢子浓度达到1×106spores/mL。
1.3.2 实验处理
1.3.2.1 离体实验
将PDA经灭菌后冷却至45 ℃左右,加入一定比例的药剂混匀,制成CaCl2质量浓度为5、10、15、20 g/L及山梨酸钾质量浓度为1、3、5、7 g/L的平板,以不加入任何药剂为对照处理(CK组)。每组处理重复3 次,平板凝固后,用灭菌打孔器在中央打孔(直径6.0 mm)并滴入20 μL菌悬液,在23 ℃恒温培养箱中培养,每天测定一组数据,直至CK组菌落长满培养皿。
用上述离体实验筛选出最佳质量浓度的CaCl2与山梨酸钾及二者复合处理制成平板,以不添加药剂的PDA培养基为对照(CK组),取20 μL孢子悬浮液滴在无菌载玻片中央,凝固后滴入10 μL菌悬液,盖上盖玻片后于23 ℃下培养,每组处理重复3 次。每天用扫描电子显微镜观察灰霉菌芽管生长及分生孢子的萌发情况,拍照并记录。
1.3.2.2 活体接种实验
先用体积分数2%次氯酸钠浸泡甜樱桃果实2 min,无菌水冲洗3 次后晾干。实验分为4 组处理:对照组(未处理,CK组)、CaCl2处理组(采前喷20 g/L CaCl2)、山梨酸钾处理组(仅采后5 g/L山梨酸钾浸泡2 min)、CaCl2+山梨酸钾处理组(采前20 g/L CaCl2处理,采后5 g/L山梨酸钾浸泡2 min)。用灭菌的牙签在甜樱桃果面刺3 mm的伤口,伤口表面晾干后,滴入10 μL无菌水。24 h后,在伤口处滴入10 μL灰霉孢子悬浮液,放置于室温(23±1)℃下。每天测定一次数据,直至病菌布满果面,取病斑周围的果肉留样待测相关酶活力指标。每组处理放置20 个果实,设置3 个重复。
1.3.3 指标测定
1.3.3.1 菌丝生长抑制率、芽管生长抑制率及分生孢子萌发抑制率的测定
采用十字交叉法[11]测量(菌落直径为测量值减0.6)菌落直径。用第3天时的病斑直径来计算菌丝的生长抑制率,具体见式(1)。

用Auto CAD 2017软件测量芽管长度,以第1天时在扫描电子显微镜下拍照记录的芽管长度来计算芽管生长抑制率,具体见式(2)。

孢子萌发抑制率以第1天时在电子显微镜下观察到的孢子萌发情况来计算,参照徐大勇等[12]的方法。每个处理分别取3 个视野进行统计,孢子芽管长度大于孢子直径的1/2为萌发,统计孢子总数及萌发孢子数,按式(3)计算萌发抑制率。

1.3.3.2 病斑直径及发病率的测定
每天统计病斑直径,病斑直径采用十字交叉法,取平均值;病斑直径若大于0.5 mm则确定为发病。发病率计算见式(4)。

1.3.3.3 抗性酶活力的测定
多酚氧化酶(polyphenol oxidase,PPO)、过氧化物酶(peroxldase,POD)、几丁质酶(chitinase,CHI)、β-1,3-葡聚糖酶(β-1,3-glucanase,GLU)活力测定参照曹建康等[13]的方法。
丙二醛(malondialdehyde,MDA)含量测定参照高俊凤[14]的方法,结果以鲜质量计。
1.4 数据处理
实验数据采用OriginPro 9.0软件整理并进行方差分析,用Duncan’s做差异显著性检验,P<0.05表示差异显著。
2 结果与分析
2.1 不同质量浓度CaCl2与山梨酸钾处理对灰霉菌菌丝生长的抑制

表 1 不同质量浓度CaCl2与山梨酸钾溶液处理对离体灰霉菌菌丝生长的抑制Table 1 Antifungal effect of different CaCl2 and potassium sorbate concentrations on Botrytis cinerea
由表1可看出,各质量浓度CaCl2处理与0 g/L CaCl2相比对菌丝生长均有抑制作用,其中20 g/L CaCl2处理组菌丝生长抑制率最大,且与其他CaCl2处理组相比差异显著(P<0.05)。山梨酸钾处理组在各质量浓度水平下抑制菌丝生长的效果差异显著,随着山梨酸钾质量浓度的升高,对灰霉菌菌丝生长的抑制效果逐渐增强,在第4天时,5、7 g/L山梨酸钾处理对菌丝生长的抑制率分别为98.18%和100.00%,与1 g/L和3 g/L山梨酸钾处理组差异显著(P<0.05)。5 g/L山梨酸钾处理组菌丝在前3 d未生长,且4 d时菌丝生长抑制率与7 g/L山梨酸钾处理之间差异不显著(P>0.05)。因此采用采前喷20 g/L CaCl2和采后5 g/L山梨酸钾浸泡的方式进行后续实验。
2.2 CaCl2与山梨酸钾处理对灰霉菌芽管生长和孢子萌发的抑制
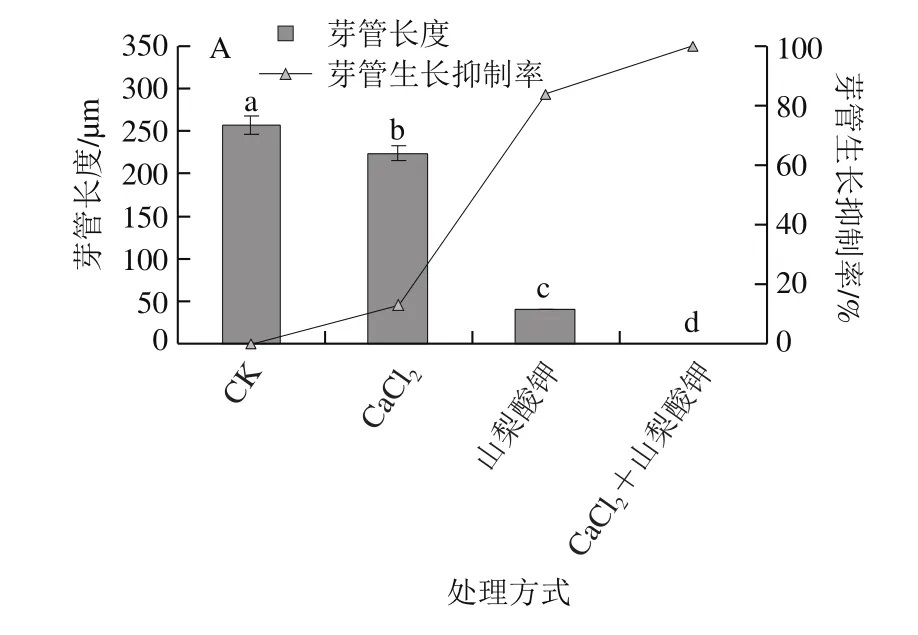

图 1 不同处理对培养1 d的灰霉菌芽管生长(A)和孢子萌发(B)的抑制作用Fig. 1 Inhibitory effects of different treatments on germ tube growth (A)and spore germination (B) on Botrytis cinerea after 1 day
从图1可以看出,灰霉菌经不同处理培养1 d后,与CK组相比,不同处理对灰霉菌孢子萌发及芽管生长的抑制程度不同。山梨酸钾处理组
的芽管长度仅为21 μm,山梨酸钾处理组与CaCl2+山梨酸钾处理组的抑制率高达94%与100%,抑制效果均显著高于CaCl2处理组(P<0.05);如图1B所示,培养1 d后,CK组孢子已经完全萌发,CaCl2、山梨酸钾、CaCl2+山梨酸钾处理组的孢子萌发抑制率分别为26%、84%、100%,CaCl2+山梨酸钾处理组孢子均未萌发,其孢子萌发抑制率显著低于与其他各组(P<0.05)。说明CaCl2结合山梨酸钾处理对灰霉孢子萌发的抑制效果最好。
2.3 不同处理对接种灰霉菌后甜樱桃发病率的影响

图 2 不同处理对接种灰霉菌后甜樱桃病斑直径(A)和发病率(B)的影响Fig. 2 Effects of different treatments on lesion size (A) and incidence (B)in sweet cherry infected with Botrytis cinerea
如图2A所示,病斑直径随接种时间延长而迅速扩展,呈逐渐上升趋势。接种灰霉菌后4 d后,各处理组病斑直径显著低于CK组(P<0.05),其中山梨酸钾和CaCl2+山梨酸钾处理能有效限制病斑直径的扩展,在5 d时病斑直径分别仅为9.46 mm和9.89 mm,两处理组之间差异不显著(P>0.05)。
从图2B可以看出,接种灰霉菌后各组果实均迅速染病,CK组在2 d内发病率高达78.95%,在3 d时全部染病。各处理组发病率显著低于CK组,表现出明显的抗病性。在5 d时,CaCl2、山梨酸钾和CaCl2+山梨酸钾处理组比CK组分别降低了23.90%、25.70%、25.77%。
2.4 不同处理对接种灰霉菌后甜樱桃果实中MDA含量的影响

图 3 不同处理对接种灰霉菌后甜樱桃果实MDA含量的影响Fig. 3 Effects of different treatments on MDA content in sweet cherry infected with Botrytis cinerea
如图3所示,在接种灰霉菌后,甜樱桃果实MDA含量均呈上升趋势。与CK组相比,各处理组的MDA含量均能保持较低水平。在接种后2~3 d,CaCl2处理组果实MDA含量最低,钙能保护细胞膜使其免受损伤。接种后4~5 d,CaCl2+山梨酸钾处理组的甜樱桃果实中MDA含量仅为5.37~6.13 mmol/g,显著低于其他处理组(P<0.05),说明CaCl2与山梨酸钾结合处理可有效减缓果实内部氧化自由基对细胞膜的伤害。
2.5 不同处理对接种灰霉菌后甜樱桃果实PPO和POD活力的影响
由图4A可知,接种灰霉菌后,PPO活力呈现出先升高后降低的变化趋势。各处理组在3 d时达到峰值,此时CaCl2+山梨酸钾处理组的PPO活力显著高于其他处理组(P<0.05),其峰值达0.761 U/g,说明CaCl2结合山梨酸钾的处理可以更快地诱导果实PPO活力的上升,并能使PPO活力在较高水平。
由图4B可知,随病害的扩展,CK组与各处理组的POD活力总体上均呈现先升高后降低的趋势,在整个过程中,各处理组的POD活力显著高于CK组(P<0.05)。CK组、CaCl2及山梨酸钾处理组于接种后3 d达到最大值,其中山梨酸钾处理组较CK组的POD活力提高了84.9%;CaCl2+山梨酸钾处理组则在第4天达到峰值,此时其POD活力是CK组的3.01 倍,且在接种后一直处于较高活力水平。

图 4 不同处理对接种灰霉菌后甜樱桃PPO(A)和POD(B)活力的影响Fig. 4 Effects of different treatments on PPO (A) and POD (B)activities in sweet cherry infected with Botrytis cinerea
2.6 不同处理对接种灰霉菌后甜樱桃果实CHI和GLU活力的影响
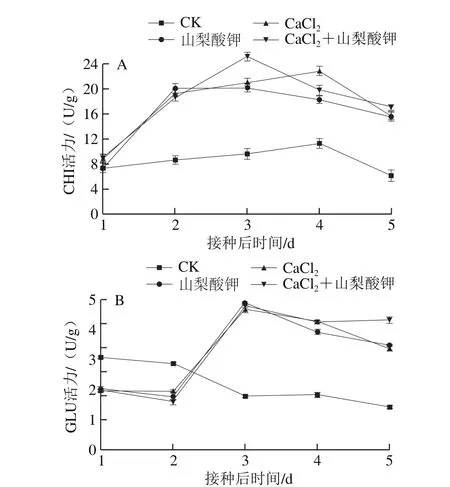
图 5 不同处理对接种灰霉菌后甜樱桃CHI(A)和GLU(B)活力的影响Fig. 5 Effects of different treatments on CHI (A) and GLU (B)activities in sweet cherry infected with Botrytis cinerea
在整个病害观察期,CHI和GLU活力大致变化趋势为先增大再缓慢减小。如图5A所示,接种后1 d开始,CaCl2+山梨酸钾处理组CHI活力迅速上升,各处理组与CK组差异显著(P<0.05)。与其他处理组不同,CaCl2处理组的CHI活力在接种后4 d达到峰值,为22.8 U/g,是CK组的2.57 倍,CaCl2+山梨酸钾处理组的CHI活力整体上高于单独CaCl2、山梨酸钾处理组。
从图5B可以看出,在接种3 d后,不同处理组GLU活力显著高于CK组(P<0.05),CaCl2、山梨酸钾、CaCl2+山梨酸钾处理组GLU活力峰值均出现在接种后3 d,分别比CK组高161.45%、171.68%、166.72%,随后各处理组GLU活力缓慢降低,但在后期仍能够维持较高的活力。与CK处理相比,CaCl2、山梨酸钾及CaCl2+山梨酸钾处理均能在接种3 d后显著提高这两种酶的活力,进一步说明CHI和GLU对果实产生抗病相关蛋白的诱导作用,从而破坏灰霉菌细胞结构,增强甜樱桃果实的抗病性。
3 讨 论
研究发现山梨酸钾的抑菌作用可能是通过改变病原菌的细胞和细胞膜形态结构,抑制其跨细胞膜的转运,进而抑制氨基酸的运输,导致病原菌胞内的酶系统被破坏[15]。陈福元[16]认为病原菌新陈代谢所必需的饱和脂肪酸的氧化、脱氢、发生在α、β位上,山梨酸α、β位上的双键阻止了霉菌脱氢生成不饱和脂肪酸,降低了病原菌的新陈代谢。本实验中,山梨酸钾质量浓度为5 g/L时极大抑制了灰霉菌生长,能抑制灰霉孢子的萌发。这与Smilanick等[15]研究结果相似,山梨酸钾作为抑菌剂在柑橘类水果上使用时,不易被病原菌降解而维持长时间的残留,从而抑制柑橘类采后青霉病的发生。胡春红等[17]研究发现,当山梨酸钾质量浓度达到8 g/100 mL及以上时,抑菌效果已达到显著水平;当质量浓度为1.0~1.2 g/100 mL时,可抑制79%~90%根霉孢子的萌发,抑制菌丝及菌落生长且加速其老化、衰退。李自强等[18]发现用乙醇和山梨酸钾处理鲜食葡萄与使用SO2对葡萄采后灰霉病的抑制效果相当,并且对葡萄无任何伤害。这些均为山梨酸钾在水果贮藏保鲜上的应用提供了参考。
钙是构成植物细胞壁的重要元素,也是构成质膜的重要成分[19],采前喷钙能维持植物细胞细胞壁和质膜在采后的稳定性,进而抑制病原菌的入侵[20]。在研究热液CaCl2处理番木瓜对炭疽病的抑制效果时发现,Ca2+能与果胶酸形成盐桥来降低细胞壁降解酶的活力,增强对真菌的抗性[21]。Ca2+结合在植物的细胞壁和细胞膜上,可减少灰霉菌对细胞壁和细胞膜通透性的改变[22]。因此,CaCl2处理可能是通过增强细胞壁和细胞膜的稳定性来抵抗灰霉菌的侵染。本实验结果表明,CaCl2处理能够抑制离体灰霉菌生长,20 g/L CaCl2与5 g/L山梨酸钾复合处理对接种1 d内的芽管生长抑制率和孢子萌发抑制率均保持在100%,说明CaCl2和山梨酸钾在同一时间内线性增加了果实对灰霉病的抵抗能力,Youssef等[23]在采前和采后对葡萄用钾盐和钙盐处理降低了菌丝生长的实验中证实了这一观点。进一步的研究发现,外源钙处理降低细胞壁降解酶活力及其基因表达,抑制了细胞壁物质的解聚,降低了细胞壁降解酶活力,减缓了果胶、半纤维素的解聚,达到了调控果实膳食纤维含量、维持果实质地品质、延长果实货架期寿命的目的[24]。
在接种实验中,采前喷20 g/L CaCl2、采后5 g/L山梨酸钾及二者复合处理组的甜樱桃果实病斑直径及发病率明显低于CK组。MDA含量是植物细胞膜质过氧化程度的体现[25],其能产生氧化自由基加速果实衰老。各处理组甜樱桃果实中的MDA含量均低于CK组,这与袁陵等[26]得到钙能有效降低奉节脐橙褐变膜脂过氧化的结果相一致。PPO和POD为植物防御体系内两种重要的抗氧化酶类。PPO可将酚类氧化为醌类物质,其对入侵的病原菌具有高毒性。POD能够防止活性氧引起伤害,调控细胞内自由基水平[27-28]。在植物遭受胁迫后,体内诱导合成病程相关蛋白,分解病原菌的细胞结构,植物的抗性反应会使CHI和GLU这两种防御蛋白含量迅速升高,抵抗病原真菌病害[29-31],进而增强耐贮性[32]。CaCl2与山梨酸钾处理能使甜樱桃果实内PPO、POD、CHI和接种3 d后的GLU均保持较高活力,诱导樱桃果实对病原菌产生抗性。以20 g/L CaCl2和5 g/L山梨酸钾复合处理的诱导效果最好,可能是CaCl2与山梨酸钾协同作用诱导了樱桃果实自身防御机制产生抗性,有利于甜樱桃抵抗灰霉菌的侵染,减缓病害的发生。
4 结 论
CaCl2和山梨酸钾处理均能不同程度地抑制灰霉菌菌丝生长,降低孢子的萌发率,最优质量浓度为5 g/L山梨酸钾、20 g/L CaCl2,二者的复合处理能够完全抑制灰霉菌孢子萌发。
在接种实验中,采前喷20 g/L CaCl2、采后5 g/L山梨酸钾处理及二者复合处理明显降低甜樱桃的发病率,抑制病斑的扩展,控制果实中MDA的含量,维持PPO、POD、CHI和接种3 d后的GLU抗性酶的活力处在较高水平,诱导樱桃果实对灰霉菌的抗性。5 g/L山梨酸钾和20 g/L CaCl2复合处理的诱导效果最好。
