红砖茶辅助降血糖功效研究
2018-08-24
(湖北省农业科学院果树茶叶研究所,湖北省农业科技创新中心果茶分中心,湖北省茶叶工程技术研究中心,湖北武汉430064)
糖尿病(diabetes mellitus,DM)是以高血糖为特征的代谢紊乱疾病,其常伴有肾功能衰竭、冠状动脉心脏疾病、失明、缺血性脑病等并发症,是严重危害人类健康的疾病之一[1]。随着人口老龄化趋势的加剧,DM发病呈快速增长趋势,截至2015年末,全球DM患者超3.5亿,我国确诊的DM患者超1亿人,该病已经成为了我国主要的公共健康问题之一[2]。糖尿病在临床上主要通过口服降血糖类药物和注射胰岛素治疗,但上述药物多为化学合成,存在较严重的毒副作用,且难以有效的预防并发症[3]。因此,寻找一类天然、副作用小的辅助降糖物质,是未来DM防治趋势。
茶叶作为一种健康饮品,含有多种天然活性成分,近年来,其降血糖功效得到广泛关注,研究表明,茶叶中茶多糖[4-7]、茶多酚[8-9]对DM老鼠有显著的降血糖效果,对DM小鼠灌喂黄大茶[10]、茯砖茶[11]汤,亦能有效降低其血糖含量。红(米)砖茶[12],由轧制红碎片末茶、切碎红毛茶、红片茶等加工而成,中国特有,湖北特产,在产区,人们有饮用红砖茶防治DM的传统,但缺乏实验支撑。本研究参照《辅助降血糖功能评价方法》中动物实验方法,对红砖茶水提物辅助降血糖功效进行系统分析,以期了解红砖茶对DM动物辅助降血糖功效,为后续红砖茶在预防和防治DM中的应用提供试验依据。
1 材料与方法
1.1 主要仪器与试剂
旋转浓缩仪:上海亚荣生化仪器厂;冷冻干燥机:江苏新申宝科技有限公司;SpectraMax M2全能酶联仪:美国MolecularDevices/MD公司;Eppendorf5804R离心机:德国Eppendorf公司;血糖仪及试纸:艾康生物技术杭州有限公司;链脲佐菌素:美国Sigma公司;胰岛素:上海拜沃生物科技有限公司;甘油三酯、总胆固醇测定试剂盒:北京中生生物工程高技术公司提供。
1.2 供试样品及前处理
1.2.1 样品
红砖茶(2007年生产):湖北赵李桥茶厂有限公司。
1.2.2 前处理
将红砖茶粉碎后,准确称取2 kg粉碎样,按1∶8茶水比(g∶mL)加入沸水(100℃),保温浸提 30 min,每隔10分钟搅拌一次,纱布粗滤,得滤液与滤渣,滤渣继续加入沸水[按茶水比 1∶7(g/mL)],保温浸提 20 min,中间搅拌一次,纱布粗滤,合并滤液,滤纸精滤,减压浓缩至原体积的20%,于-20℃预冻后,冷冻干燥36 h,得茶粉410 g,得率为20.5%,密封包装,-20℃保存备用。
1.3 实验动物
健康成年雄性SD大鼠,体重为130 g~150 g,上海西普尔-必凯实验动物有限公司提供(批准证号:SCXK<沪>2013-0016)。于华中科技大学实验动物中心饲养(实验动物设施许可证号:SYXK(鄂)2010-0057)。环境温度20℃~26℃,相对湿度40%~70%。鼠维持饲料购自湖北天海饲料有限公司。高热能饲料组成为:猪油10%、蔗糖15%、蛋黄粉15%、酪蛋白5%、胆固醇1.2%、胆酸钠0.2%、磷酸氢钙0.6%、石粉0.4%、鼠维持饲料52.6%。
1.4 剂量选择与受试物给予方式
红砖茶人体推荐量,成人60 kg每日饮用10 g干茶,即166.7 mg/(kg·d)。换算成冻干茶粉剂量=166.7×20.5%(得率)=34.2 mg/(kg·d)。动物实验低、中、高剂量组分别按人体推荐量的2.5倍、5倍(大鼠与人的等效剂量)、10倍。
各剂量组受试物均当天新鲜配制,方式如下:1)10倍剂量组:称取3 420 mg茶粉加蒸馏水定容至100 mL;2)5倍剂量组:取50 mL上述10倍剂量组受试物加蒸馏水定容至100 mL;3)2.5倍剂量组:取50mL上述5倍剂量组受试物加蒸馏水定容至100 mL。
大鼠灌胃量1.0 mL/100 g·bw,样品空白对照组和模型对照组同时给予同体积的纯水。
1.5 实验方法
1.5.1 正常动物降糖实验
健康成年大鼠20只,按禁食3 h的血糖水平随机分为对照组和剂量组。对照组给予溶剂,剂量组给予10倍剂量受试样品,连续30 d,测空腹血糖值(禁食同实验前),比较两组动物血糖值。
1.5.2 高血糖模型降糖实验
链脲佐菌素诱导胰岛素抵抗糖/脂代谢紊乱模型法。健康成年大鼠75只,以初始血糖水平随机分5个组,即空白对照组、模型对照组和3个剂量组,维持饲料饲养1周后,模型对照组和3个剂量组更换高热能饲料,喂饲3周后,模型对照组和3个剂量组禁食24 h(不禁水),给予链脲佐菌素25 mg/kg·bw腹腔注射,注射量1 mL/100 g体重。注射后继续给予高热能饲料喂饲5 d。
1.6 有关指标测定及计算
实验期间大鼠每周称体重1次;实验结束,各组动物禁食3 h,检测空腹血糖、糖耐量、血清胰岛素及胆固醇(total cholesterol,TC)、甘油三脂(triglyceride,TG)水平。并计算血糖曲线下面积、胰岛素抵抗指数。

1.7 数据统计分析
采用(SAS9.3软件包)进行T检验、方差分析SNK检验(方差齐时)及Dunnett T3检验(方差不齐时)分析。
2 结果与分析
2.1 红砖茶水提物对正常大鼠空腹血糖、体重的影响
红砖茶水提物对正常大鼠空腹血糖影响如表1所示。
实验前后对照组与高剂量组空腹血糖水平均无显著性差异,表明受试物对正常大鼠的空腹血糖水平无明显影响。
红砖茶水提物对正常大鼠体重影响如表2所示。

表1 红砖茶水提物对正常大鼠空腹血糖水平的影响(X±SD)Table 1 Effects of Hongzhuan tea extracts on FBG of normal rats(X±SD)

表2 红砖茶水提物对正常大鼠体重的影响(X±SD)Table 2 Effects of Hongzhuan tea extracts on body weight of normal rats(X±SD)
实验开始时对照组与高剂量组体重无显著性差异,自第一周末,高剂量组的体重显著低于同期对照组体重,实验结束时高剂量组增重显著低于对照组,表明受试物对正常大鼠的体重有显著控制作用。
2.2 红砖茶水提物对高血糖大鼠血糖、体重的影响
2.2.1 高血糖大鼠模型判定
健康成年大鼠75只,以0、0.5 h血糖水平分5个组,即1个空白对照组、1个模型对照组和3个剂量组,每组15只,如图1所示,实验前正常对照组和模型对照组各组间大鼠血糖指标均无显著差异。

图1 正常组和模型组大鼠实验前后血糖及血糖曲线下面积Fig.1 The FBG and areas under the glucose curve of normal and molel rats before and after the experiment
采用链脲佐菌素(streptozocin,STZ)诱导胰岛素抵抗糖脂代谢紊乱模型法,给模型对照组和低、中、高3个剂量组大鼠注射STZ,实验结束时,如图1所示,空腹血糖、经口给予2.5g/kg·bw葡萄糖后,0.5 h、2 h血糖值及血糖曲线下面积模型对照组均显著高于正常对照组,由此判定糖尿病动物模型成立。
2.2.2 红砖茶水提物对高血糖大鼠糖耐性影响
红砖茶水提物对高血糖大鼠糖耐性的影响如表3所示。在糖代谢紊乱模型成立的前提下,灌喂红砖茶水提物的低、中、高3个剂量组与模型对照组相比,实验结束时空腹血糖值分别下降了30.9%、38.7%、40.6%,0.5 h血糖值分别下降了22.6%、27.2%、38.5%,2 h血糖值分别下降了27.6%、23.5%、38.5%,血糖曲线下面积分别下降了25.4%、26.8%、38.7%,各血糖指标均呈显著性降低(p<0.05)。表明红砖茶水提物能有效降低DM大鼠空腹血糖和改善糖耐性。
红砖茶水提物对实验大鼠血胰岛素浓度和胰岛素抵抗指数影响见表4。模型对照组的胰岛素浓度和胰岛素抵抗指数显著高于正常对照组,说明本研究中所采用糖代谢絮乱模型在导致大鼠血糖指标升高的同时,还刺激机体内胰岛素分泌,使得体内胰岛素水平显著升高,进而导致胰岛素抵抗指数也显著升高。
红砖茶水提物低、中、高剂量组与模型对照组相比,胰岛素浓度和胰岛素抵抗指数均显著降低,其中胰岛素浓度分别降低了26.3%、24.5%、40.4%,胰岛素抵抗指数则分别降低了48.7%、52.2%、68.1%,说明红砖茶水提物能够有效降低DM大鼠的胰岛素浓度和胰岛素抵抗指数,其中高剂量组处理的胰岛素抵抗指数降至与正常对照组相当水平。
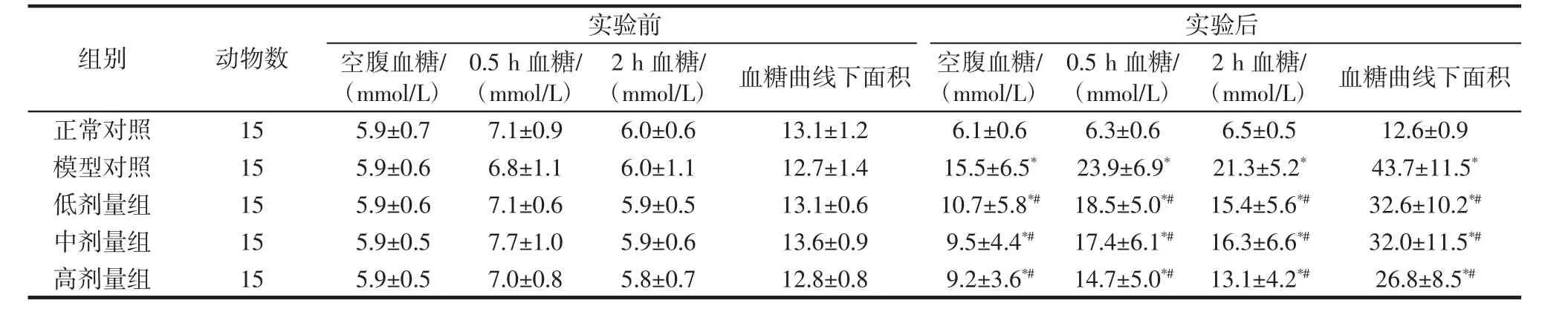
表3 大鼠实验前后空腹血糖及血糖曲线下面积(X±SD)Table 3 The FBG and areas under the glucose curve of rats before and after the experiment(X±SD)
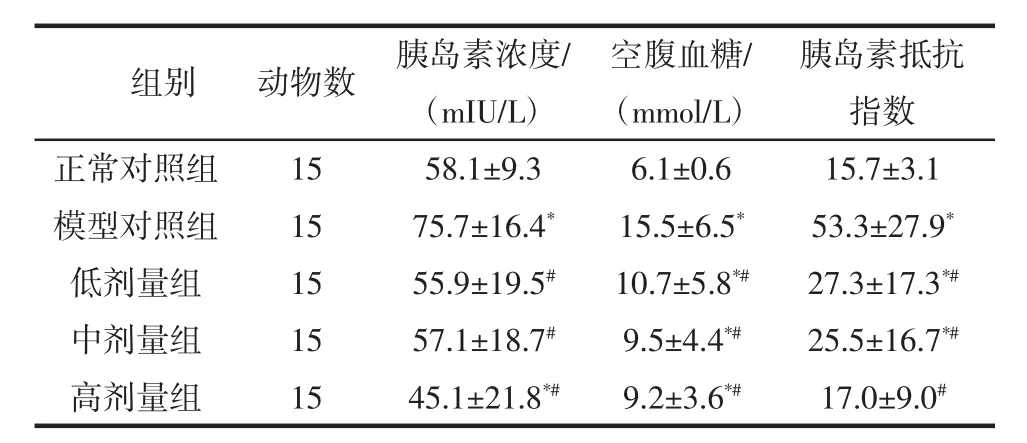
表4 红砖茶水提物对糖尿病大鼠胰岛素及胰岛素抵抗指数的影响Table 4 Effects of Hongzhuan tea extracts on insulin concentration and insulin resistance index of DM rats
2.2.3 红砖茶水提物对高血糖大鼠体重的影响
各组大鼠初始体重均一,基础饲料适应性喂养一周后,除正常对照组外其余4组均采用高热能饲料喂养,结果如表5所示。
模型对照组各期大鼠体重与正常对照组无显著性差异,说明本试验采用糖代谢紊乱模型方法对大鼠体重无显著影响;剂量组大鼠体重与正常对照组和模型对照组比较,低、中剂量组各期无显著差异,而高剂量组大鼠体重在第一周末即显著低于同期模型组和对照组体重,表明在正常饲料喂养的情况下,高剂量组红砖茶水提物可显著降低正常大鼠体重,这与2.1结果一致;在采用高热能饲料喂养和链脲佐菌素诱导胰岛素抵抗糖代谢紊乱情况下,第二、三、四周末及实验结束时,高剂量组大鼠体重均显著低于同期模型对照组,表明高剂量红砖茶水提物可显著降低DM大鼠体重。

表5 红砖茶水提物对糖尿病大鼠体重的影响(X±SD)Table 5 Effects of Hongzhuan tea extracts on body weight of DM rats(X±SD)
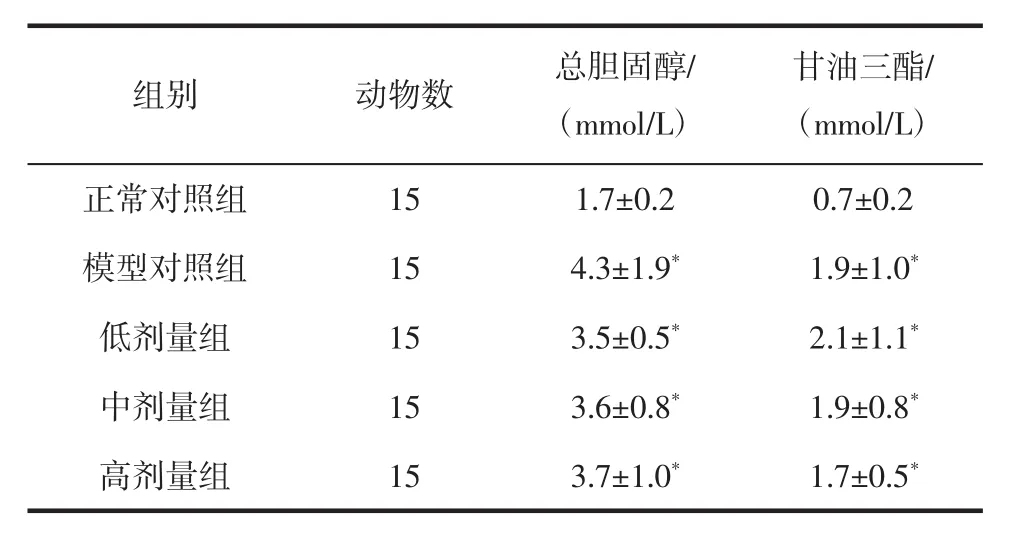
表6 红砖茶水提物对实验大鼠中胆固醇和甘油三酯的影响Table 3 Effects of Hongzhuan tea extracts on TC and TG of experimental rats
2.2.4 红砖茶水提物对实验大鼠血脂指标影响
不同组别大鼠血清胆固醇和甘油三酯水平如表6所示。
实验结束时,模型对照组与正常对照组相比较,胆固醇、甘油三酯指标均显著升高(p<0.05),表明本实验中所采用建模方法,在导致大鼠糖代谢紊乱的同时,亦会导致大鼠脂代谢紊乱;红砖茶水提物3个剂量组与模型对照组相比,胆固醇、甘油三酯指标均无显著差异,说明针对DM大鼠,灌喂红砖茶水提物不会导致其血脂指标上升。
3 结论与讨论
研究表明,灌胃红砖茶水提物对于正常大鼠空腹血糖值无影响。采用链脲佐菌素诱导建立DM大鼠模型,在模型成立的前提下,3个红砖茶水提物剂量组与模型对照组相比,空腹血糖、0.5、2 h血糖和血糖曲线下面积均显著降低,提示该3组受试样品空腹血糖、糖耐量指标结果阳性;血清胆固醇、甘油三酯水平,无显著性差异。根据《辅助降血糖功能评价方法》(国食药监保化[2012]107号)规则“空腹血糖和糖耐量二项指标中一项指标阳性,且血脂(总胆固醇、甘油三酯)无明显升高,对正常动物空腹血糖无影响,即可判定该受试样品辅助降血糖功能动物实验结果阳性”。可判定红砖茶水提物辅助降血糖功能动物实验结果阳性。
与模型对照组相比,红砖茶水提物还能显著降低DM大鼠的胰岛素浓度和改善胰岛素抵抗(IR),其中高剂量组胰岛素抵抗降至正常对照组水平。胰岛素抵抗是指机体胰岛素介导的葡萄糖摄取和代谢能力减低,包括胰岛素的敏感性和反应性下降,机体代偿性的分泌过多的胰岛素,表现为高血糖、高胰岛素血症,是糖尿病的重要发病基础和显著特征[13],并与高血压、高血脂、肥胖等心血管疾病的发生、发展密切相关,被称为上述疾病的“共同土壤”[14],因此,如何控制和改善机体的胰岛素抵抗,对预防糖尿病,乃至整个心血管疾病具有重要意义。目前临床上用于改善胰岛素抵抗的药物,因存在引发心血管疾病风险而受到安全性关注[15],而本实验结果提示红砖茶在改善胰岛素抵抗方面具有一定的潜力。
在实验大鼠成长过程中,与正常对照和模型对照相比,高剂量组红砖茶水提物能显著降低各期大鼠体重,而中、低剂量组则无差异,说明高剂量组红砖茶水提物对正常大鼠和高血糖大鼠的体重增长有抑制作用,其原因是否仅与剂量相关,需要进一步研究分析。
糖尿病常会引起机体的脂质代谢异常[16]。本实验中,模型对照组大鼠血清中总胆固醇及甘油三脂含量显著升高,说明机体的脂质代谢处于紊乱状态。而与模型对照组相比,3个剂量组大鼠的血脂指标变化均不显著,表明针对本次实验中高血糖模型所引发的脂质代谢絮乱,红砖茶水提物改善效果有限。
