保宁醋醋曲中醋酸菌筛选及其代谢产物分析
2018-08-24刘阳邓静吴华昌
刘阳,邓静,吴华昌
(四川旅游学院,四川成都610100)
保宁醋是我国四大传统名醋之一,采用白叩、砂仁、杜仲、当归、五味、薄荷等60多种中草药制曲酿造,使其具有独特的中草药香味,色泽鲜亮、酸味柔和适中、醇香回甜、经久不腐,成为我国传统药醋的典型代表[1-2]。
食醋酿造中的产酸微生物种类繁多,醋酸菌可在醋酸发酵阶段将大量的酒精转化为乙酸,提高产酸量及出醋率。目前在保宁醋酿造研究中,多涉及醋醅中醋酸菌、乳酸菌的分离、产酸能力方面,关于保宁醋固态酿造醋曲中醋酸菌的分离、鉴定及应用研究较少。
本研究采用可培养的方法从保宁醋醋曲中分离产酸微生物,以产酸量、耐酒精能力、耐酸能力为指标筛选醋酸菌,以生理生化试验和16SrDNA相结合进行菌株鉴定,并对其代谢产物进一步分析,探究其在保宁醋发酵过程中的发挥作用,对保宁醋生产和发酵工艺的改良具有指导意义。
1 材料与方法
1.1 材料
1.1.1 材料来源
保宁醋醋曲:四川省保宁醋有限公司。
1.1.2 仪器设备
SHP0201147047电子分析天平:上海恒平科学仪器有限公司;SW-CJ-IF超净工作台:苏净集团苏州安泰空气技术有限公司;LDZX-50FBS立式压力蒸汽灭菌器:上海深谙医疗器械厂;BH200微生物显微镜:宁波舜宇仪器有限公司:S-3C pH计:成都世纪方舟科技有限公司;DY-6C电泳仪:北京市六一仪器厂;S1000PCR扩增仪、GelDoc 2000紫外凝胶成像仪:美国Bio-Rad公司;7890A-5975B气相色谱质谱、Agilent 1200高效液相色谱:美国Agilent公司。
1.1.3 主要试剂
葡萄糖、酵母浸粉、蛋白胨、硫酸铵、硫酸镁、琼脂粉、氯化钙、磷酸氢二钠、磷酸二氢钠、磷酸二氢钾(均为分析纯):成都市科龙化工试剂厂;DL2000 DNA Marker、rTaq酶、dNTP 等聚合酶链式反应(Polymerase Chain Reaction,PCR)相关试剂:大连宝生物有限公司。
1.1.4 培养基
醋酸菌基础发酵培养基:葡萄糖1%、酵母膏1%、pH 4.5,121℃灭菌20 min,使用前加入3.0%(体积分数)95%乙醇。
分离培养基:在基础发酵培养基中琼脂2%,碳酸钙2%。
醋酸菌斜面保藏培养基:葡萄糖1%、酵母膏1%、磷酸氢二钾0.05%、硫酸镁0.05%、琼脂2%,分装试管,121℃灭菌20 min后加入3.0%(体积分数)95%乙醇,摆成斜面即可。
1.2 方法
1.2.1 醋酸菌的分离
样品预处理:称取10 g醋曲样品于装有30 mL ddH2O的离心管中,涡旋均匀,4层纱布过滤后备用;
富集培养及稀释涂布:取2 mL过滤菌液加入已灭菌的基础培养基中,28℃,150 r/min摇床培养24小时后,取1.0 mL菌液于盛有9 mL 0.85%生理盐水的试管中,依次用已灭菌0.85%生理盐水稀释,获得最终浓度为10-3~10-5的稀释液,每个稀释度吸取100 μL稀释液涂布于分离培养基上,30℃倒置培养2 d~3 d;

式中:V为发酵液样品滴定耗用的NaOH体积,mL;V0为空白培养基为对照滴定耗用的NaOH体积,mL;CNaOH为 NaOH 标准溶液浓度,mol/L;60 为乙酸的相对分子质量;V样为样品液体积,mL。
1.2.2.3 醋酸菌的耐酒精能力比较[5]
分别挑取一环菌种接种于液体基础发酵培养基中,30℃、120 r/min培养12小时后活化菌种,向液体基础发酵培养基中添加酒精使其终浓度为3%、5%、7%、9%、11%,再以2%的接种量接种于已添加酒精的液体基础培养基中,30℃、120 r/min培养24 h,在波长600 nm下测定发酵液吸光度。
1.2.2.4 醋酸菌的耐酸能力比较
与醋酸菌耐酒精试验操作相同,其中活化后的菌种以 2%接种于具有不同 pH 值(2.5、3.0、3.5、4.0、4.5、5.0)的液体基础培养基中。
1.2.3 产酸菌的鉴定
产酸菌的生理生化鉴定:参考《伯杰明细菌手册》进行生理生化试验。
DNA提取:参考吉志伟等[6]的方法,提取DNA。
PCR扩增:采用引物27F/1492r对醋酸菌和乳酸菌的16SrDNA区进行特异性扩增,其PCR扩增体系参考文献[7]。测序结果经BLAST同源性比对后,在Mega6.0软件中采用Neighbor-joining法构建系统发育
纯化及保藏:挑取透明圈较大的菌株,划线纯化2次~3次,镜检后接种于斜面试管进行短期保藏,采用甘油保藏法进行长期保藏。
1.2.2 醋酸菌筛选
1.2.2.1 醋酸菌的定性试验[3]
挑取两环醋酸菌菌种接种于基础发酵培养基中,30℃、120 r/min摇床培养2 d~3 d。取10 mL培养液于离心管中,5 000 r/min离心10 min,去菌体。取5 mL无菌培养液,煮沸后,以0.1 mol/L氢氧化钠溶液中和至pH 7.0,滴加5%氯化铁3滴~5滴,产生红褐色沉淀者为醋酸菌,以未接种基础发酵培养基为空白对照。
1.2.2.2 醋酸菌的产酸量测定[4]
挑取醋酸菌菌种接种于30 mL基础发酵培养基中,30℃、120 r/min摇床培养12 h,以2%接种量接种于30 mL基础发酵培养基 [添加7%(体积分数)95%乙醇],再次培养3 d,取1 mL发酵液加入装有20 mL蒸馏水的锥形瓶中,滴加2滴酚酞指示剂,摇匀后用滴定法测定产酸量,每株菌株3个平行,以未接种基础发酵培养基为空白对照,产酸量计算见公式(1)。树,进行同源性分析。
1.2.4 发酵液的挥发性物质分析
将初筛菌株接种于50 mL液体基础发酵培养基,30℃,120 r/min培养5 d,以未接种基础发酵培养为空白对照,准确量取7 mL发酵液于15 mL顶空瓶中恒温(65℃)水浴,将50/30 μmDVB/CAR/PDMS萃取头插入顶空瓶中平衡10分钟后吸附30 min(在固相微萃取装置上实现)后,将萃取头移入气相色谱的高温汽化室中解吸5 min,进行GC-MS分析。
色谱条件:毛细管色谱柱Agilent HP-INNOWax(60 m×250 μm,0.25 μm);手动无分流进样,进样口温度230℃;程序升温45℃,保留3 min,以10℃/min的速率升至200℃,保留5 min;检测器温度230℃;载气He,流速 1 mL/min。
质谱条件:EI电离源,电子能量70 eV,扫描范围10 u~550 u,离子源温度230℃;接口温度230℃。
1.2.5 发酵液的有机酸分析
发酵液前处理:取10 mL发酵液,5 000 r/min离心20 min,准确量取5 mL上清液于100 mL容量瓶中,分别加入2 mL 10.6%亚铁氰化钾(需要避光保存)和2 mL 30%硫酸锌,摇匀后用ddH2O定容。室温下静止沉淀30 min,取澄清液5 000 r/min离心20 min后,取上清液,上清液用0.22 μm微孔滤膜过滤,滤液采用HPLC进行有机酸分析[8]。
液相系统:Agilent1200;Gemini色谱柱:C184.6 mm×250 mm,5 μm;流动相:(NH4)2HPO4/甲醇=95/5,pH 2.7;进样体积:20 μL;流动速度:0.4mL/min;柱温:20℃;检测器:UV 210 nm。
标准溶液的配制:准确配制6种有机酸混合标准溶液,混合标准溶液的浓度见表1。

表1 有机酸混合标准溶液的浓度Table 1 Concentrations of mixed standards solution for organic acid
分别取不同体积(1.0、3.0、4.0、5.0、6.0、8.0、10.0)的混合标准溶液于10 mL容量瓶中,以ddH2O定容,配制不同浓度的混合标准溶液。
有机酸的定性、定量分析:以保留时间和样品加标定性,将不同浓度的有机酸标准溶液在同样的色谱条件下进样,以有机酸浓度为横坐标(mg/mL),有机酸峰面积(mV)为纵坐标,绘制标准曲线,采用峰面积外标法定量,得到不同有机酸的线性范围、回归方程及相关系数。有机酸计算见公式2。
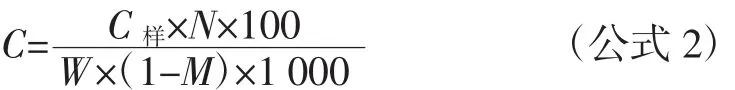
式中:C为醋醅中有机酸含量,g/100 g干醅;C样为由有机酸标准曲线所得有机酸浓度,mg/mL;N为样品稀释倍数;W为醋醅质量,g;M为醋醅水分含量,%。
2 结果与分析
2.1 醋酸菌的筛选
2.1.1 醋酸菌的定性试验
根据碳酸钙透明圈的大小及菌落形态差异,从分离培养基上得到产生透明圈的15株醋酸菌,分别命名为A1~A15,并对15株产酸菌进行醋酸菌定性试验,取一定量的醋酸菌发酵液,离心后进行醋酸菌的定性试验,其结果如表2所示。
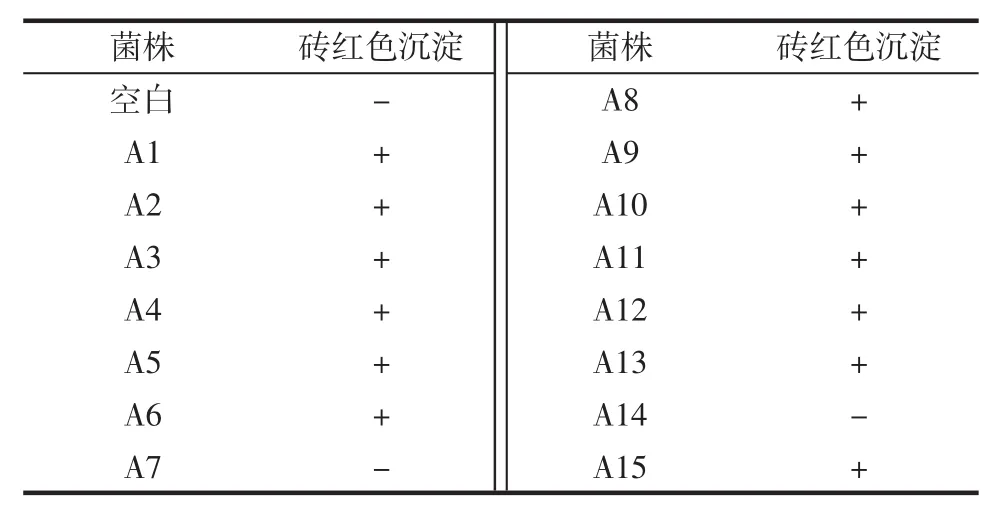
表2 醋酸菌定性试验Table 2 The qualitative test of acetic acid bacteria
如表2知,除空白组、菌株A7、A14以外,均可产生砖红色沉淀且沉淀含量有所差异,所以,13株产酸菌初步鉴定为醋酸菌,进一步对13株菌株进行产酸量测定。
2.1.2 醋酸菌的产酸量测定
采用滴定法测定13株醋酸菌发酵液中总酸含量,其结果如图1所示。

图1 醋酸菌的总酸含量Fig.1 The total acid content of acetic acid bacteria strains
由图1可知,12株醋酸菌的产酸量均在8.00 g/L以上,菌株A12的产酸量最低,仅为5.65 g/L,产酸量较高的为菌株 A11、A9、A10、A5,其中 A11 的产酸量最高,达到 30.90 g/L。故选用 A11、A9、A10、A5 进行后期试验。
2.1.3 醋酸菌的耐性试验
醋酸菌菌株在不同酒精浓度和pH值的液体基础发酵培养基中培养24小时后,在波长600 nm处测定发酵液的吸光度。分别以酒精浓度和pH值为横坐标,以发酵液吸光度为纵坐标,绘制醋酸菌的耐性曲线,其曲线如图2所示。

图2 醋酸菌耐性试验Fig.2 The resistant test of acetic acid bacteria
由图2可知,随着培养基中酒精浓度的逐渐增加,菌株 A5、A9、A10、A11发酵液在 600 nm 处的吸光度均呈现下降趋势,在酒精浓度为3%时,4株醋酸菌的吸光度大致相同,无明显差异,在酒精浓度由5%增加至9%时,菌株A5、A9、A10发酵液的吸光度迅速下降至0.4附近,菌株A11也呈现下降趋势,相对于其余3株而言,其下降趋势更为缓和。在接种量相同的情况下,以总趋势来说,菌株A11在5个不同的酒精浓度下,其发酵液的吸光度均高于其他3株醋酸菌,表明菌株A11的耐酒精能力均高于其他三株菌。
随pH值的不断增加,4株醋酸菌发酵液的吸光度呈上升趋势,在pH值为2.5~4.0之间时,4株醋酸菌的发酵液的吸光度均出现明显的增加,在pH值为3.0~4.0时,菌株A5、A9、A10发酵液吸光度随pH值变化最为明显,菌株A11的变化趋势更为平缓。菌株A11在pH值为3.0~3.5时变化最明显,在pH值为3.5后,变化趋势逐渐平缓,且在不同的pH值下,菌株A11发酵液的吸光度均高于其他3株醋酸菌,表明菌株A11的耐酸能力强于其他3株醋酸菌。
2.2 生理生化鉴定及16SrDNA分子鉴定
2.2.1 A11的生理生化鉴定
将菌株A11接种于醋酸菌分离培养基,观察其菌落形态,通过革兰氏染色观察其个体形态,对其进行部分生理生化试验。其菌落形态及个体形态结果如图3所示。
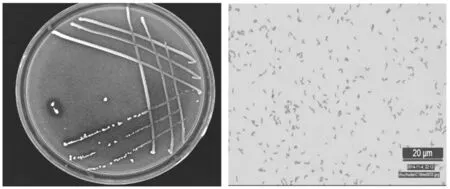
图3 醋酸菌的菌落形态和个体形态Fig.3 The colony morphology and individual morphology of acetic acid bacteria
如图3所示,醋酸菌A11的菌落形态为:乳白色稍黄,圆形或椭圆,菌落较小,边缘整齐,不透明,湿润有光泽,易挑起。其在100倍油镜下的个体形态为:粉红色,短杆状,单生或少数对生。其生理生化试验如表3所示,参考《伯杰明细菌手册》,可将该菌株初步归为醋杆菌属。
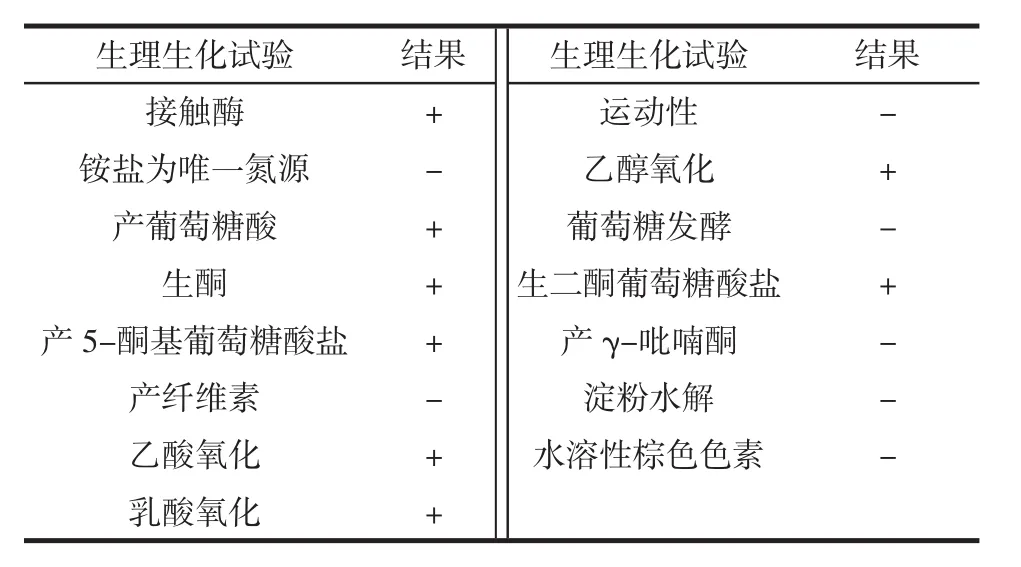
表3 醋酸菌的生理生化鉴定Table 3 Physiological and biochemical identification of acetic acid bacteria
2.2.2 A11的16SrDNA分子鉴定
以醋酸菌A11的DNA为模板,27F/1492r为引物,进行PCR扩增,其扩增产物以1%的琼脂糖电泳检测,其扩增结果如图4所示。并送往上海杰李生物有限公司测序,BLAST基因比对后,采用MEGA6.0软件构建系统进化发育树,结果如图5所示。
如图5所示,菌株A11与醋酸杆菌(Acetobacter sicerae LMG 1531)在发育树的同一分支上,同源性达到99%,故可认为菌株A11为醋酸杆菌(Acetobacter sicerae)。
2.3 醋酸菌代谢产物分析
2.3.1 醋酸菌A11发酵液中挥发性物质分析
采用HS-SPME-GC-MS法检测醋酸菌发酵液中的挥发性成分种类及相对含量,图6、图7分别为接种醋酸菌发酵前和醋酸菌发酵结束后挥发性物质检测结果,空白培养基和发酵液挥发性成分见表4。

图4PCR扩增电泳图Fig.4 The amplification electrophoresis pattern of A11

图5 A11系统发育树示意图Fig.5 The phylogenetic tree of the strain A11

图6 空白培养基的总离子流图Fig.6 The ion-flow graph of blank fermentation broth
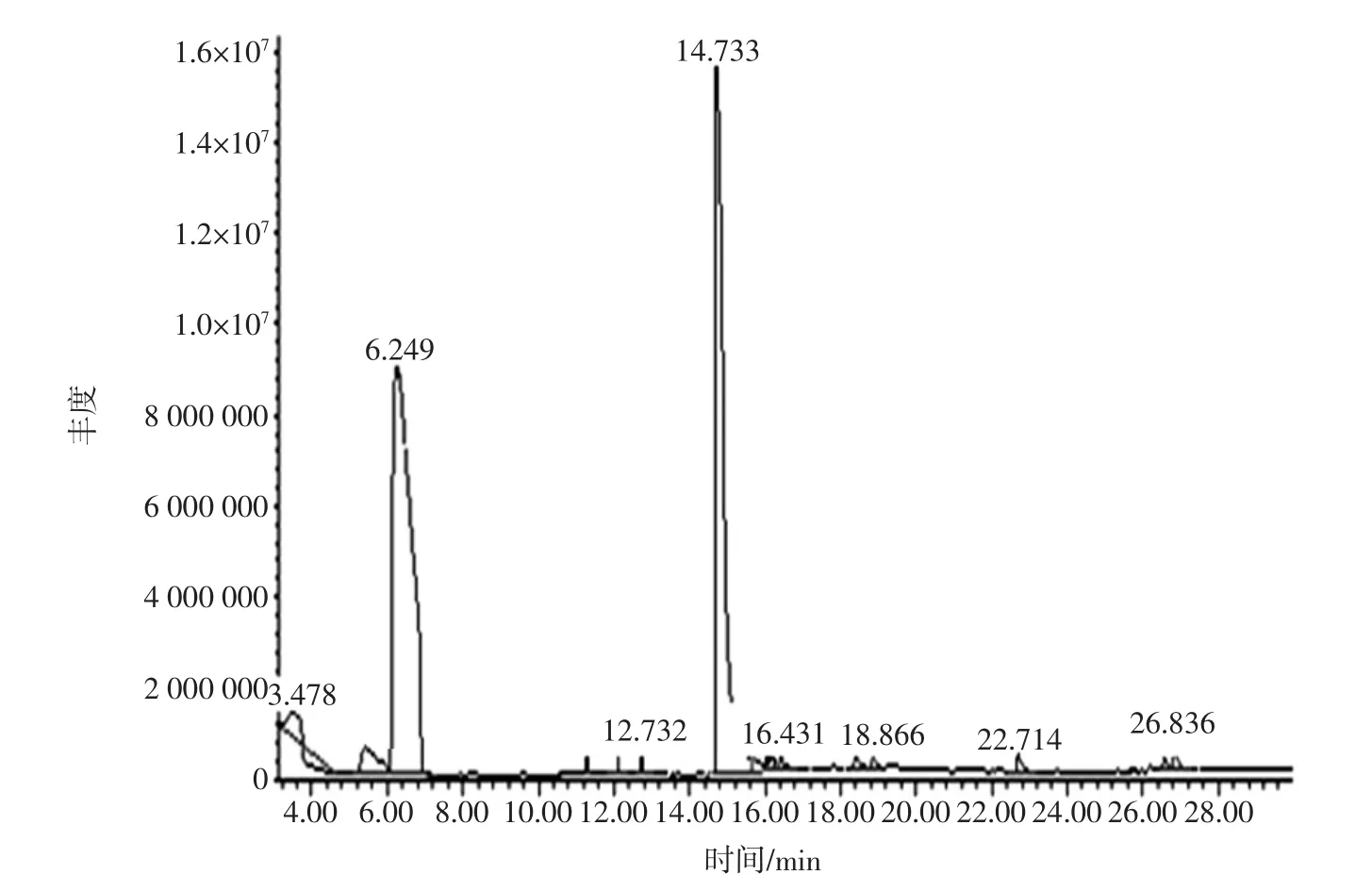
图7 醋酸菌A11发酵液的总离子流图Fig.7 The ion-flow graph of the fermentation broth of acetic acid bacteria A11

表4 醋酸菌A11发酵液中挥发性成分Table 4 Volatile components of the fermentation broth of acetic acid bacteria A11
表4中空白培养基和A11发酵液分别检测出8种和10种物质,其中空白培养基中,主要成分为乙醇,其相对含量为91.79%,为A11发酵酸化提供原料;在A11发酵液中,共生成7种新代谢产物,分别为乙醛、3-羟基-2-丁酮、乙酸、乙酸铵、芳樟醇、S-(Z)-3,7,11-三甲基-1,6,10-十二烷三烯-3-醇、橙花叔醇。其中3-羟基-2-丁酮具有水果香、奶油香,常用于奶香、草莓香等香精的制备及直接添加使用[9],同时也是四甲基吡嗪的重要的前提物质[10]。除此之外,发酵液中乙醛的相对含量较低,仅为0.388%,但低浓度的乙醛溶液具有愉快的青苹果香味[11],是重要的呈感官特征的醛类化合物。A11发酵液中,主要的挥发性物质为乙醇和乙酸,其相对含量分别为52.659%、39.25%,相比空白培养基而言,乙醇相对含量从91.79%降至52.659%,其乙酸相对含量增加了39.25%。表明醋酸菌A11将大量乙醇转化为乙酸。同时甲氧基苯基肟、2,4-二叔丁基苯酚相对含量均有所增加。
2.3.2 发酵液中有机酸分析
制定有机酸标准曲线:分别精确称取6种有机酸,配制有机酸混标溶液,并分别制备不同浓度的混标溶液,进样分析,以有机酸含量X(mg/mL)为横坐标,峰面积Y(mV)为纵坐标,绘制标准曲线,得到线性方程,有机酸色谱图和线性方程如图8和表5所示。
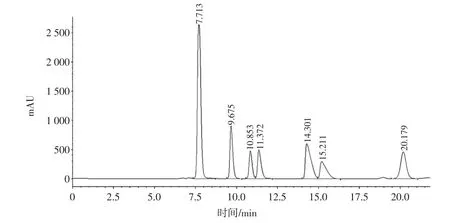
图8 有机酸标准色谱图Fig.8 The chromatogram of standard organic acid
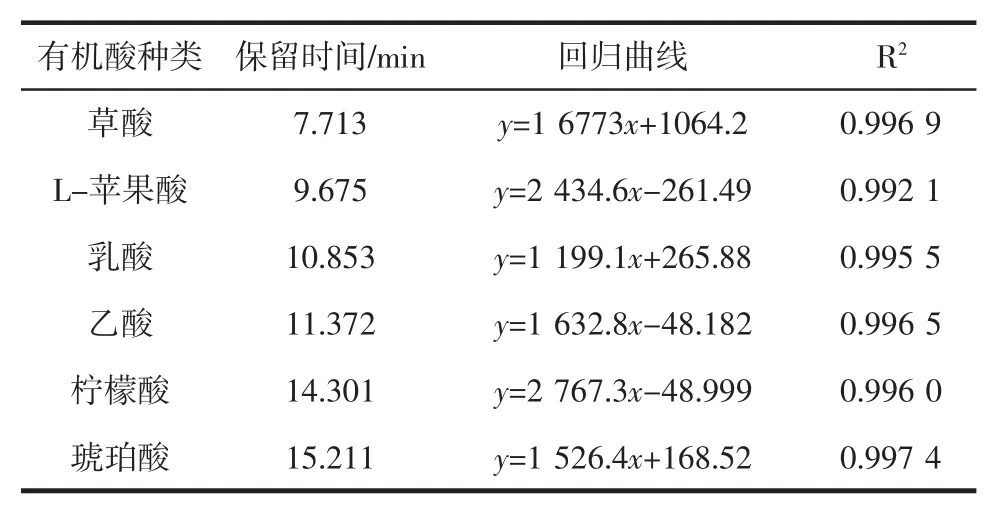
表5 有机酸的回归曲线及相关系数Table 5 Regression curve and correlation coefficient of organic acids
由图8可知,在该色谱条件下,6种有机酸可完全分离,表明该色谱条件可用于分离有机酸。由表5可知,6种有机酸标准品的回归相关性良好,可用于有机酸的定量分析。
醋酸菌A11发酵液中有机酸的分析:采用高效液相色谱法检测醋酸菌发酵液中的有机酸的种类及相对含量,其结果如图9、表6所示。
由表6知,对A11菌株的发酵液进行6种有机酸的测定,发现醋酸菌A11发酵液中只检测到两种有机酸,分别为乙酸、柠檬酸其保留时间分别为乙酸11.412 min,柠檬酸14.406 min。A11液态发酵主要生成大量的乙酸,其产量达到542.88 mg/100 mL,柠檬酸产量为17.21 mg/100 mL。
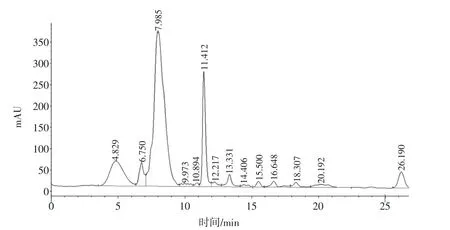
图9 醋酸菌A11发酵液中有机酸色谱图Fig.9 The organic acid chromatogram of the fermentation broth of acetic acid bacteria strain A11
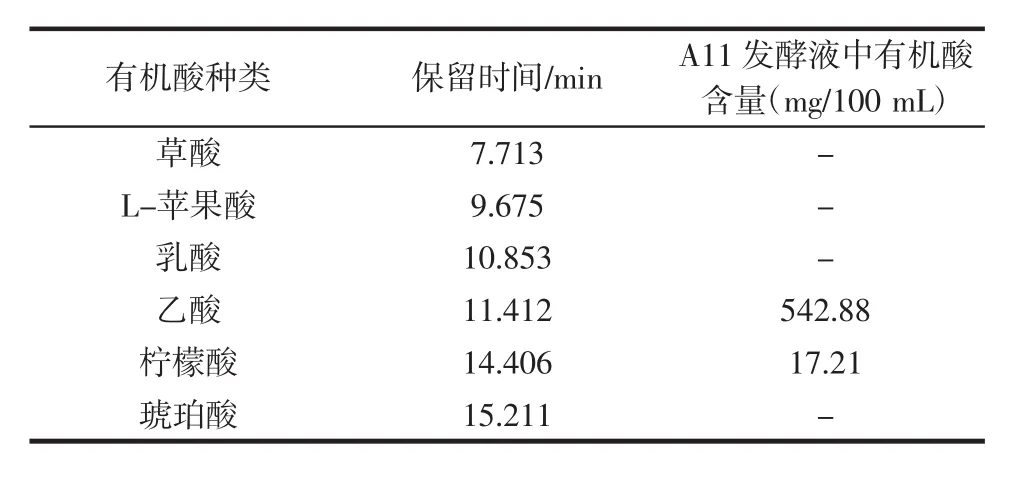
表6 发酵液中有机酸检测Table 6 Detection of organic acid in the fermentation broth
3 结论
从保宁醋醋曲中筛选到13株醋酸菌,通过定性、产酸量、耐酒精能力、耐酸能力试验,筛得一株产酸量为30.90 g/L的醋酸菌,其耐酸和耐酒精能力均优于其他菌株。经生理生化试验及16SrDNA试验鉴定其为醋酸杆菌(Acetobacter sicerae)。采用固相微萃取-气质联用法和高效液相色谱法分析醋酸菌A11发酵液中的风味物质和有机酸含量,醋酸菌A11主要是将乙醇转化成乙酸,其他挥发性物质较少,相对含量不高,有机酸共检测到乙酸和柠檬酸,其乙酸含量可高达542.88 mg/100 mL。醋酸菌在食醋发酵过程中发挥重要作用,而此次所得醋酸杆菌产酸能力突出,其对保宁醋工业生产和发酵工艺的改良具有指导意义。
