猪繁殖与呼吸综合征病毒感染对上市猪屠宰场肺部病变评分的影响
2018-08-24曲向阳宋岱松李柏立孙江才宋志强任夫波孙英军师保浚周明明赖清华杨汉春
曲向阳,宋岱松,周 磊,李柏立,孙江才,宋志强,夏 天,任夫波,孙英军,师保浚,周明明,赖清华,杨汉春
[1.中国农业大学动物医学院,北京 海淀 100193;2.环山集团股份有限公司养猪事业部,山东 青岛 266000;3.默沙东动物保健品(上海)有限公司 ,上海 徐汇 200030]
猪繁殖与呼吸综合征(PRRS)是以引致繁殖障碍与呼吸系统疾病为主要特征一种重要的猪病毒性疾病。1995年我国华北地区发生首个病例,2006年后暴发高致病性PRRS,造成高发病率、高死亡率。因猪繁殖与呼吸综合征病毒(PRRSV)变异性强,疫苗免疫效果不佳,给全球养猪业造成了巨大经济损失。据Holtkamp等[1]测算(2012),美国每年因PRRSV感染导致的经济损失高达6.63亿美金。
PRRSV感染可诱发持续性感染与免疫抑制,导致育肥猪继发感染支原体、巴氏杆菌、胸膜肺炎放线杆菌等细菌性疾病。据Dee等研究发现,PRRSV及其细菌性继发感染会导致肥猪上市时间推迟14~30 d,每头猪生产成本增加7.50~15.00美金[2]。
支原体肺炎与胸膜肺炎是育肥猪常见细菌性疾病,均为条件性致病。支原体感染可增加PRRS导致的病毒性肺炎的严重性[3],而PRRSV感染也可能会增强肺炎支原体的易感性。Zurwieden等[4]证实欧洲型PRRSV可显著增加2型胸膜肺炎放线杆菌的临床危害。
本研究以PRRS暴发前后上市肥猪为研究对象,通过屠宰场肺部病变评分,评估PRRSV感染对上市猪支原体肺炎与传染性胸膜肺炎相关病变的影响,以期为PRRSV阳性群细菌性疾病控制方案制定提供依据。
1 .材料与方法
1.1 实验动物与分组 某存栏3 800头母猪的商品群,母猪群+合作育肥模式饲养。伪狂犬病、猪瘟等抗原阴性,PRRSV阳性稳定群,断奶当天免疫圆环病毒疫苗。2016年12月母猪群暴发PRRS(NADC30-like毒株),以该猪群的上市肥猪为研究对象,选取PRRS暴发前后的相同季节的上市猪共672头进行屠宰场肺脏评分,包括疑似病毒性肺炎、支原体肺炎评分与胸膜肺炎评估。每组设定3个重复,分组方案如表1。

表1 屠宰场病变评估分组与评估时间
1.2 上市肥猪生产数据收集 从育肥猪生产管理系统中导出A组、B组与C组在育肥期的主要生产参数,包括:日增重、存活率、正品率、料肉比及动保费用等。
1.3 肺脏图像摄影工具 利用Kodak/柯达SP360专业运动摄像机,对屠宰猪肺脏进行快速摄影,事后根据图像进行病变评分。
1.4 疑似病毒性肺炎 将间质性肺炎判定为疑似病毒性肺炎(见中插彩版图1)。
1.5 猪支原体肺炎评分标准 参考Madec评分方法[6]进行(见中插彩版图2)。将肺脏分为7个肺叶(2个尖叶、2个心叶、2个膈叶、1个附叶),每个肺叶根据实变比例分别评为0~4分:无实变记0分,约1/4实变记1分,1/2实变记2分,3/4实变记3分,全部实变记4分,各肺叶评分相加,总分28分。
1.6 胸膜肺炎评分标准 根据屠宰场胸膜肺炎评估系统(The Slaughterhouse Pleurisy Evaluation System,SPES)评分方法进行[7](见中插彩版图3)。根据胸膜肺炎严重程度记0~4分。无病变记0分;心叶、尖叶轻微粘连记1分;单侧膈叶局部病灶(非弥漫性)记2分;双侧膈叶局部病灶或单侧膈叶病灶大于1/3记3分;严重粘连(双侧膈叶病灶均大于1/3)记4分。对2~4分的肺脏进行加权平均,算得胸膜肺炎病变指数。
1.7 数据分析 利用t检验对数据差异显著性进行分析,P<0.05差异显著,P<0.01差异极显著。
2 结果与分析
2.1 各组上市肥猪的主要生产参数 组A正品率比组B、组C分别高3.7%,4.0%;生长速度分别快87 g/d,58 g/d;料肉比分别低0.11,0.03;动保费用分别低5元/头与8元/头,见表2。PRRSV感染后显著降低了猪群的存活率、生长速度,增加了生产成本。
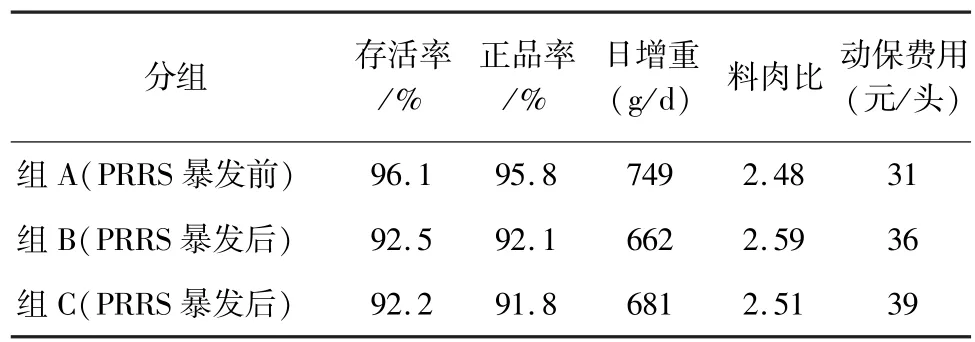
表2 各处理的主要生产参数
2.2 疑似病毒性肺炎评分 肺炎病变评分结果如表3所示。
PRRS暴发前70.7%的上市肥猪肺无病变,但PRRS暴发后,无病变肺脏比例急剧下降至21.5%与34.5%,暴发前后无病变肺比例差异极显著(P<0.01)。说明:PRRSV感染会显著影响育肥猪细菌性或病毒性肺炎的发生率。
PRRS暴发前猪群疑似病毒性肺炎比例1.2%,说明猪群整体呼吸道疾病压力低,无PRRS、PR、PCV-2等重大疾病的影响。而PRRS暴发后7个月疑似病毒性肺炎的比例上升11.3%,差异极显著(P<0.01),暴发后9个月疑似病毒性肺炎的比例上升7.1%,差异显著(P<0.05)。PRRS暴发后9个月与暴发后7个月相比,病毒性肺炎比例下降4.2%,差异不显著。PRRSV感染会导致猪群病毒性肺炎的比例显著升高,与PRRS暴发后7个月相比,PRRS暴发后9个月病毒性肺炎比例有所下降,但差异不显著。说明保育猪感染PRRSV后,其造成的病毒性肺炎的影响可持续至上市。
2.3 支原体肺炎屠宰场病变评分 与PRRS暴发前(26.8%)对比,PRRS暴发后7个月猪群支原体肺炎病变比例上升37.4%,差异极显著(P<0.01);PRRS暴发后9个月支原体肺炎病变比例上升19.1%,差异极显著(P<0.01);此外,PRRSV感染前,支原体肺炎病变评分多为1~5分,而PRRSV感染后,支原体肺炎病变评分在6分以上的比例(分别占比19.4%与29.0%)显著升高。PRRS暴发前支原体肺炎病变指数为0.72,而暴发后升高至3.44与2.68,差异极显著(P<0.01)。与PRRS暴发后7个月相比,PRRS暴发后9个月,支原体病变比例下降18.3%,差异极显著(P<0.01)。
疑似病毒性肺炎比例与支原体病变比例呈正相关(y=3.2423x+0.2185,R2=0.9824),PRRSV感染能导致上市肥猪支原体肺炎病变比例上升37.4%,随着PRRSV感染比例的下降,支原体肺炎病变比例也随之下降。说明:PRRSV感染可增加肺炎支原体的易感性,严重影响支原体肺炎疫苗的保护效果。

表3 屠宰场病毒性肺炎与支原体肺炎病变评分结果
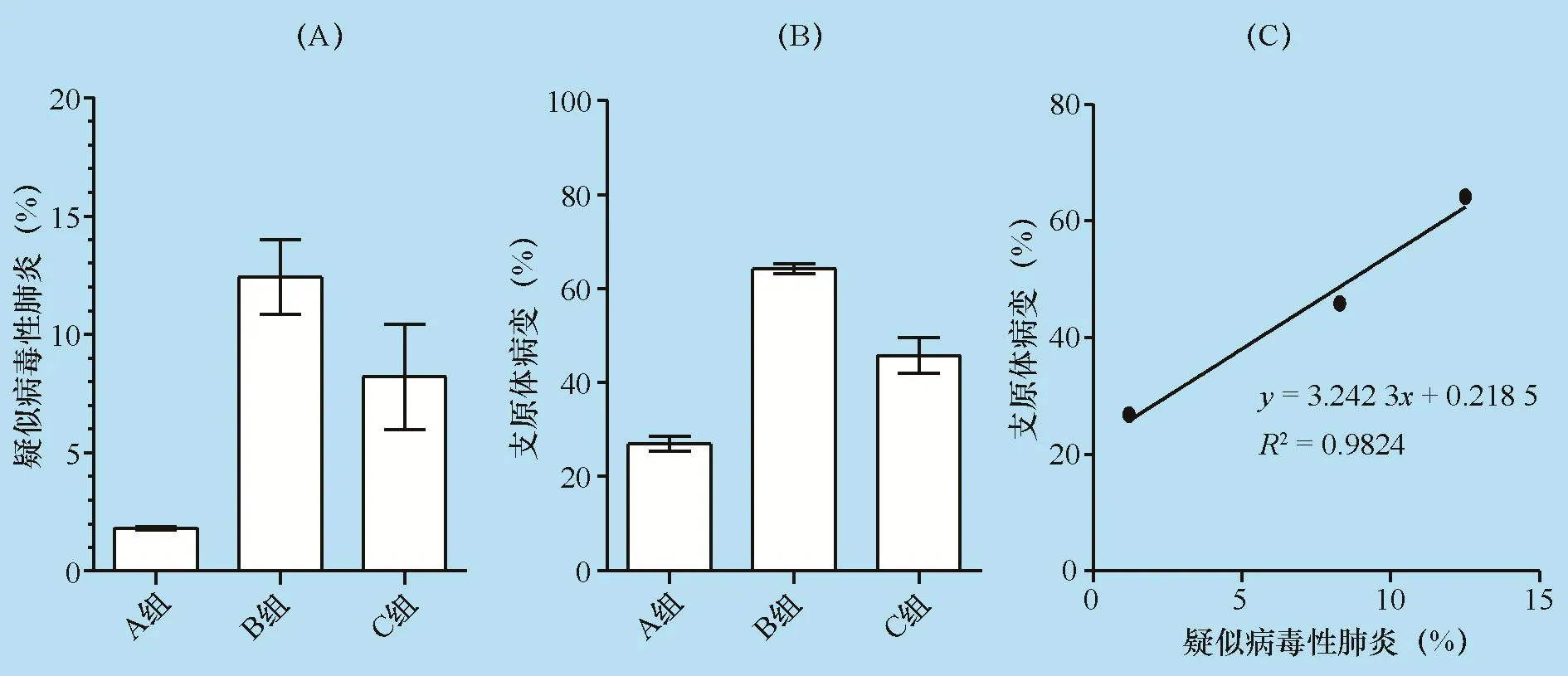
图4 屠宰场肺脏病毒性肺炎与支原体肺炎病变
2.4 胸膜肺炎屠宰场病变评分 胸膜肺炎病变评分结果如表4所示。
与PRRS暴发前(1.2%)相比,PRRS暴发后7个月,猪群胸膜肺炎病变比例上升12.1%,差异极显著(P<0.01);胸膜肺炎病变指数也从0.024上升至0.251,差异极显著(P<0.01)。PRRS暴发后9个月,猪群胸膜肺炎病变比例上升1.4%,差异不显著(P>0.05);PRRS暴发后9个月比暴发后7个月的胸膜肺炎病变比例下降10.66%,差异极显著(P<0.01)。感染后9个月的上市肥猪胸膜肺炎病变指数为0,此时胸膜肺炎感染压力已明显降低。以上结果说明,PRRSV促进传染性胸膜肺炎的共感染,增加胸膜肺炎放线菌感染的易感性及胸膜肺炎病变的严重性。
疑似病毒性肺炎发生率与胸膜肺炎病变发生率呈正相关(y=0.9765x-0.0147,R2=0.7148)。PRRSV感染能导致猪群胸膜肺炎病变发生率上升12.06%,随着PRRSV感染压力下降,胸膜肺炎病变发生率也显著下降,但两者相关性不强,说明PRRSV感染可能不是导致诱发胸膜肺炎病变发生率升高的唯一因素,考虑到组B评估时间为7月份,而组C评估时间为9月份,推测环境性因素(如:通风、温度控制)可能是导致胸膜肺炎病变发生率上升或下降的另一重要诱因。
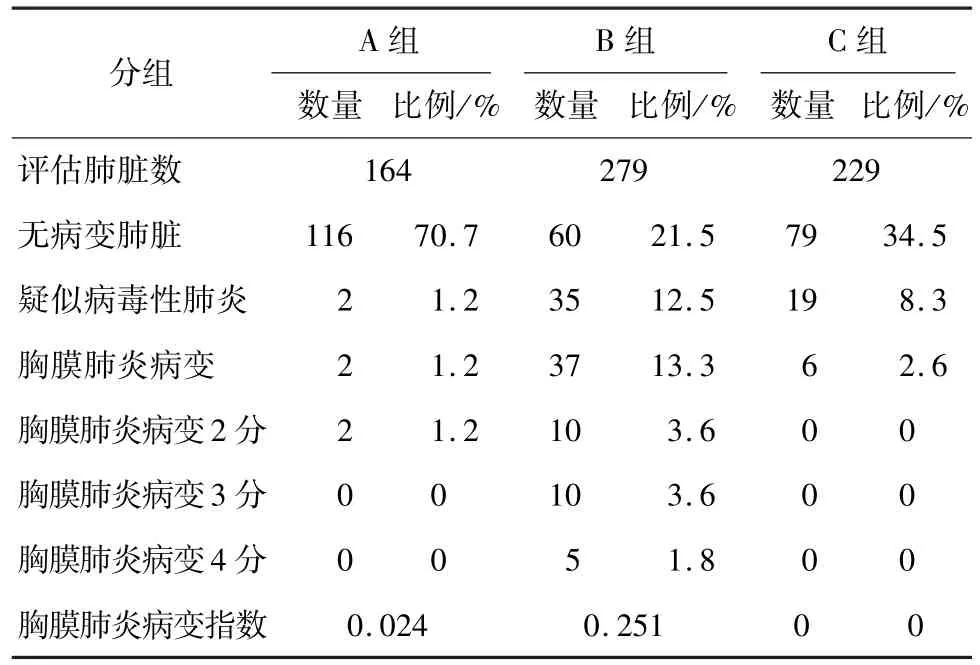
表4 屠宰场病毒性肺炎与胸膜肺炎病变评分结果
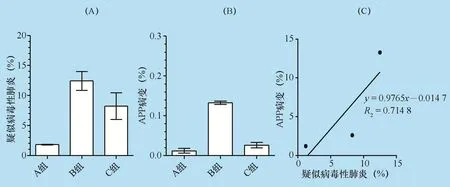
图5 屠宰场病毒性肺炎与胸膜肺炎病变
3 讨论
猪繁殖与呼吸综合征可诱发断奶后仔猪发生间质性肺炎,是猪呼吸道综合征(PRDC)的重要原发性病原之一。在本研究中,感染PRRSV上市肥猪的间质性肺炎或疑似病毒性肺炎的检出率显著升高,说明:PRRSV感染所造成的肺脏损伤会持续性存在。
支原体肺炎是由肺炎支原体感染导致的一种保育育肥猪慢性消耗性的呼吸道疾病,可导致肺尖叶、心叶、膈叶等部位发生典型的实变。虽然已应用疫苗免疫、策略性给药及环境控制等综合性防控措施,但疑似支原体肺炎病变依然是上市猪主要的肺脏病变[7]。
研究表明,肺炎支原体与PRRSV感染之间可相互作用,即:肺炎支原体感染可加重PRRSV感染所造成的肺炎的严重性,而PRRSV感染又可引致支原体肺炎的病变显著增加。在本研究中,感染PRRSV后,上市肥猪的支原体肺炎疑似病变从26.8%上升至64.2%,通过统计学函数分析,PRRSV导致的病毒性肺炎与支原体肺炎病变检出率之间呈正相关性,说明在PRRSV感染后支原体临床危害加重,需要优先进行支原体防控。
传染性胸膜肺炎主要以出血性坏死性肺炎与纤维素性胸膜炎为特征性病变,主要影响生长育肥猪,可表现为最急性型、急性型、慢性型等。慢性胸膜肺炎虽不表现严重临床症状,但严重影响猪群生长速度与料肉比等。通常认为传染性胸膜肺炎属于条件性致病性疾病,与环境控制及其他免疫抑制性诱因有关,本研究从临床角度证实:PRRSV感染后,传染性胸膜肺炎(APP)更加易感,胸膜肺炎发病率更高。
屠宰场病变评估是猪群健康监控的方法之一,该方法可对育肥阶段亚临床疾病进行诊断,并评估其流行率与严重性,以帮助猪场做好健康管理决策。目前该方法主要用于肺脏、鼻腔等呼吸道系统疾病的病变评估[8-9]。笔者(2012)曾对某公司上市肥猪做屠宰场病变评估,支原体肺炎病变与传染性胸膜肺炎比例分别为66.7%与10%[8],而法国学者Fablet等对全国35个屠宰场的185个批次的上市肥猪进行了屠宰场肺脏病变评估,支原体肺炎与胸膜肺炎的病变比例分别是50.8%与13.6%[10]。
屠宰场病变评估方法具有一定的局限性。因肺炎病变具有自愈性,当肥猪上市时部分早期肺炎病变已经自愈[11]。肺部病变修复通常需要8~10周时间[12],如,若肺炎发生在保育期或生长前期(如:链球菌、副猪嗜血杆菌等),可能会低估肺炎的发生率及所造成的损失。肺炎支原体与巴氏杆菌主要发生于生长、育肥猪,传染性胸膜肺炎多出现于育肥猪。故屠宰场肺脏病变评估对这些病的发生率及严重性评估具有参考价值。
本研究通过屠宰场病变评估证实了PRRSV感染所造成间质性肺炎病变的持续性及PRRSV作为PRDC原发性病原对支原体肺炎与胸膜肺炎发生具有明显的诱发性。在PRRS暴发后,做好生长育肥猪的支原体肺炎与胸膜肺炎控制对提高经济效益至关重要。