磷脂酰肌醇3激酶抑制剂LY294002对李斯特菌感染的影响
2018-08-24张俊波印双红
张俊波,印双红,易 萌,张 红
(1.铜仁学院农林工程与规划学院 铜仁市文化科技产业创新研究中心,贵州 铜仁 554300;2.铜仁学院大健康学院,贵州 铜仁 554300;3.铜仁学院大数据学院,贵州 铜仁 554300)
单核细胞增生李斯特菌(L.monocytogenes)是一种人兽共患的革兰阳性致病菌,同时也是四大食源性病原体之一。可在免疫功能低下的个体中,如老年人,孕妇,新生儿等,引起脑膜炎、败血症等严重的感染性疾病,免疫力正常人群,在食入一定量单增李斯特菌污染的食品后,也可能会出现发热性胃肠炎症状[1]。单核细胞增生李斯特菌感染过程和致病机理成为研究的重点之一[2-3],L.monocytogenes是兼性细胞内生存的病原菌,既能感染吞噬细胞也能感染非吞噬细胞,并在细胞中生长、增殖进而在细胞间进行传播[4]。其感染过程可以分为四个阶段:入侵、逃逸吞噬泡、增殖以及在细胞与细胞之间传播[5-6]。
PI3K/Akt信号转导通路是重要的细胞生存通路之一,在促进细胞运动、侵袭和转移和抑制细胞凋亡方面起核心作用[7]。已有研究表明,PI3K/Akt信号通路与一些胞内病毒的繁殖密切相关,某些病毒可通过激活PI3K/Akt信号通路抑制宿主细胞的早期凋亡、促进细胞自噬和抑制细胞免疫以延长在胞内的复制时间[8-10]。PI3K/Akt信号通路与许多疾病密切相关,然而与李斯特菌病关系如何,目前尚不清楚,本研究着重探讨PI3K/Akt信号通路抑制剂LY294002对李斯特菌存活的影响,这为揭示L.monocytogenes致病机制奠定基础。
1 材料与方法
1.1 菌株和细胞 单核细胞增生李斯特菌L.monocytogenes和小鼠脑微血管内皮细胞为实验室保存。
1.2 试剂 胎牛血清,购自海克隆公司;胎牛血清、BHI培养基,购自上海信裕生物科技有限公司;Triton X-100细胞裂解液、MTT试剂盒和DMSO,购自北京索莱宝科技有限公司;LDH检测试剂盒,购自Roche公司;LY294002抑制剂,购自碧云天生物技术有限公司;小鼠IFN-γ ELISA试剂盒,均购自上海依科赛生物制品有限公司。
1.3 MTT试验 将不同浓度的抑制剂LY294002(0 μmol/L、 5 μmol/L、 10 μmol/L、 20 μmol/L、40 μmol/L和 60 μmol/L)与细胞共同孵育 24 h,收集细胞,参照MTT试剂盒说明书进行操作。
1.4 LY294002作用下L.monocytogenes生长曲线的测定 配制体积为5 mL分别含LY294002浓度为0 μmol/L、5 μmol/L、10 μmol/L 和20 μmol/L 的 BHI液体培养基,同时于培养基中加入100 μL处于对数生长期的L.monocytogenes。 分别于 0 h、6 h、12 h、18 h、24 h、30 h、36 h、42 h 和48 h 取100 μL 菌液于96孔板中,酶标仪600 nm波长处测量吸光度值。
1.5 LDH实验 将细菌感染细胞,感染比例为细菌∶细胞=50∶1,然后将细胞分为5组,包括4组加了L.monocytogenes同 时 分 别 加 了 0 μmol/L、5 μmol/L、10 μmol/L、20 μmol/L 的 LY294002,以及单独LY294002(浓度为20 μmol/L)组,感染24 h。 测值,1 000 r/min离心10 min,然后吸取100 μL上清,每孔再加入100 μL的LDH工作液,避光静置30 min后450 nm酶标仪测值。
1.6 生存曲线分析 将小鼠随机分为LY294002组和PBS对照组2组,每组10只,每只小鼠腹腔注射l×l06CFU的L.monocytogenes悬液,并分别在感染后6 h、24 h、48 h给药,实验组小鼠腹腔注射20 mg/kg·bw的LY294002,对照组小鼠腹腔注射等量的PBS。每天记录小鼠的生存情况,共10 d。
1.7 体内载菌量测定 取10只小鼠,将小鼠随机分LY294002组和对照PBS组,每组5只。每只小鼠腹腔注射l×l05CFU的L.monocytogenes,分别于给菌前4 h和给菌后24 h和48 h腹腔注射相应剂量LY294002,给LY294002后3 d,无菌条件下摘取脑组织和脾脏,用组织匀浆器充分碾碎脾脏后加入1 mL的PBS制成匀浆,取组织匀浆液进行梯度稀释,涂布于BHI固体培养基中,放入37℃恒温培养箱中过夜,计数平板菌落数,计算出小鼠脑组织、脾脏中的活菌数。
1.8L.monocytogenes侵染小鼠脑微血管内皮细胞 将细胞传代于六孔板中培养,当单层细胞生长至80%覆盖度时,抑制剂LY294002(20 μmol/L)与细胞作用1 h,以50∶1(细菌个数∶细胞个数)比例感染细胞,并将其置于37℃、5%CO2培养箱中继续培养2 h,加入庆大霉素100 μg/mL孵育30 min以杀灭胞外细菌,用PBS洗涤3次。然后在细胞培养液中添加庆大霉素(10 μg/mL)和 LY294002(20 μmol/L),置于37 ℃、5%CO2培养箱中继续培养4 h、8 h、12 h和24 h,用PBS洗涤3次,利用0.5%Triton X-100裂解细胞10 min,无菌蒸溜水终止裂解。将细胞裂解液梯度稀释并涂板,37℃培养24 h后计数,计算胞内细菌数量。
1.9 ELISA检测细胞因子 取10只小鼠,将小鼠随机分LY294002组和对照PBS组,每组5只。每只小鼠腹腔注射l×l05CFU的L.monocytogenes,分别于给菌前4 h和给菌后24 h和48 h腹腔注射相应剂量 LY294002,给予 LY294002 后1 d、2 d、3 d 断尾对小鼠进行采血,分离血清,对血清中的IFN-γ进行ELISA检测,操作步骤见试剂盒说明书。
1.10 统计学分析使用SPSS17.0软件数据统计对试验数据进行统计学分析。
2 结果与分析
2.1 LY294002对小鼠脑微血管内皮细胞活性的影响 不同浓度抑制剂LY294002与细胞作用24 h后,收集细胞,利用MTT方法检测细胞活性。结果表明,与对照LY294002(0 μmol/L)组细胞活性相比,抑制剂 LY294002 浓度为 5 μmol/L、10 μmol/L和20 μmol/L不影响细胞活性,当LY294002浓度为40 μmol/L和 60 μmol/L时细胞活性显著降低(图1)(P<0.05)。
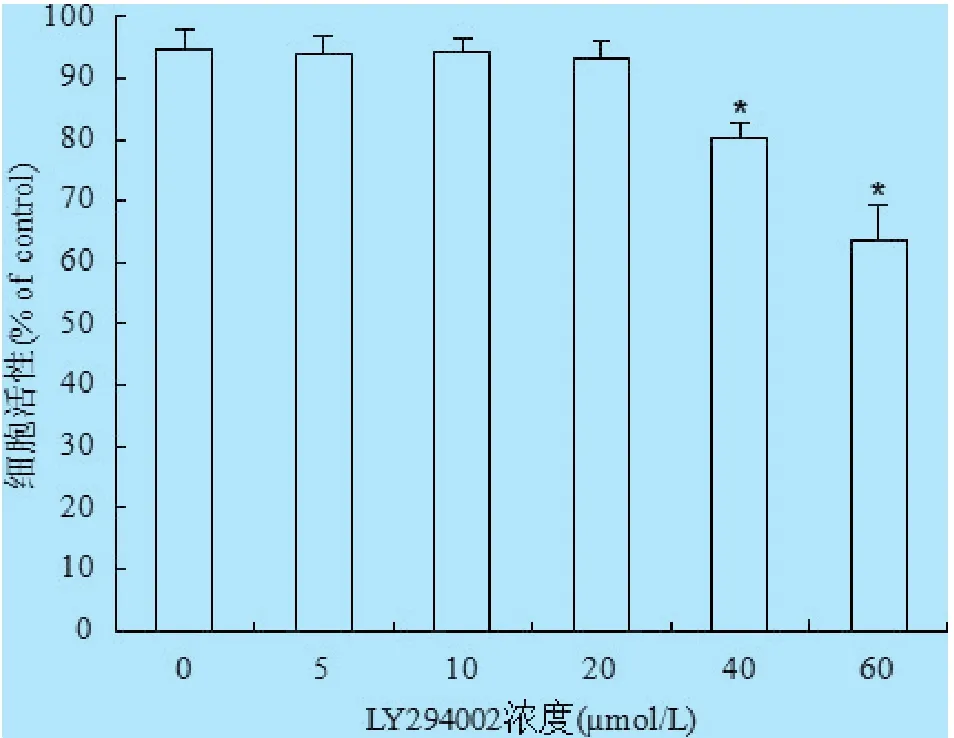
图1 LY294002对细胞活性的影响
2.2 LY294002对体外L.monocytogenes生长的影响将LY294002添加至L.monocytogenes的液体培养基中,在不同时间点 0 h、3 h、6 h、12 h、18 h、24 h 和30 h检测L.monocytogenes的生长情况。结果发现,在不同浓度的 LY294002作用下,L.monocytogenes的生长曲线无差异(图 2)。因此,各浓度的LY294002对L.monocytogenes体外生长均没有抑制作用。因此LY294002阻断剂对L.monocytogenes没有体外的抑制效果。
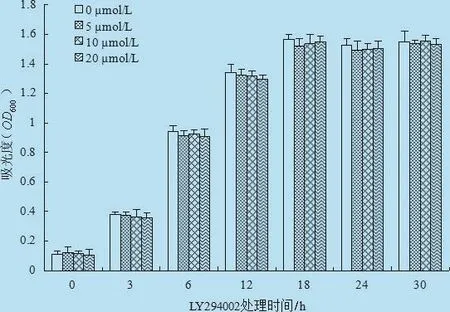
图2 LY294002对体外L.monocytogenes生长的影响
2.3 LY294002对L.monocytogenes介导的细胞毒性作用的影响 不同浓度LY294002与细胞孵育1 h,然后,将L.monocytogenes感染细胞24 h,收集上清液,检测LDH水平变化。结果显示,L.monocytogenes具有很强的细胞毒性作用。L.monocytogenes+LY294002组细胞释放的LDH水平显著低于L.monocytogenes组细胞(P<0.05)(图3),且具有浓度依赖性,当药物浓度达到20 μmol/L时,细胞的死亡情况从之前的100%显著的降低到了65%以下,而仅仅利用LY294002(20 μmol/L)处理组细胞LDH的释放量非常少(图3)。结果表明,LY294002显著降低了L.monocytogenes介导的细胞毒性作用,而LY294002本身对细胞不具有毒性作用。
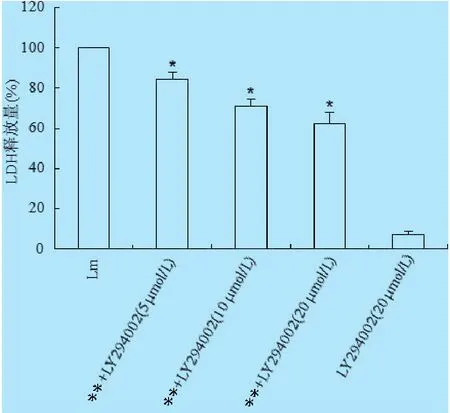
图3 LY294002对L.monocytogenes介导的细胞毒性的影响
2.4 LY294002对L.monocytogenes胞内存活的影响 不同浓度LY294002与细胞孵育1 h,然后,将L.monocytogenes感染细胞24 h,裂解细胞,通过菌斑计数发现,胞内L.monocytogenes数量随着LY294002浓度的增加而减少,L.monocytogenes+LY294002组细菌数量显著低于对照组(P<0.05)(图4);同一浓度LY294002(20 μmol/L)与 细 胞 孵 育 1 h,将L.monocytogenes感染细胞4 h、8 h、12 h 和24 h,检测胞内菌数。结果显示,在所观察的时间点,LY294002处理细胞中L.monocytogenes的数量显著低于对照组(P<0.05)(图4)。结果表明,LY294002抑制胞内菌数与其浓度和感染时间相关。
2.5 小鼠存活曲线分析 小鼠腹腔注射l×l06CFU的L.monocytogenes悬液,并分别在感染后6 h、24 h、48 h给药,试验组小鼠腹腔注射20 mg/kg.bw的LY294002,对照组小鼠腹腔注射等量的PBS。结果显示,在感染L.monocytogenes的第10天,抑制剂LY294002处理组的小鼠存活率为60%,而对照组PBS处理组小鼠存活率为40%(图5)。结果表明,抑制剂LY294002处理后显著提高被L.monocytogenes感染的小鼠存活率。
2.6 LY294002对小鼠体内L.monocytogenes感染的影响 小鼠感染L.monocytogenes后,腹腔注射给予LY294002,感染3 d后解剖小鼠,取其脑和脾进行细菌计数。结果发现,LY294002处理组小鼠的脾脏和脑组织中细菌载量显著低于PBS组(P<0.05)(图6)。结果表明,LY294002能够有效地抑制小鼠体内L.monocytogenes的繁殖,从而可减轻L.monocytogenes导致的脑膜炎症状。

图4 LY294002对胞内L.monocytogenes繁殖的影响

图5 LY294002对L.monocytogenes介导的小鼠体存活率的影响

图6 LY294002对小鼠脑和肝脏载菌量的影响
2.7 抑制剂LY294002对L.monocytogenes介导的细胞因子水平的影响 小鼠感染L.monocytogenes后,腹腔注射给予LY294002,感染1 d、2 d、3 d后利用断尾方式采取小鼠的血液,离心获得血清,利用ELISA检测血清中的IFN-γ水平。结果显示,LY294002处理组小鼠诱导产生的IFN-γ水平显著高于对照组(P<0.05)。结果表明,LY294002诱导L.monocytogenes介导的IFN-γ水平,从而提高抵抗L.monocytogenes感染的细胞免疫(图7)。
3 讨论

图7 LY294002对小鼠血清中L.monocytogenes介导的IFN-γ分泌的影响
PI3K/Akt通路参与许多疾病有关。LY294002是一种特异性抑制剂,它可特异地抑制PI3K酶的活性。LY294002可抑制PI3K-依赖的Akt磷酸化和激酶活性,它通过与ATP竞争PI3K催化结构域的结合位点发挥作用,从而抑制其下游信号分子Akt的磷酸化,LY294002已被广泛应用与信号通路的研究中[11]。本研究为其他信号通路与L.monocytogenes的研究提供依据。IFN-γ是生物细胞受诱导后产生的一类多功能、具有抗病原体活性的糖蛋白,可活化巨噬细胞,增强其杀伤已被吞噬的病原体的能力[12]。本研究表明,抑制剂LY294002可以提高胞内L.monocytogenes介导的IFN-γ的分泌,有助于细胞抵抗L.monocytogenes的感染,因此,揭示了抑制剂LY294002调控L.monocytogenes存活的分子机制。
当病原体入侵细胞内后,还能够利用胞浆内的NOD样受体等模式识别受体与PAMP或DAMP相互作用,启动炎症复合体的活化与装配,继而活化Caspase-1,诱导IL-1β、IL-18等促炎细胞因子的成熟分泌及细胞凋亡,调节免疫应答和炎症反应,调控获得性免疫反应[13]相关文献报道,在单核细胞增生李斯特菌感染过程中NLRP3、AIM2以及IPAF炎症复合体可被激活,而炎症复合体是活化Caspase-1所必需的分子平台[14]。在宿主体内,单核细胞增生李斯特菌感染可诱导专职和非专职吞噬细胞发生凋亡,感染早期可使胸腺细胞、肝细胞、脾细胞和淋巴细胞发生凋亡,单核细胞增生李斯特菌在体内外均可感染肝细胞,引起肝细胞的凋亡和趋化因子的释放,嗜中性粒细胞进入肝可清除凋亡的肝细胞及侵入的单核细胞增生李斯特菌[15]。可见细胞凋亡在机体抵御单核细胞增生李斯特菌的早期特异性免疫防御机制中起关键性的作用。通常LDH存在于细胞内,当细胞膜受到来自胞内或胞外各种有害因素刺激时,胞内的LDH可经通透性增大的细胞膜释放至胞外。在本研究中,LY294002可降低L.monocytogenes在宿主体内外的存活和L.monocytogenes介导的细胞损伤。该研究为揭示L.monocytogenes导致脑膜炎致病机制和抗L.monocytogenes药物靶点筛选提供科学依据。
