体外过表达Foxp1对多巴胺神经元分化的影响*
2018-08-23赵海霞吴科晓李云竹苏炳银李淑蓉
左 璇,赵海霞,吴科晓,李云竹,苏炳银,李淑蓉Δ
1.成都医学院 病理学与病理生理学教研室(成都 610500);2. 发育与再生四川省重点实验室(成都 610500);3. 成都医学院 人体解剖与组织胚胎学教研室(成都 610500)
中脑多巴胺神经元(midbrain dopaminergic neuron,mDAn)是哺乳动物中枢神经系统中产生多巴胺类神经递质的主要神经元,参与运动调节、情绪、奖赏、抑郁等生理过程。mDAn的功能异常与一系列神经精神疾病如帕金森病、精神分裂症、成瘾症、抑郁症的发生密切相关。转录因子在mDAn的发育过程中扮演重要角色,有关mDAn发育的转录调控网络机制历来是神经科学领域的研究热点[1]。
转录因子Foxp1(forkhead box protein P1,Foxp1)是Foxp家族的一员,Foxp1 能够与多种基因的启动子及增强子相结合,形成转录复合体发挥转录调控作用以调节多种基因的时空表达[2]。研究[3-6]结果显示,Foxp1基因缺陷可造成明显的认知障碍、智力低下、自闭症谱系症候群以及语言功能障碍。此外,Foxp1在神经系统的表达范围十分广泛,在发育中的前脑、脊索、纹状体、丘脑以及皮层中均有表达,提示Foxp1参与神经系统的发育过程。有关Foxp1在mDAn发育中作用的研究鲜有报道。本课题组前期观察发现Foxp1在胚胎发育早期中脑腹侧表达,提示Foxp1可能在mDAn的早期发育过程中发挥作用。为进一步探究Foxp1对多巴胺神经元分化的影响,本研究首先构建了Foxp1过表达载体,应用脂质体转染法转染至MN9D细胞,然后通过RT-qPCR技术检测多巴胺神经元分化相关基因Foxa2、Ngn2、Pitx3、Th的表达水平,初步探究转录因子Foxp1在mDAn分化中的作用,为进一步完善多巴胺神经元分化的转录调控网络机制提供一定的理论支持,同时为Foxp1突变相关神经精神疾病的发生提供理论依据。
1 材料与方法
1.1 实验动物及细胞
实验动物:野生型C57/BL6小鼠,约4周龄,体重约20 g,购自成都达硕实验动物公司。配种野生型雄性及雌性性成熟小鼠,检栓并计算孕龄,获取E10.5、E15.5天胎鼠。实验用细胞:MN9D细胞(ATCC来源)。
1.2 实验试剂及设备
实验所用引物序列均由美国Invitrogen公司合成。试剂:DMEM/F12(1∶1)培养基、1% Penicillin-Streptomycin、Lipofectamine 2000、Trizol均购自美国Invitrogen公司、胎牛血清购自德国PAN公司;兔源抗小鼠Foxp1 抗体、兔源抗小鼠Th抗体购自美国Millipore公司、Alexa Fluor®488 goat anti-rabbit IgG购自美国Invitrogen公司、DAPI染色液购自上海碧云天生物技术有限公司。高保真Taq酶购自日本Takara公司、EcoRI-HF、BamHI-HF以及T4连接酶购自美国NEB公司。反转录试剂盒Transcriptor First Strand cDNA Synthesis Kit以及荧光定量PCR检测试剂盒Fast Start Universal SYBR Green Master购自美国Roche公司。设备:CO2细胞培养箱购自美国Thermo公司、电泳及凝胶成像系统、PCR仪及CFX96TmReal-Time System购自美国Bio-Rad公司、正置荧光显微镜、激光共聚焦显微镜购自日本Olympus公司、冰冻切片机购自美国Thermo公司。
1.3 免疫荧光染色
取E10.5、E15.5天胚胎脑组织样品,4% PFA固定过夜,30% 蔗糖脱水沉淀,冷冻包埋,收集中脑连续冰冻切片,片厚20 μm。选取腹侧中脑所在部位进行免疫荧光染色。组织切片烘干,组织复水,滴加透化性封闭液至样品表面,室温封闭1 h,滴加一抗兔源抗小鼠Foxp1 抗体、兔源抗小鼠Th抗体(1∶200稀释)至样品表面4 ℃孵育过夜,洗涤,滴加二抗Alexa Fluor®488 goat anti-rabbit IgG(1∶400稀释)至样品表面室温孵育2 h,洗涤,滴加DAPI染色液,中性树胶封片,置于正置荧光显微镜下拍照观察。
1.4 Foxp1过表达载体的构建
设计含有BamHⅠ、EcoRⅠ酶切位点的Foxp1引物,体外PCR扩增获得目的基因,将目的基因及载体pIRES2-EGFP分别应用BamHⅠ、EcoRⅠ限制性内切酶进行双酶切,所得目的基因及载体酶切产物应用T4连接酶进行连接,连接成功后将重组质粒转化至大肠杆菌感受态细胞DH-5α 中,铺板培养14 ~16 h后,挑选能够在Kana抗性培养板生长的菌落,摇菌扩大培养并提取质粒送检测序。
实验涉及引物序列:Foxp1-EcoRI上游:5'-CCGGAATTCGCCACCATGATGCAAGAATCTGGGTC-3';Foxp1-BamHI下游:5'-CGCGGATCCTCACTCCATGTCCTCATTTACTG-3'。
1.5 细胞培养及转染技术
MN9D细胞培养于含有1%Penicillin-Streptomycin(双抗)、10%FBS(胎牛血清)的DMEM/F12培养基中,培养条件为37 ℃,5% CO2培养箱。细胞呈现贴壁生长,当细胞密度达到90%以上时进行传代操作。操作时倒掉原培养基,以灭菌1×PBS适量冲洗培养瓶,加入0.25%胰酶1 mL,横直培养瓶使其充分接触细胞,消化约3 min左右可见细胞脱落,收集细胞悬液于15 mL离心管内,低速离心机离心1 000 r/min,离心5 min,可见细胞沉淀于管底,倒去上层液体,以1 mL新鲜培养基重悬细胞,充分混匀,动作应尽量轻柔。以1∶3吸取300 μL细胞悬液,加入含有新鲜培养基5 mL的培养瓶内。轻轻晃动瓶体,使细胞均匀分布,置于CO2培养箱内继续培养。细胞需传代2~3次后方可进行后续实验操作。
细胞转染操作前1 d,将MN9D细胞接种于24孔培养板中,接种密度以细胞密度达70%~80%为宜。第2天,见细胞贴壁生长良好,密度为80%左右。准备转染复合体转染DNA 50 ng/孔,分别配置A、B液。A液:DNA 50 ng/孔,DMEM/F12补足至25 μL,混合均匀。B液:Lipo2000 2 μL/孔,DMEM/F12补足至25 μL,混合均匀。将B液加入A液中混匀,室温静置5 min。按照50 μL/孔标准,将混合液加入孔板内,注意加液时应逐滴分散加入。转染后细胞置于CO2培养箱内继续培养。
1.6 RT-qPCR技术
MN9D细胞转染Foxp1过表达载体后,应用含有丁酸钠的诱导培养基,诱导分化3 d。Trizol法收集总RNA。所得RNA应用反转录试剂盒反转录为cDNA,具体方法步骤参照试剂盒说明。以cDNA为模版应用实时荧光定量PCR检测目的基因表达情况。
引物序列:GAPDH上游:5'-GAAACCTGCCAAGTATGATGACA-3',下游:5'-GGTCCTCAGTGTAGCCCAAGA-3';Foxp1上游:5'-TCTCGTCCTCGGCACCTT-3',下游:5'-GTCACAAACCGCCTCACA-3';Foxa2上游:5'-GCTGCAGACACTTCCTACTACCA-3',下游:5'-CCAAAGTCTCCACTCAGCCTC-3';Ngn2上游:5'-CATCTGGAGCCGCGTAGG-3',下游:5'-GGACATCGGGGTCAGGGT-3';Pitx3上游:5'-TCCAGAGGAATCGCTACCC-3',下游:5'-GCCGGTTCTTGAACCACA-3';Th上游:5'-TCCTCAGTTCTGTGCGTCG-3',下游:5'-CAGGTCCAGGTCAGGGTCA-3'。
1.7 统计学方法

2 结果
2.1 Foxp1在胚胎发育早期E10.5天小鼠中脑腹侧的表达
通过免疫荧光染色,于连续切片中分别标记Foxp1、Th,观察二者在胚胎早期E10.5天小鼠中脑的表达情况,结果发现,Th在胚胎早期E10.5天便已经开始表达,其特异性地表达于中脑腹侧。Foxp1同样表达于中脑腹侧,二者在该时期的表达存在显著重叠(图1)。
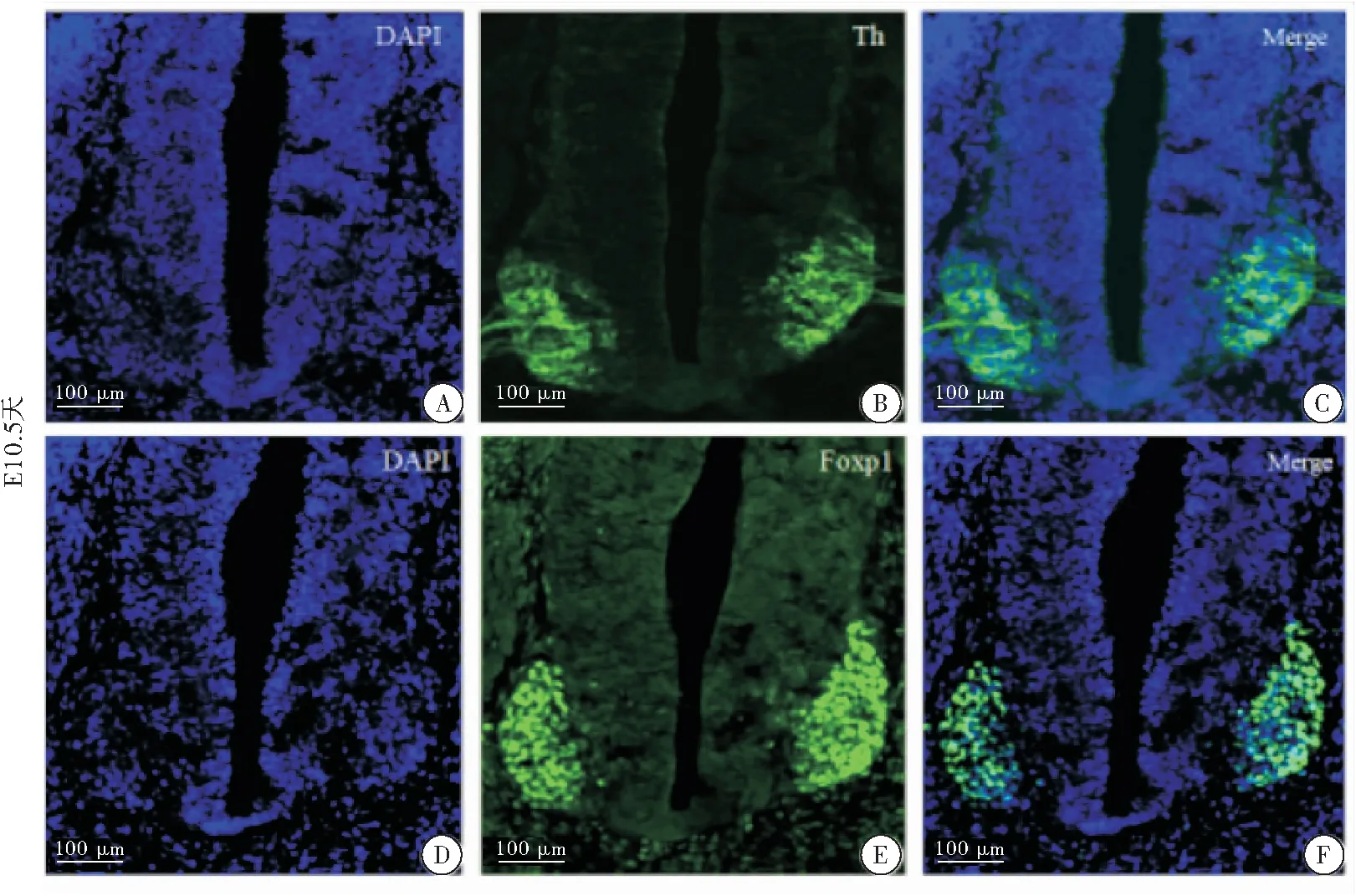
图1 Foxp1在胚胎发育早期E10.5天小鼠中脑的表达注:A-C:E10.5天中脑Th的表达;D-F:E10.5天中脑Foxp1的表达;DAPI标记细胞核,呈现蓝色;Th标记多巴胺神经元,呈现绿色
2.2 Foxp1在胚胎发育晚期E15.5天小鼠中脑的表达
通过免疫荧光染色,于连续切片中分别标记Foxp1、Th,观察二者在胚胎发育晚期E15.5天小鼠中脑的表达,结果发现,较E10.5天而言,E15.5天时可观察到mDAn发生显著迁移,形成中脑腹侧被盖VTA及黑质致密部SNc。该时期,Foxp1表达于Th阳性细胞下方,二者间无重叠表达(图2)。

图2 Foxp1在胚胎发育晚期E15.5天小鼠中脑的表达注:A-C:E15.5天中脑Th的表达;D-F:E15.5天中脑Foxp1的表达;DAPI标记细胞核,呈现蓝色;Th标记多巴胺神经元,呈现绿色
2.3 Foxp1过表达载体的构建
通过对目的基因PCR扩增片段以及Foxp1过表达载体酶切产物进行琼脂糖凝胶电泳检测,结果发现PCR扩增所得产物大小约2.5 kb,与Foxp1目的基因片段长度一致;Foxp1过表达载体酶切后电泳条带显示过表达载体成功酶切为目的片段及载体片段两部分(图3)。

图3 构建EGFP、EGFP-Foxp1重组质粒
2.4 多巴胺神经元MN9D细胞中过表达Foxp1
通过实时荧光定量PCR技术检测Foxp1在MN9D细胞中的过表达水平,结果发现,转染组较对照组Foxp1表达水平明显升高,表明Foxp1在MN9D细胞中过表达成功(图4)。
2.5 过表达Foxp1对多巴胺神经元分化相关基因的影响
通过实时荧光定量PCR技术观察Foxp1过表达后,MN9D细胞中多巴胺神经元分化相关基因Foxa2、Ngn2、Pitx3、Th的表达水平。结果发现,过表达Foxp1后,Foxa2、Ngn2表达水平明显升高而Pitx3、Th表达未见明显变化(图5)。

图5 过表达Foxp1对多巴胺神经元分化相关基因的影响注:n=3,*P<0.05
3 讨论
mDAn作为中枢神经系统内产生多巴胺神经递质的主要神经元,其功能异常与一系列神经精神疾病的发生密切相关,尤其是黑质致密部多巴胺神经元的退行性变可引起帕金森病。有关mDAn发育发生机制的各项研究[7]结果表明,多巴胺神经元的发育分化过程受到多种转录因子的调控。
小鼠中脑黑质及腹侧被盖的多巴胺神经元均起源于腹侧底板区,其发育主要经历3个阶段:前体细胞的区域化诱导;前体细胞向多巴胺神经元的特化;成熟多巴胺神经元表型的获得以及多巴胺神经元的终末分化[8]。前体细胞区域化诱导阶段受到转录因子Foxα1/2、En1/2、Lmx1a/b、Ngn2调控,研究[9]结果显示,Foxa2杂合型小鼠可出现散发性的多巴胺神经元发育延缓以及运动功能异常,而Ngn2突变小鼠在胚胎发育E14.5及E17.5天即可造成约86%及66%多巴胺神经元的发育缺陷[10]。伴随着胚胎的不断发育,前体细胞逐渐特化为多巴胺神经元并开始表达转录因子Nurr1、Pitx3。值得注意的是,Pitx3仅特异性的表达于mDAn,并且Pitx3敲除可造成中脑黑质多巴胺神经元数目减少[11]。在表达Nurr1、Pitx3等转录因子后,多巴胺神经元的表型开始出现并合成多巴胺。Th、Vmat的表达与成熟多巴胺神经元表型的获得密切相关。据此可见,多巴胺神经元的转录调控网络在其正常发育过程中至关重要。
本课题组前期实验中运用免疫荧光染色观察发现Th早在胚胎发育早期E10.5天便开始表达,在该时期,Foxp1表达于Th阳性细胞中。胚胎发育至E15.5天,较发育早期而言多巴胺神经元发生显著的细胞迁移,分别形成中脑腹侧被盖VTA区以及黑质致密部SNc区。在该时期,Foxp1表达于多巴胺神经元下方的部分区域内,二者之间无重叠表达。这一结果表明Foxp1参与调节mDAn发育的时间窗较短,仅在胚胎早期发挥作用,可能影响胚胎早期多巴胺神经元的特化或分化进程,而对胚胎晚期多巴胺神经元的表型获得及维持影响较小。
MN9D细胞是由小鼠胚胎腹侧中脑细胞与成神经细胞瘤杂交而获得。研究[12]显示,MN9D细胞作为多巴胺神经前体细胞系,经丁酸钠诱导分化后,可具备在体内多巴胺神经元的某些特性,如Th表达阳性、能够吸收、合成及释放DA等。因此被广泛应用于多巴胺神经元分化的相关体外实验研究。本研究通过在MN9D细胞中过表达Foxp1,探究过表达Foxp1对多巴胺神经元分化相关基因表达的影响。结果发现Foxp1过表达能够显著促进Foxa2以及Ngn2的表达,而对Pitx3、Th的表达无明显影响。Foxα2、Ngn2被认为是分化早期多巴胺神经前体细胞的标记因子,而Pitx3、Th则是分化晚期及成熟多巴胺神经元的标记因子[13-16]。这表明,Foxp1主要参与调节多巴胺神经元的早期分化过程,而对分化晚期多巴胺神经元的影响较小。但这一结论仍有待于体内实验中进一步加以验证。
综上所述,有关Foxp1在mDAn早期发育中的具体功能以及Foxp1作为转录因子通过与何种靶基因结合以调节mDAn发育仍有待进一步的研究。相关研究在完善mDAn发育的分子网络调控机制方面具有重要意义。
