热重法分析不同纳米CeO2粒径和添加量对燃油热动力学的影响
2018-08-22梅德清王子胥陈志宇
梅德清,孙 潮,王子胥,陈志宇,陈 晨,陶 俊
(1. 江苏大学汽车与交通工程学院,镇江 212013;2. 江苏苏扬包装股份有限公司,扬州 211400)
0 引 言
纳米流体是指含有粒径为10~100 nm的固体纳米粒子的悬浮液[1-2]。在燃油液体中加入纳米尺度固体粒子后,在导热性、黏度、润湿性、表面张力等方面表现出与基液不同的热物理特性[3-4],如热传导性会显著增加,应用于热交换系统,在很大程度上可以提高系统的传热性能,且纳米粒子粒径小,比起毫米或微米级粒子,其在应用过程中不会引起磨损、堵塞等不良后果。因此纳米流体的应用引起人们的广泛关注[5-7]。
在燃油液滴蒸发及雾化领域,纳米尺度固体粒子会影响液体燃油的蒸发焓、蒸气压、蒸发速率等基础物性参数[8]。Sefiane等[2]研究表明,相比于乙醇基液,纳米铝粒子的存在降低了液滴的蒸发速率。Chen等[9]研究了黏土、三氧化二铁和银等纳米粒子对液滴蒸发速率的影响,发现黏土和银纳米粒子能够提高基液的蒸发速率,但三氧化二铁(Fe2O3)纳米粒子则使得液滴蒸发速率降低。Moghiman等[10]从纳米物质种类及其添加质量分数的角度,研究了黏土、TiO2、ZrO2和Fe2O3等纳米流体液滴的蒸发特性,发现TiO2、ZrO2和 Fe2O3能使基液的蒸发速率降低,但黏土却会使基液蒸发速率增加。综上可见,由于试验条件及研究方法的差异,目前对纳米燃油蒸发的研究有时还会得到相互抵触的结论,对于纳米粒子在液滴蒸发过程的作用机理尚未达成共识。
液体中能量较高的分子有脱离液面进入气相的倾向,蒸气压正是用来衡量这一中间过程变化倾向的物理参数。蒸气压越大表示液体内分子逃逸的倾向越大,更易挥发。因而,蒸气压是评价物质相态稳定性的重要指标[11]。目前测量蒸气压的方法有饱和气流法、参比法、雷德法等,总体上可分为静态法和动态法。静态法直接测定与液体相平衡的蒸汽的压力,主要应用于高压和常压场合,是测定蒸气压的最基本方法[12-13]。动态法是在不同外部压力下测量液体的沸点,从而得到其蒸气压,多用于常压下蒸气压的测量。近年来,热重分析(thermogravimetric analysis,TGA)用于蒸气压测定已得到快速发展[14],常见于利用调制升温[15]、恒温模式[16]和非等温模式[17]研究升华和蒸发现象。Chatterjee等[18]采用热重法测量单组份药物的蒸气压,在合适的温度范围内具有很好的效果,计算得到的蒸汽压值与早期报导的由传统方法测量得到的值基本一致。Hazra等[19]采用热重法分别测量计算了 3种精油及其混合物的蒸气压值并与早期收录的数据相比,发现在已知多组分化合物平均分子量的条件下,热重法可用于多组分物质蒸气压的测量。
虽然有一些文献汇编蒸气压和蒸发焓数据[20-21],但更多物质的物性参数并未被穷举。本文以正十四烷作为基液燃油,配制不同粒径及浓度的CeO2纳米燃油,采用恒温热重法进行纳米燃油蒸发试验,并计算纳米燃油的蒸气压、蒸发焓以及蒸发过程的活化能等物理特征参数。这些特性参数可以反映燃油蒸发的难易程度、蒸发速率的大小以及蒸发时吸收的热量,影响着混合气形成的质与量,从而为纳米燃油雾化蒸发及燃烧等热力学过程研究提供重要的基础数据。
1 材料与试验
1.1 纳米燃油的配制
柴油是一种多组分混合物,其蒸发特性受到多个不同馏程组分的复合影响,难以区分某一组分的蒸发过程。为便于简化研究,选用与柴油分子结构较为接近的单组份正十四烷(C14)纯物质作为基液燃油[22],表1为正十四烷和柴油的理化性质参数的对比,可以看出,正十四烷和柴油理化特性较为相似。将20、50 nm 2种粒径的CeO2粒子添加至基液燃油 C14中,配制浓度为 50和100 mg/L的纳米燃油,分别记作 20 nmCe50、20 nmCe100、50 nmCe50、50 nmCe100。
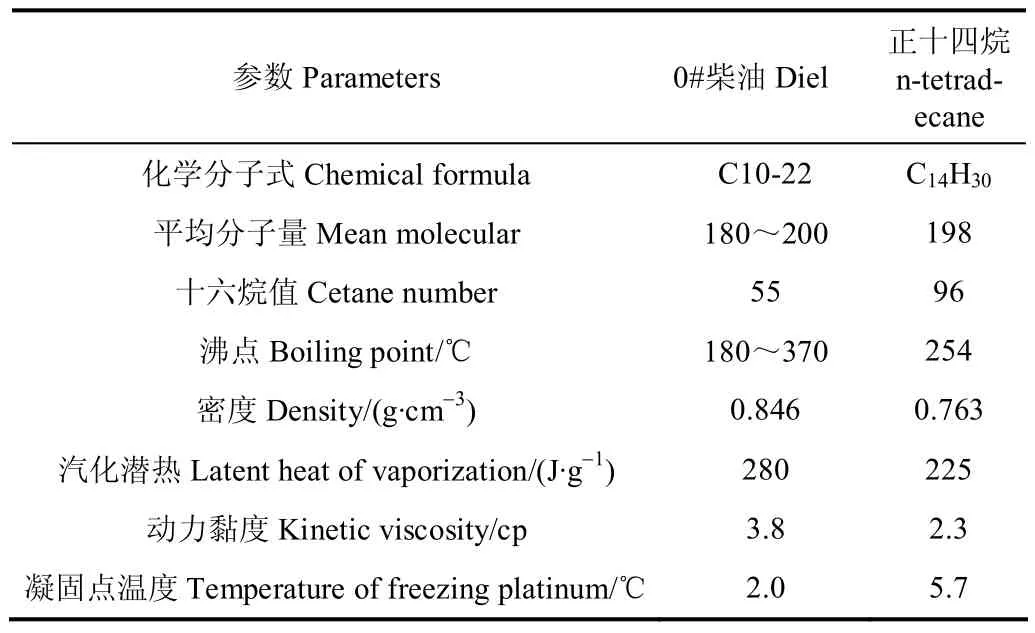
表1 正十四烷和柴油的理化性质参数Table 1 Physical and chemical properties of tetradecane and diesel
采用物理分散与化学分散相结合的方法配制纳米燃油。选用十六烷基三甲基溴化铵(cetyltrimethyl ammonium bromide,CTAB)作为阳离子表面活性剂,加入基液燃油后能够包裹CeO2粒子,使其带上正电荷而相互排斥,防止发生团聚沉淀。将称量好的CeO2纳米粒子与表面活性剂CTAB放入研钵中轻轻搅拌研磨,使其充分混合均匀。然后将上述混合物倒入基液燃油中搅拌,在40 ℃水浴温度下超声震荡30 min,得到均匀分散且稳定的纳米燃油。
1.2 试验仪器
采用瑞士METTLER公司的TGA/DSC1型综合热重仪,用经过灼烧恒重的刚玉坩埚盛放试样,其横截面积为 3.848 5×10-5m2。
在C14及其纳米燃油的恒温热重试验过程中,既要求燃油样品有明显的蒸发,但又不能出现裂解结焦现象,因而依据C14的沸点,设定恒温度区间为100~140 ℃,以5 ℃作为恒温间隔,每个等温段均保持10 min。燃油样品的恒温热重测试程序如下:用高纯氮气(99.99%)作为工作气和保护气,流量均为50 mL/min,将空坩埚在100 ℃恒温1 h,以除去挥发性杂质;使用瑞士METTLER公司MX-5微克电子天平称量约20 mg燃油样品加入坩埚,在恒定温度100 ℃下保持10 min;重复上述试验步骤,分别进行105~140 ℃下的恒温热重试验。为了减小试验误差,进行3次试验并取平均值。
2 试验方法
2.1 蒸发过程活化能
活化能是指分子从常态转变为活跃状态所需要的能量。在纳米燃油蒸发过程中,引入活化能来衡量纳米燃油蒸发的难易程度。
热重法测量物质在升温条件下的质量变化,是求解其热动力学特征的有力工具。蒸发失质量过程可由式(1)来描述[23-24]。
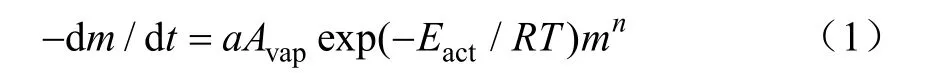
式中m为t时刻样品剩余质量,g;T为绝对温度,K;R为气体常数,J/(mol·K);t为时间,s;a为比例常数;Eact为活化能,kJ/mol;Avap为蒸发表面积,m2;n为反应等级。
对于零级蒸发,n=0,有
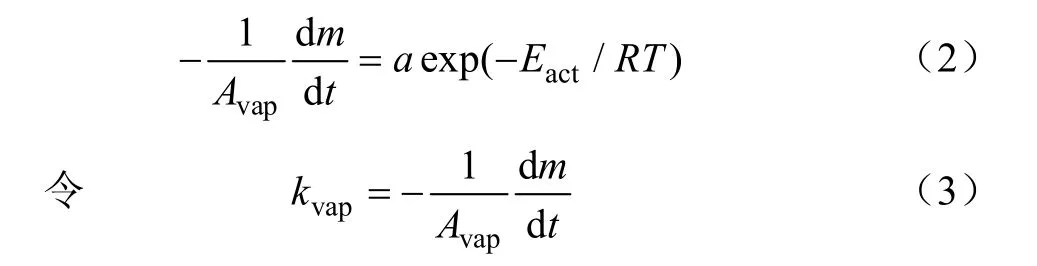
代入式(3),整理可得

式(4)即为Arrhenius方程,其中kvap为单位面积蒸发速率,kg/(s·m);k0为指前因子。
根据式(3)和式(4),取对数,得到拟合方程
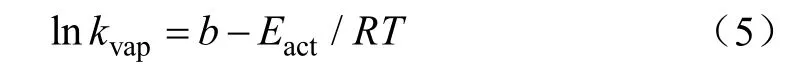
将lnkvap与1/T作图得到一条直线,由其斜率可计算得到蒸发过程的活化能[25]。
2.2 蒸气压
液体汽化现象用Langmuir方程来描述[26-27]
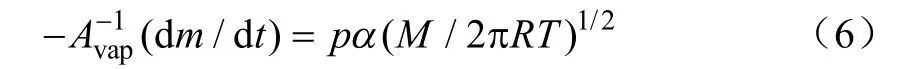
式中-dm/dt是液体的失质量率,g/s;p是蒸气压,kPa;α是汽化常数;T是绝对温度,K;M是摩尔质量,198.39 g/mol;R是气体常数,8.314 J/(mol·K);在真空条件下,α=1,在保护气条件下,α是常数[28]。重新排列方程(6)得
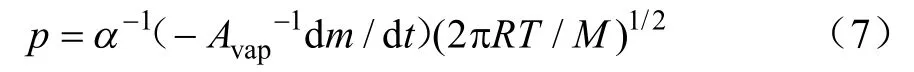
令式(7)中(2πR)1/2α-1=k,k是与温度无关的经验参数;v=(−Avap-1dm/dt)(T/M)1/2,则式(7)可写为

利用已知蒸气压的参考物质的热重数据计算可得到v,根据Antoine方程[29]可得到其不同温度下的蒸气压值,将参考物质的蒸气压p对v作图,得到一条通过原点的直线,斜率即是此试验环境下的k值。依据同样的方法,利用恒温热重试验数据可计算出各纳米燃油在不同温度下的v值,再根据式(8),即可计算出纳米燃油的蒸气压值。
2.3 蒸发焓
由Clausius-Clapeyron方程使蒸气压与蒸发焓和温度相关联[30]

式中c是经验常数;ΔHvap是摩尔蒸发焓,kJ/mol。
由于燃油蒸发量较小,可以认为在坩埚内的液体蒸发表面积不变,因此有
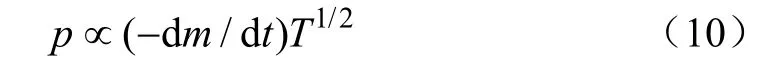
则得到拟合方程
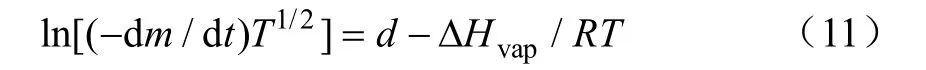
式中d为常数。将ln[(-dm/dt)T1/2]对1/T作图,得到一条直线,其斜率为-ΔHvap/RT,根据斜率可计算出平均温度蒸发焓ΔHvap(Ta),kJ/mol。Ta是平均温度,Ta=(Ts+Tf)/2,Ts为起始恒温温度,Tf为终止恒温温度[31]。
3 试验结果与分析
3.1 蒸发过程活化能分析
在确定基液燃油和纳米燃油蒸发过程的活化能之前,需要考察其在一段温度范围内的蒸发速率T及其一阶导数DTG曲线的特征,以确定其热动力学阶数。当一阶导数DTG曲线上只出现一个峰值,可以判定此蒸发过程表现为零级热动力学特性[18]。
分别取C14和纳米燃油20 nmCe50置于坩埚中用高纯氮气(99.00%)作为工作气和保护气,流量均为50 mL/min,温升区间为30~500 ℃,升温速率设为20 ℃/min,得到如图1所示的TGA曲线。可见C14和纳米燃油20 nmCe50的DTG曲线只有一个失质量峰,说明基液燃油C14和纳米燃油均符合零级蒸发动力学特征。
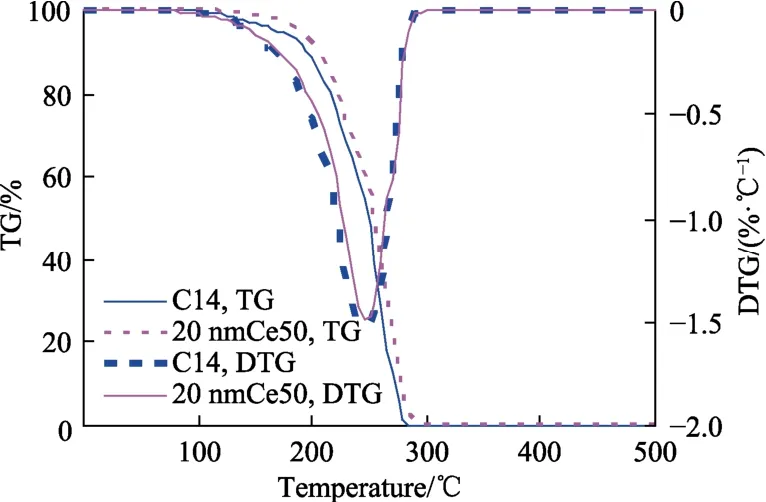
图1 C14和纳米燃油20 nmCe50的TG/DTG曲线Fig.1 TG/DTG curves of C14 and nano-fuel 20 nmCe50
图2为C14在不同恒温下的质量损失随时间的变化,从图中可以看出,质量损失和时间呈现良好的线性关系,斜率-dm/dt即为挥发速率,列于表2中。
由 TG条件下各燃油样品在惰性氛围下的蒸发试验数据,计算得到不同恒温温度下的蒸发速率−dm/dt,代入式(5),将 lnkvap与 1/T作图得到图 3。各样品 lnkvap与1/T的表达式及活化能列于表3。
由表 3可知,不同粒径及质量分数的纳米粒子加入使基液燃油蒸发所需活化能增加,C14、20nmCe50、20nmCe100、50nmCe50和 50nmCe100的燃油蒸发行为所需的活化能分别是60.97、64.36、66.63、62.95和65.09 kJ/mol,较C14燃油分别增大了5.6%,9.3%,3.2%和6.8%。对于相同质量分数的纳米燃油,粒子尺度越小,则蒸发过程所需活化能越大;而对于相同尺度的纳米粒子,质量分数越大的纳米燃油其蒸发过程所需活化能亦增大。总体而言,在纳米燃油蒸发过程中,由于均匀悬浮的纳米粒子具有较低的比热容,将从外界吸收的热量加快向液体内部传递,而延滞了气液自由界面处液体分子的挥发,因而纳米燃油的挥发过程需要更多的能量。此外,对于相同质量分数的纳米燃油,粒径越小其比表面积越大,因此表面分子作用力增大,这需要更多的能量来克服分子间的作用力[32]。而对于同一尺度的粒子,其在燃油中的质量分数越大,则纳米燃油的表面张力或表面能越大[33],因而燃油蒸发所需的活化能亦增大。
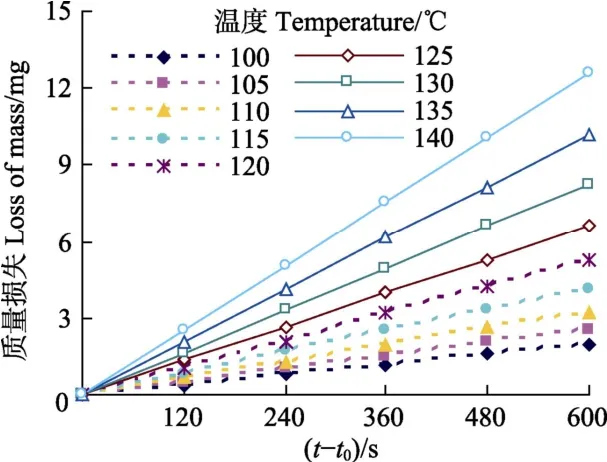
图2 不同恒温温度下C14的质量损失Fig.2 C14 mass loss with time at various constant temperature
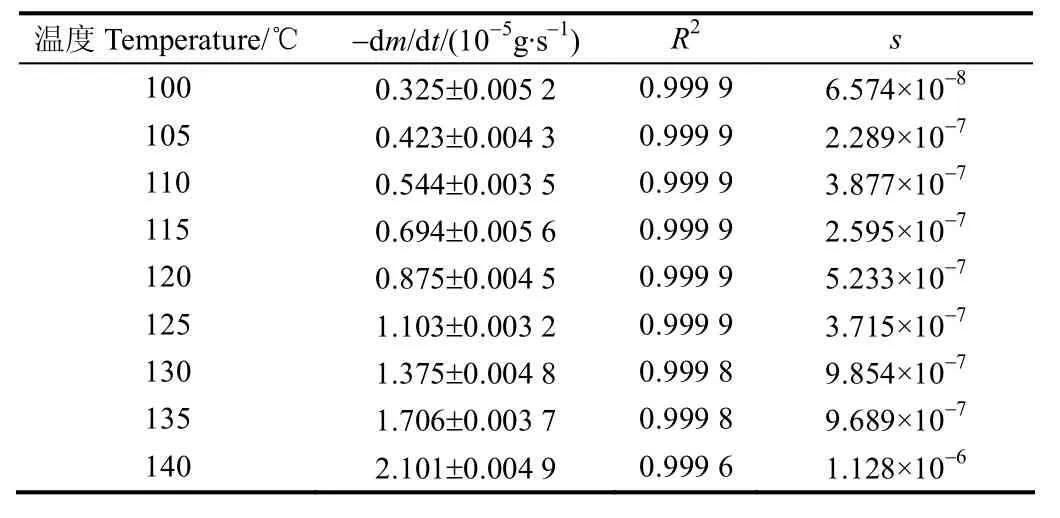
表2 C14蒸发过程的失质量率-dm/dt、拟合精度R2和标准差sTable 2 -dm/dt, fitting precision R2 and standard deviation s for evaporation of C14

图3 蒸发过程的lnkvap与1/T的关系Fig.3 Relationship of lnkvap versus 1/T during vaporization process

表3 燃油蒸发活化能Eact的求解表达式Table 3 Expressions for solving activation energy Eact of fuel evaporation
3.2 蒸气压测量结果与分析
根据Antoine方程

可计算出C14的蒸气压p。其中A、B、C为Antoine常数,对于正十四烷,A=7.013,B=1 740.88,C=167.22[28]。
将计算得到的p值和v值作图,斜率即为k值。从图4可见,p和v之间呈现良好的线性关系,可得常数k=3.809 8×103Pa·s/(g·K·mol)1/2,R2=0.998 5,进一步计算得到汽化常数α=0.001 9。试验条件下的汽化常数α值远小于1,这是由于试验是在载气存在的情况下进行的,与真空条件相差很远,Vecchio等对此类情况进行过说明[28]。
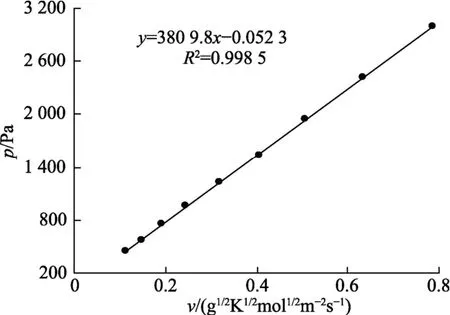
图4 蒸气压p和变量ν的关系Fig.4 Relationship between vapor pressure p and variable ν
依据热重试验得到的蒸发速率数据,计算出各样品的蒸气压p,其与温度T的关系如图5所示,可见蒸气压随温度呈多项式或指数分布式增长。与基液燃油C14相比,CeO2纳米燃油的蒸气压降低。以20 nmCe100纳米燃油为例,其蒸气压在373.15 K时较C14降低了18.1%。比较不同粒径及不同质量分数纳米燃油的蒸气压,由于纳米粒子的加入,使燃油挥发速率降低,因而粒径越小或质量分数越大的纳米燃油的蒸气压越低。表面张力是关乎液体蒸发形成蒸气压的重要参数。由于小尺度纳米粒子具有较大的比表面积,粒子与液体分子之间的相互吸引的作用能更大,即纳米燃油的表面张力增强,需要更多的能量才能使燃油分子从液相向气相扩散,因而蒸发过程受到一定程度的阻滞,已挥发气体分子所形成的蒸气压降低。
3.3 蒸发焓测定结果与分析
图6为ln[(-dm/dt)T1/2]与1/T的关系曲线,从中选取连续的5个数据,可分别计算得出383.15、388.15、393.15、398.15、403.15 K时的蒸发焓,表4为其多次试验平均值。

图5 不同温度下的蒸气压pFig.5 Vapor pressure p varing with temperature

图6 ln[(-dm/dt)T1/2]与1/T的关系Fig.6 Relationship between ln[(-dm/dt)T1/2]and 1/T
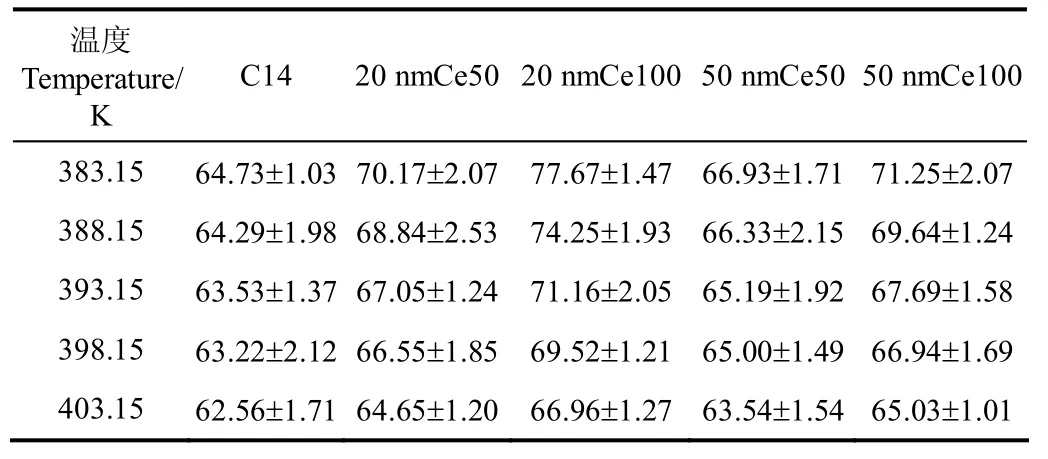
表4 不同温度下各燃油样品的蒸发焓Table 4 Vaporization enthalpy of various fuel samples at different temperature kJ·mol-1
王军等[34]采用气相色谱仪测出C14在343.15 K温度下的蒸发焓为67.74 kJ/mol,运用本文方法计算得到此温度下 C14的蒸发焓为 68.25 kJ/mol,结果相差 0.75%;Chickos等[35]列出众多烷类在298.15 K温度下的蒸发焓,其中C14蒸发焓为71.70 kJ/mol,运用本文方法得到的数值为71.93 kJ/mol,结果相差0.32%。由此可见,通过恒温热重法获得的蒸发焓数值与文献数据较为符合,所以该方法可以很好地应用于纳米燃油热力学基础物性参数的测定。
从表 4可以看出,对于特定的纳米燃油样品,其蒸发焓随温度升高而降低,这可解释为随着温度升高液体自身的内能随之增加,达到蒸发临界状态所需的热量减少,因此蒸发焓随温度升高而降低。与基液燃油相比,纳米燃油的蒸发焓升高;此外,随着粒子尺度减小或质量分数增加,纳米燃油的蒸发焓升高。在383.15 K时,20 nmCe100纳米燃油蒸发焓较 C14相差最大,增大了16.7%。纳米燃油蒸发焓的增大是由于纳米粒子与正十四烷燃油分子之间产生了新的相互作用。在固体纳米粒子均匀分散于燃油的接触面处,液体燃油分子之间原先的氢键被破坏,但燃油分子会与纳米粒子形成新的作用力和氢键[36-37],而这种作用力会随着粒子质量分数增加或粒子尺度减小而增强,因而蒸发焓亦随之增大。
4 结 论
1) 在热重条件下,考察纳米燃油在不同恒温温度下的蒸发特性,并求解纳米燃油蒸发过程的活化能、蒸气压和蒸发焓等热动力学参数。在纳米燃油蒸发过程中,由于纳米粒子具有较低的比热容,将从外界吸收的热量加快向液体内部传递,延滞了气液自由界面处液体分子的挥发,且这种作用会随着纳米粒子尺度减小或质量分数增加而增强,因而纳米燃油蒸发过程需要更大的活化能。
2)与基液燃油相比,在不同温度下纳米燃油蒸发所形成的蒸气压降低。在373.15 K时,20 nmCe100纳米燃油蒸气压较 C14相差最大,降低了 18.1%。随着粒子尺度减小或质量分数增加,粒子与液体分子之间相互吸引的作用能即表面张力增强,延滞了液相分子向气相扩散,因而纳米燃油蒸发所形成的蒸气压降低。
3)与基液燃油相比,在不同温度下纳米燃油蒸发所需要的蒸发焓增加。在383.15 K时,20 nmCe100纳米燃油蒸发焓较 C14增大了16.7%。由于燃油分子与纳米粒子之间的范德华力及氢键作用,会随着粒子尺度减小或质量分数增加而增强,因而纳米燃油蒸发所需的蒸发焓升高。
4)纳米粒子尺度和质量分数对纳米燃油蒸发所需的活化能、蒸气压及蒸发焓等特征参数的影响表现出一致的作用规律。
[1]Tso C Y, Fu S C, Chao C Y H. A semi-analytical model for the thermal conductivity of nanofluids and determination of the nanolayer thickness[J]. International Journal of Heat &Mass Transfer, 2014, 70(3): 202-214.
[2]Sefiane K, Bennacer R. Nanofluids droplets evaporation kinetics and wetting dynamics on rough heated substrates[J]. Advances in Colloid and Interface Science, 2009, 147:263-271.
[3]Wang X, Xu X, Choi S U S. Thermal conductivity of nanoparticle-fluid mixture[J]. Journal of Thermophysics &Heat Transfer, 2012, 13(13): 474-480.
[4]Chen C H, Ding C Y. Study on the thermal behavior and cooling performance of a nanofluid-cooled microchannel heat sink[J]. International Journal of Thermal Sciences, 2011,50(3): 378-384.
[5]Pakdaman M F, Akhavan-Behabadi M A, Razi P. An experimental investigation on thermo-physical properties and overall performance of MWCNT/heat transfer oil nanofluid flow inside vertical helically coiled tubes[J]. Experimental Thermal & Fluid Science, 2012, 40(7): 103-111.
[6]Kleinstreuer C, Feng Y. Experimental and theoretical studies of nanofluid thermal conductivity enhancement: A review[J].Nanoscale Research Letters, 2011, 6(1): 229-241.
[7]Esfe M H, Arani A A A, Rezaie M, et al. Experimental determination of thermal conductivity and dynamic viscosity of Ag-MgO/water hybrid nanofluid[J]. International Communications in Heat & Mass Transfer, 2015, 66(9): 189-195.
[8]Eastman J A, Phillpot S R, Choi S U S, et al. Thermal transport in nanofluids[J]. Annual Review of Materials Research, 2004, 34(1): 219-246.
[9]Chen R H, Phuoc T X, Martello D. Effects of nanoparticles on nanofluid droplet evaporation[J]. International Journal of Heat & Mass Transfer, 2010, 53(19): 3677-3682.
[10]Moghiman M, Aslani B. Influence of nanoparticles on reducing and enhancing evaporation mass transfer and its efficiency[J]. International Journal of Heat & Mass Transfer,2013, 61: 114-118.
[11]郑青,雷群芳,方文军. 基于热重分析测定物质的蒸气压[J]. 浙江大学学报:理学版,2008,35(1):59-62.Zheng Qing, Lei Qunfang, Fang Wenjun. Measurements of vapor pressures of alkanes by thermogravimetry[J]. Journal of Zhejiang University: Science Edition, 2008, 35(1): 59-62.(in Chinese with English abstract)
[12]尹洪清. 大唐煤液化油主要热力学性质研究[D]. 太原:太原理工大学,2009.Yin Hongqing. Study on Main Thermodynamic Properties of Datang Coal Liquid Fractions[D]. Taiyuan: Taiyuan University of Technology, 2009. (in Chinese with English abstract)
[13]Ye S L, Yang X W, Yang S J, et al. Experimental study and error correction of low saturated vapor pressure measurement based on static method[J]. Modern Chemical Industry, 2014,34(1): 161-164.
[14]Kröhl T, Kästel R, König W, et al. Methods for determining the vapour pressure of active ingredients used in crop protection. Part V: Thermogravimetry combined with solid phase microextraction (SPME)[J]. Pest Management Science,2015, 53(4): 300-310.
[15]Brady J E, Smith J L, Hart C E, et al. Estimating ambient vapor pressures of low volatility explosives by risingtemperature thermogravimetry[J]. Propellants Explosives Pyrotechnics, 2012, 37(2): 215-222.
[16]杨家振,关伟,佟静,等. 恒温热重法测定离子液体蒸气压和汽化焓[J]. 辽宁大学学报:自然科学版,2014,41(3):193-201.Yang Jiazhen, Guan Wei, Tong Jing, et al. The determination of the vapor pressure and vaporization enthalpies for ionic liquids using isothermogravimetry[J]. Journal of Liaoning University: Natural Science Edition, 2014, 41(3): 193-201.(in Chinese with English abstract)
[17]Suceska M, Rajic M, Matecic-Musanic S, et al. Kinetics and heats of sublimation and evaporation of 1,3,3-trinitronzetidine(traz)[J]. Journal of Thermal Analysis & Calorimetry, 2003,74(3): 853-866.
[18]Chatterjee K, Hazra A, Dollimore D, et al. Estimating vapor pressure curves by thermogravimetry: A rapid and convenient method for characterization of pharmaceuticals[J]. European Journal of Pharmaceutics & Biopharmaceutics, 2002, 54(2):171-180.
[19]Hazra A, Dollimore D, Alexander K. Thermal analysis of the evaporation of compounds used in aromatherapy using thermogravimetry[J]. Thermochimica Acta, 2002, 392/393:221-229.
[20]Stull D R. Vapor pressure of pure substances organic compounds[J]. Industrial & Engineering Chemistry Research,1947, 39: 517-540.
[21]Jordan T E. Vapor Pressure of Organic Compounds [M].Science, 1954.
[22]鞠洪玲,成晓北. 正十四烷在柴油机条件下芳香烃的形成及演化[J]. 华中科技大学学报:自然科学版,2011,39(9):112-116.Ju Hongling, Cheng Xiaobei. Polycyclic aromatic hydrocarbon formation during n-tetradecane combustion in diesel engines[J]. Journal of Huazhong University of Science &Technology: Natural Science Edition, 2011, 39(9): 112-116.(in Chinese with English abstract)
[23]Lerdkanchanaporn S, Dollimore D. An investigation of the evaporation of stearic acid using a simultaneous TG-DTA unit [J]. Termochim Acta, 1998, 324: 15-23.
[24]Hazra A, Alexander K, Dollimore D, et al. Characterization of some essential oils and their key compounds:thermoanalytical techniques[J]. Journal of Thermal Analysis& Calorimetry, 2004, 75: 317-330.
[25]Wilburn F W, Dollimore D, Non-isothermal kinetics: A different approach[J]. Thermochimica Acta, 2000, 357:141-145.
[26]Wright S F, Dollimore D, Dunn J G, et al. Determination of the vapor pressure curve of adipic acid and triethanlamine using thermogravimetric analysis [J]. Thermochimica Acta,2004, 421: 25-30.
[27]Langmuir I. The vapor pressure of metallic tungsten[J].Physics Review, 1913, 2: 329-342.
[28]Vecchio S, Catalani A, Rossi V, Tomassetti M. Thermal analysis study on vaporization of some analgesics Acetanilide and derivatives[J]. Thermochimica Acta, 2004, 420: 99-104
[29]Dean J A. Lange’s Handbook of Chemistry[M]. New York:McGraw- Hill, 1997.
[30]Price D M. Vapor pressure determination by thermogravimetry[J].Thermochimica Acta, 2001, 367/368: 253-262.
[31]Anderson J L, Dixon J K, Maginn E J, et al. Measurement of SO2solubility in ionic liquids[J]. Journal of Physical Chemistry B, 2006, 110: 15059-15062.
[32]Kamatchi R, Venkatachalapathy S, Srinivas B A. Synthesis,stability, transport properties, and surface wettability of reduced graphene oxide/water nanofluids[J]. International Journal of Thermal Sciences, 2015, 97(13): 17-25.
[33]Bhuiyan M H U, Saidur R, Amalina M A, et al. Effect of nanoparticles concentration and their sizes on surface tension of nanofluids[C]// Bsme International Conference on Thermal Engineering. 2015: 431-437.
[34]王军,张真真,杨许召,等. 反气相色谱测定双阳离子型离子液体的溶解度参数[J]. 色谱,2009,27(4):480-483.Wang Jun, Zhang Zhenzhen, Yang Xuzhao, et al.Determination of solubility parameter for dicationic ionic liquid by inverse gas chromatography[J]. Chinese Journal of Chromatography, 2009, 27(4): 480-483. (in Chinese with English abstract)
[35]Chickos J S, Wilson J A. Vaporization Enthalpies at 298.15 K of the n-Alkanes from C21to C28and C30[J]. Journal of Chemical Engineering Data, 1997, 42(1): 190-197.
[36]Garai J. Physical model for vaporization [J]. Fluid Phase Equilibria, 2009, 283(1/2): 89-92.
[37]Israelachvili J N. Intermolecular and Surface Forces: Revised[M]. Academic: Third Edition, Elsevier Inc. 2011
