核桃抗逆基因JrGSTU23的克隆及表达分析
2018-08-22高向倩李忆林贾彩霞李大培杨玉婷杨桂燕
高向倩,李忆林,贾彩霞,李大培,杨玉婷,杨桂燕
(1.西北农林科技大学 林学院 山阳核桃板栗试验示范站,陕西 杨凌 712100;2.西北农林科技大学 林学院 陕西省经济植物资源开发利用重点实验室,陕西 杨凌712100)
谷胱甘肽转移酶(GSTs)是一个多功能的二聚体酶超家族,具有解毒、清除细胞内活性氧等功能[1]。在植物中,GSTs根据其功能和序列等特征被分为8个亚家族:alpha,mu,pi,sigma,theta,kappa,zeta 和线粒体(microsomal)GSTs[1-3]。 目前, 很多植物中的GST基因被陆续克隆[4-5], 并进行功能研究, 发现来自不同植物的GST同源基因或相同植株的不同GST基因,其功能具有一定差异。大多数GSTs基因具有响应逆境胁迫的功能。如前期研究发现,柽柳Tamarix hispida的zeta家族基因ThGSTZ1能被氯化钠,聚乙二醇(PEG 6000),脱落酸(ABA)和甲基紫精(MV)等胁迫调控,过量表达情况下能提高转基因株系抵抗盐、旱、MV及ABA等胁迫的能力[6-7]。核桃Juglans regia的JrGSTTau1基因也能响应不同逆境刺激,过量表达能改善植株应对低温胁迫的能力[8]。在羽衣甘蓝Brassica oleracea中分离获得65个GST基因,其中BoGSTU19,BoGSTU24,BoGSTF10能被冷胁迫强诱导,推测它们与冷胁迫响应具有重要关系[9]。水稻Oryza sativa OsGSTl2转基因拟南芥Arabidopsis thaliana表现出较高的重金属耐受力[10]。这些研究表明:GST基因在植物响应逆境应答及调节中具有多方面的作用,因此具有重要的研究价值。GST家族成员众多,目前对GST基因的研究主要集中在草本植物,对木本植物GST基因的研究较少,特别是经济干果核桃鲜见报道。核桃属多年生落叶乔木,是中国主要经济树种之一。近年来全球环境的变化,环境因子特别是西北地区越冬入春出现的 “倒春寒”及夏秋核桃成熟期严重的高温干旱等气候现象,严重制约了核桃产业的发展。因此,筛选核桃逆境响应重要基因,研究其逆境响应功能机制,将对了解核桃的逆境适应机制具有指导作用。本研究从核桃中鉴定获得1条GST基因JrGSTU23,通过生物信息及定量表达分析其生物学功能,以期为核桃抗逆响应研究提供候选基因。
1 材料与方法
1.1 材料及处理
选取培养于相同条件下的2年生 ‘香玲’ ‘Xiangling’核桃嫁接苗用作研究材料。处理包括非生物胁迫[100 g·kg-1聚乙二醇(PEG 6000), 0.3 mol·L-1氯化钠、 低温 6 ℃]和激素处理[0.1 mmol·L-1脱落酸(ABA)], 100.0 mg·L-1茉莉酸(MeJA)及 2.0 mg·L-1水杨酸(SA)。 分别在 0, 3, 6, 12, 24, 48 h 取样,以0 h正常浇水作为对照,重复3次·处理-1。分别收集各处理后的根和叶,用液氮速冻后保存于-80℃冰箱备用。
1.2 JrGSTU23基因的克隆与分析
以 “glutathione transferase”为关键词在 ‘香玲’核桃转录组数据中查找GST基因,经BLAST比对选取其中1条GST基因(命名为JrGSTU23)进行分析。用ORF finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)确定JrGSTU23基因开放读码框(ORF),再根据ORF两端序列设计引物JrGSTU23-F和JrGSTU23-R(表1),进行聚合酶链式反应(PCR)扩增。产物经回收纯化后与pMD-18-T载体连接并转化大肠埃希菌Escherichia coliDH5ɑ感受态细胞。挑取阳性克隆扩大培养进行菌液PCR验证,对获得目的片段的克隆测序。利用Expasy ProtParam(http://web.expasy.org/protparam/)对确认的JrGSTU23基因序列特征进行分析。利用BLASTP(http://blast.ncbi.nlm.nih.gov/Blast)进行序列同源性搜索;利用Clustal 3.0软件对不同物种的GST蛋白进行多序列比对和进化分析。使用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)分析该基因启动子中含有的顺式作用元件。利用Expasy中Swiss Model程序同源建模,推测该蛋白的三维结构模型。
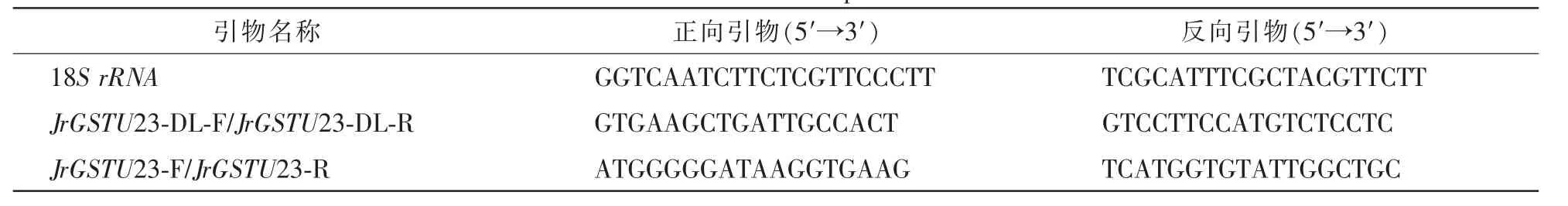
表1 研究所用引物Table 1 The used primers
1.3 JrGSTU23的表达分析
各样品总核糖核酸(RNA)采用十六烷基三甲基溴化铵(CTAB)方法提取[8],RNA经DNA消化酶处理后采用PrimeScriptTMRT Reagent Kit(CWBIO,康为世纪,中国)反转录为cDNA,稀释10倍后用作实时荧光定量PCR(qRT-PCR)的模板。qRT-PCR参照SYBR Green Real time PCR Master mix(CWBIO)进行,内参基因为核桃 18S rRNA(HE574850)基因[10]。JrGSTU23定量引物为 DL-F和 DL-R(表1)。 定量反应仪器为Applied Biosystems生产的Step OneTMReal-Time PCR System。反应程序为:94℃预变性30 s;94℃变性12 s,60℃退火45 s,72℃延伸 45 s,45个循环;81℃读板 1 s, 重复3次·样品-1。 采用 2-ΔΔCt法对定量结果进行相对分析[11],所有表达值均做了以2为底的对数转化。
2 结果与分析
2.1 JrGSTU23全长cDNA序列分析
通过查找核桃转录组数据获得1条GST基因,根据获得的cDNA序列设计引物JrGSTU23-F/R进行PCR验证,经分析发现该基因ORF长684 bp,拟推导的蛋白分子量为25.89 kDa,含有氨基酸数为227,理论等电点为5.20。BLAST分析发现:该基因与核桃转录组中的GST23基因相同。保守结构域分析发现:该蛋白具有GST-Tau保守域(图1),表明该蛋白属于GST氧硫还蛋白亚家族(thioredoxin-line superfamily,Thi),因此命名为JrGSTU23(GeneBank登录号:MG356784)。经美国生物技术信息中心(NCBI)同源搜索获得相似蛋白,并进行进化分析,发现JrGSTU23蛋白与香蕉Musa accuminata,毛果杨Populus trichocarpa等的进化关系较近(图2)。通过Swiss Model程序同源建模,推测该蛋白的三维结构如图3所示。
2.2 JrGSTU23启动子分析
以JrGSTU23在NCBI数据库中进行同源搜索,发现其与 ‘强特勒’核桃的GST序列(XM_018974105.1)一致。因此,分析XM_018974105.1序列起始密码子上游2 000 bp的DNA序列作为基因启动子,并对其顺式作用元件进行分析,为预测JrGSTU23基因的功能及可能调控机制提供参考依据。PlantCARE预测结果显示,JrGSTU23启动子包含多个与逆境响应及激素调控相关的顺式作用元件,如热胁迫响应元件(HSE),干旱响应元件(MBS),茉莉酸响应元件(CGTCA-motif),水杨酸响应元件(TCA-element)等(表 2)。
2.3 外源激素胁迫对JrGSTU23表达的影响
对试材分别进行ABA,MeJA,SA等激素处理。qRT-PCR实验发现:JrGSTU23能被这些激素明显诱导,但在根和叶的表达趋势不同(图4)。在叶中,ABA处理3~6 h被抑制,24 h达最大表达水平(2.85);MeJA胁迫下与ABA相反,随着胁迫时间延长,JrGSTU23的表达水平逐渐下降,在24 h被抑制(-0.98);SA胁迫3~6 h也被抑制,在24 h达最大值4.13,但其最低值出现在3 h,为-0.01。在根中,JrGSTU23在ABA胁迫下的最大和最小转录水平分别出现在12和24 h,分别为4.35和2.74;MeJA处理下,该基因的最大和最小表达量分别为7.24(12 h)和2.73(3 h);而在SA胁迫下,JrGSTU23的表达随胁迫时间延长而增强,最大值为4.57倍(24 h)。表明JrGSTU23基因能不同程度响应ABA,Me-JA,SA的胁迫,并表现出组织特异性,但其具体的响应机制可能不同。
2.4 不同非生物胁迫对JrGSTU23基因表达的影响
qRT-PCR结果显示:JrGSTU23能被氯化钠,聚乙二醇(PEG 6000),6℃等不同胁迫明显诱导,且在大多数时间点下的表达差异显著(图4)。氯化钠胁迫下,JrGSTU23在根和叶中的表达趋势相似,均随着胁迫时间的延长表达增高,在胁迫24 h达最大表达水平,分别为2.49和4.11。但除3 h外,其他处理点该基因在根中的表达水平高于在叶中的表达。PEG 6000模拟干旱胁迫3~12 h,JrGSTU23在叶中的表达被抑制,24 h被诱导为1.76;在根中的表达趋势与氯化钠胁迫相似,随着胁迫时间延长而增大,且在24 h达最高水平,但表达量低于氯化钠胁迫。表明JrGSTU23应对氯化钠和干旱胁迫的响应机制可能相似,但JrGSTU23对盐胁迫可能更为敏感。低温胁迫下,JrGSTU23在叶中的表达在6 h(1.22)和24 h(2.30)出现2个高峰;在根中,其表达趋势与氯化钠和干旱胁迫相似,随着胁迫时间延长而升高,在24 h 达最大值(3.06)。

图1 JrGSTU23蛋白与其同源蛋白序列的氨基酸聚类分析Figure 1 Amino acid sequence alignment between JrGSTU23 and its homologous proteins from other species

图2 JrGSTU23蛋白与其他物种相似蛋白氨基酸序列的系统进化树分析Figure 2 Phylogenetic tree of JrGSTU23 protein and its homologs from other species
图3 JrGSTU23蛋白三维结构预测模型Figure 3 Predicted 3D structure model of protein JrGSTU23
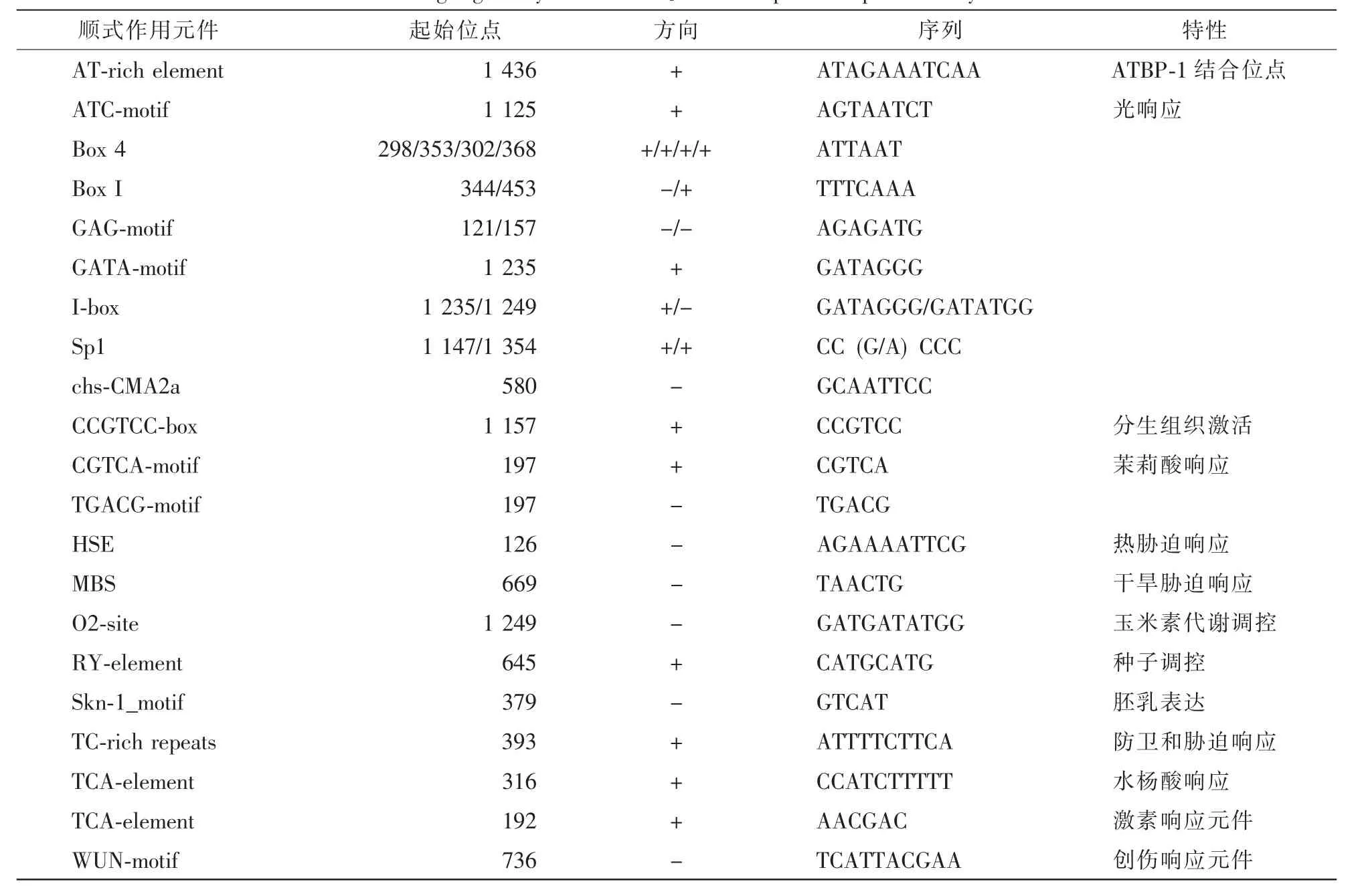
表2 PlantCARE预测JrGSTU23启动子区顺式作用元件Table 2 Cis-acting regulatory elements in JrGSTU23 promoter predicted by PlantCARE
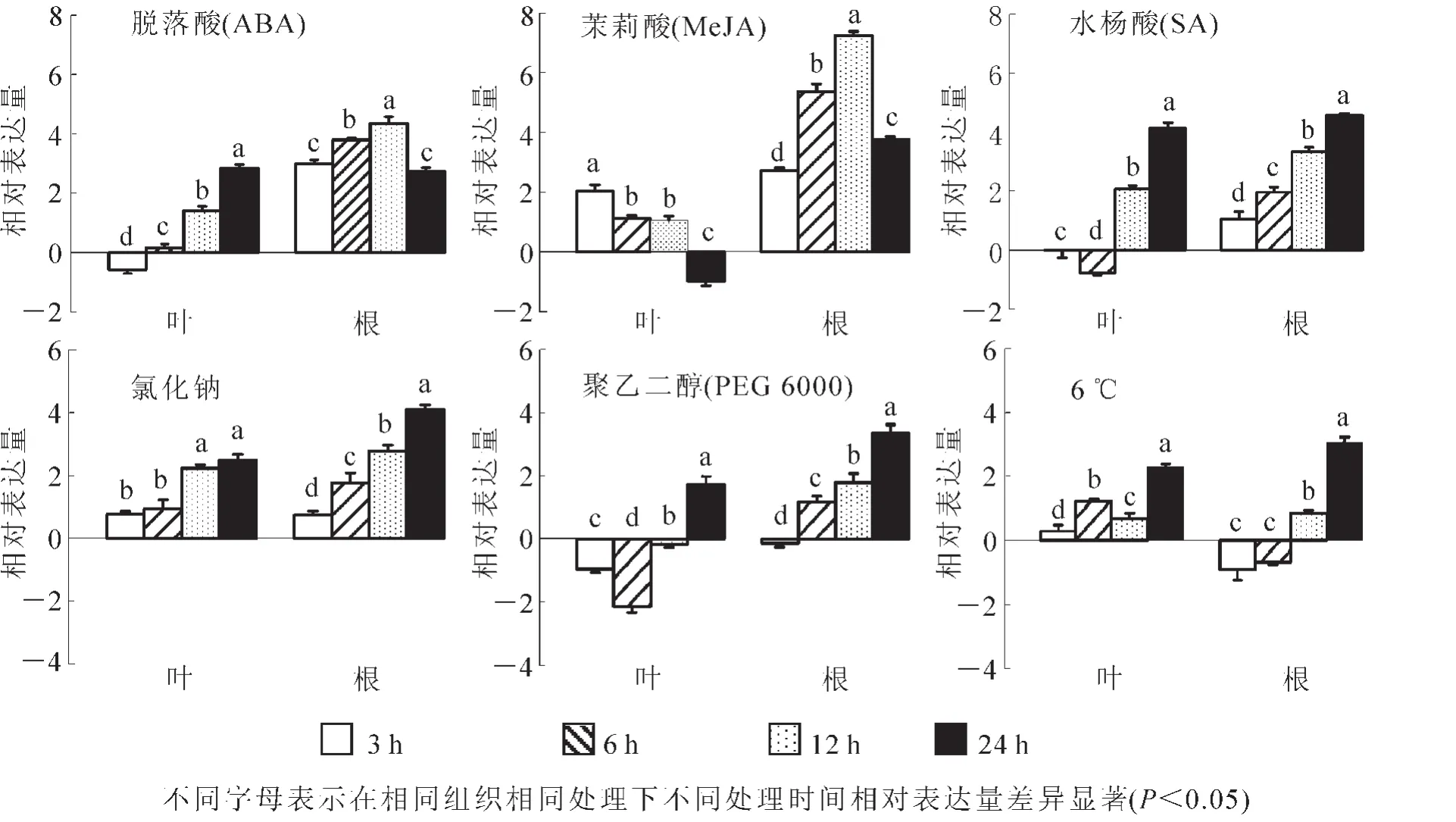
图4 JrGSTU23基因在不同胁迫处理下的表达水平Figure 4 Expression level of JrGSTU23 gene under different stresses
3 讨论
GSTs是植物响应逆境的重要基因,在植物解毒等方面具有重要作用。其中,含有Tau保守结构域的GST亚家族基因,参与植物众多的逆境响应。核桃作为中国西北地区扶贫攻坚项目的重要经济树种,在推动区域经济发展上具有重要作用。核桃产业的健康快速发展与核桃产量和质量息息相关。但气候等环境因子严重制约了中国核桃产业的发展,因此,选育抗逆优良核桃品种,掌握核桃抗逆适应机制,对深入了解核桃的适应性具有重要指导作用。本研究从 ‘香玲’核桃中克隆获得1条Tau家族的GST基因(JrGSTU23),经进化分析发现该基因与来自水稻、香蕉、毛果杨、大豆Glycine max等物种的Tau家族基因具有较近的亲缘关系,推测其可能与这些蛋白具有相似或相近的功能。如,水稻Osgstu4和Osgstu3能迅速被抗氧化剂和过氧化氢诱导,表明Osgstu4和Osgstu3的应答反应涉及氧化还原反应[12]。大豆GmGSTU2-2是严格的渗透胁迫型响应基因,参与植物胁迫反应中的催化和调节功能网络[13]。毛果杨的GSTU16和GSTU45能被三硝基甲苯(2,4,6-trinitrotoluene)诱导[14]。因此,推测JrGSTU23与逆境应答具有重要关系。
顺式作用元件一般由5~20个碱基对组成,是同一DNA分子中具有转录调节功能的特异DNA序列[15]。海蓬子Salicornia brachiata的一个Tau类GST基因的上游1 023 bp启动子包含有非生物胁迫响应相关的ABA响应元件(ABRE),干旱响应基因rd22识别位点(MYB),结节特意表达元件(NOD),光响应表达元件(GATA),光调控表达元件(GT1)及激素、病害和损伤等相关的顺式作用元件,参与了该基因响应氯化钠和渗透胁迫的表达调控[16]。玉米Zea mays的ZmCIPK10和ZmZIP71基因启动子序列中含有ABA,SA,赤霉素(GA),低温等相关的顺式作用元件,在氯化钠、干旱、低温胁迫下,ZmCIPK10和ZmZIP71的表达量上升,表明其参与了玉米的逆境响应[17-18]。本研究发现:JrGSTU23基因启动子含有丰富的顺式作用元件,如玉米素代谢、种子调控、分生组织激活、胚乳表达以及干旱胁迫、热胁迫、防卫、MeJA和SA等响应相关的元件(表2)。由此可推测,JrGSTU23可能参与植物生长发育及逆境响应过程,具有深入研究的价值。
GSTs基因响应逆境具有组织表达特异性。本研究发现的JrGSTU23基因在不同激素(SA,MeJA,ABA)及不同逆境(氯化钠、干旱、低温)下在根和叶中能被不同程度地诱导表达,体现了一定的组织表达特异性和逆境响应特异性。这与其他物种的Tau家族GST基因的逆境响应表达具有一定的相似性。如从香蕉克隆获得的5个GST基因(MaGSTU1,MaGSTU2,MaGSTU3,MaGSTF1,MaGSTL1)的表达具有组织特异性,在盐、干旱、冷等胁迫下Tau亚家族的MaGSTU1,MaGSTU2,MaGSTU3的表达受盐、干旱、冷诱导更为明显,而MaGSTF1和MaGSTL1更受信号分子影响[19],预测这些GST基因对不同逆境的响应功能具有差异。盐胁迫下,番茄Solanum lycopersicum的SlGSTU23和SlGSTU26基因在叶中被上调表达[20],推测这些GST基因在不同逆境下的具体功能可能不同。JrGSTTau1在低温胁迫下也表现出根、叶表达差异,过表达提高了植株的抗寒能力[8]。可见,通过分析基因响应不同逆境的转录水平,可以推测其在逆境响应中可能的生物学功能。JrGSTU23能不同程度地响应激素及非生物胁迫,表明其参与了核桃的逆境响应调控。后续研究将通过在植株中过量表达全面分析JrGSTU23基因的抗逆响应功能。
4 参考文献
[1] DIXON D P,LAPTHORN A,EDWARDS R.Plant glutathione transferases [J].Methods Enzymol,2005,401(3):169-186.
[2] DIXON D,HARTMANN D H,KOLACZYK E D,et al.Evidence for a galactic r-ray halo [J].New Astron,1998,3(7):539 - 561.
[3] DIXON D P,EDWARDS R.Glutathione transferases [J].Arabidop Book,2010,8(45):e0131.doi:10.1199/tab.0131.
[4] CHEN J H,JIANG Hanwei,HSIEH E J,et al.Drought and salt stress tolerance of anArabidopsisglutathione S-transferase U17 knockout mutant are attributed to the combined effect of glutathione and abscisic acid [J].Plant Physiol,2012,158(1):340 - 351.
[5] JAIN M,GHANASHYAM C,BHATTACHARJEE A.Comprehensive expression analysis suggests overlapping and specific roles of rice glutathione S-transferase genes during development and stress responses [J].BMC Genom,2010,11(1):11-17.
[6] GAO Caiqiu,YANG Guiyan,GUO Yucong,et al.Overexpression ofThGSTZ1 fromTamarix hispidaimproves tolerance to exogenous ABA and methyl viologen [J].Trees,2016,30(6):1935-1944.
[7] YANG Guiyan,WANG Yucheng,XIA Dean,et al.Overexpression of aGSTgene (ThGSTZ1) fromTamarix hispidaimproves drought and salinity tolerance by enhancing the ability to scavenge reactive oxygen species [J].Plant Cell Tissue Organ Cult,2014,117(1):99-112.
[8] YANG Guiyan,XU Zhenggang,PENG Shaobing,et al.In planta characterization of a tau class glutathione S-transferase gene fromJuglans regia(JrGSTTau1) involved in chilling tolerance [J].Plant Cell Rep,2016,35(3):681-92.
[9] VIJAYAKUMAR H,THAMILARASAN S K,SHANMUGAM A,et al.Glutathione transferases superfamily:cold-inducible expression of distinctGSTgenes inBrassica oleracea[J].Int J Mol Sci,2016,17(8):1211.doi:10.3390/ijms.17081211.
[10] KUMAR S,ASIF M H,CHAKRABARTY D,et al.Expression of a rice Lambda class of glutathione S-transferase,OsGSTL2,inArabidopsisprovides tolerance to heavy metal and other abiotic stresses [J].J Hazardous Mater,2013,248/249:228-237.
[11] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod [J].Methods,2001,25(4):402-408.
[12] MOONS A.Osgstu3 andosgtu4,encoding tau class glutathione-S-transferases,are heavy metal-and hypoxic stress-induced and differentially salt stress-responsive in rice roots [J].FEBS Lett,2003,553(3):427-432.
[13] SKOPELITOU K,MULETA A W,PAPAGEORGIOU A C,et al.Characterization and functional analysis of a recombinant tau class glutathione transferaseGmGSTU2-2 fromGlycine max[J].Int J Biol Macromol,2016,94(B):802-812.
[14] MUSDAL Y,MANNERVIK B.Substrate specificities of two tau class glutathione transferases inducible by 2,4,6-trinitrotoluene in poplar [J].Biochem Biophys Acta,2015,1850(9):1877-1883.
[15] 郭晋艳,郑晓瑜,邹翠霞,等.植物非生物胁迫诱导启动子顺式元件及转录因子研究进展[J].生物技术通报, 2011,23(4):16-20.GUO Jinyan,ZHENG Xiaoyu,ZOU Cuixia,et al.Research progress ofcis-elements of abiotic stress inducible promoters and associated transcription factors [J].Biotechnol Bull,2011,23(4):16-20.
[16] TIWARI V,PATEL M K,CHATURVEDI A K,et al.Functional characterization of the tau class glutathione-S-transferases gene (SbGSTU) promoter of salicornia brachiata under salinity and osmotic stress [J].PLoS One,2016.11(2):e0148494.doi:10.1371/journal.pone.0148494.
[17] 赵晋锋,余爱丽,王寒玉,等.非生物逆境胁迫下ZmCIPK10基因表达分析[J].生物技术进展,2011,1(2):130-134.ZHAO Jinfeng,YU Aili,WANG Hanyu,et al.Expressional analysis ofZmCIPK10 under abiotic stresses [J].Curr Biotechnol,2011,1(2):130-134.
[18] 刘彦丹,英生,张登峰,等.玉米逆境胁迫响应基因ZmbZIP71的克隆与表达分析[J].植物遗传资源学报,2011,12(5):775-781.LIU Yandan,YING Sheng,ZHANG Dengfeng,et al.Isolation and expression analysis of a stress-responsive geneZmbZIP71 in maize (Zea maysL.) [J].J Plant Genet Resour,2011,12(5):775-781.
[19] WANG Zhou,HUANG Suzhen,JIA Caihong,et al.Molecular cloning and expression of five glutathione S-transferase(GST) genes from banana (Musa acuminataL.AAA group,cv.Cavendish) [J].Plant Cell Rep,2013,32(9):1373-1380.
[20] CSISZÁR J,HORVÁTH E,VÁRY Z,et al.Glutathione transferase supergene family in tomato:salt stress-regulated expression of representative genes from distinct GST classes in plants primed with salicylic acid [J].Plant Physiol Biochem,2014,78(3):15-26.
