酶解法制备牦牛骨胶原多肽及其加工性能评价
2018-08-20胡迤萧周恒量刘爱平彭露露
刘 静,李 诚,胡迤萧,杜 昕, 周恒量,刘爱平,辜 雨, 彭露露
(四川农业大学 食品学院,四川 雅安 625014)
牦牛是我国特有的家畜之一,约1 400余万头,占世界总量的90%以上[1]。作为青藏高原高寒地区藏牧民不可缺少的生产生活资料[2],具有不可替代的生态和经济地位[3]。牦牛肉是公认的“绿色食品”,已被广泛开发利用,其加工副产物牦牛骨主要用于加工牦牛壮骨粉[4]、牦牛骨汤[5-6]等,未被深入研究。近年来,骨胶原多肽因其丰富的营养价值和生理功能成为当前研究的热点,国内外对于骨骼酶解的报道较多,集中在猪骨[7-8]、牛骨[9]、鱼骨[10]等,酶解牦牛骨胶原蛋白的研究鲜见报道。大量研究表明:酶解动物骨蛋白得到的胶原多肽具有生物活性功能,如降血压活性、抗肿瘤活性、抗氧化活性、预防与治疗骨关节炎和骨质疏松活性等,且大多的活性肽都是以相对分子质量低于5 000的小分子肽存在,多肽具有良好的食品加工特性,而且有比氨基酸和蛋白质更好的营养、吸收特性[11-14]。李帆等[15]以水解度为指标,探索木瓜蛋白酶水解牦牛骨的最佳条件,但水解度过高,蛋白质可能被彻底水解成氨基酸从而丧失多肽的功能。因此,本实验与现有的青海牦牛骨肽产品[16-17]生产工艺相比较,以四川九龙牦牛骨为原料,考察了不同种类的蛋白酶对酶解效果的影响,首次将可溶性多肽得率作为评价指标,弥补了单纯提高水解度的不足;用响应面分析方法优化制备牦牛骨小分子多肽得率最高的工艺条件,较大的缩短了酶解时间,并研究了酶解产物的加工功能特性,以期为进一步利用牦牛骨胶原多肽开发功能性产品以及探索牦牛骨多肽的生物活性提供实验依据。
1 材料与方法
1.1 试验材料
四川九龙牦牛骨粉(200目):四川大渡河食品有限公司产品;胃蛋白酶、中性蛋白酶、碱性蛋白酶、胰蛋白酶、木瓜蛋白酶:上海瑞永生物科技有限公司产品;福林酚法蛋白检测试剂盒:南京凯基生物科技发展有限公司产品;其他试剂均为国产分析纯。
1.2 仪器与设备
恒温数显水浴锅:江苏金城国胜实验仪器厂制造;PHS-3C型酸度计:四川优普科技有限公司产品;D-37520型冷冻离心机、Scientz-12型冷冻干燥机:美国Thermo Fisher公司产品;QT-2型漩涡混合器:上海琪特分析仪器有限公司产品;UV-3200紫外分光光度计:上海美普达仪器有限公司产品。
1.3 试验方法
1.3.1 牦牛骨蛋白的酶解工艺 称取适量牦牛骨粉→按比例加水混合均匀→121℃条件下处理30 min,冷却、调节pH→加酶水浴酶解→100℃灭酶10 min→10 000 r/min离心10 min→上清液过滤→牦牛骨蛋白酶解液→测定其可溶性多肽含量及水解度→冷冻干燥→牦牛骨多肽粉→加工特性测定。
1.3.2 最适蛋白酶种筛选试验 分别选用胰蛋白酶、碱性蛋白酶、中性蛋白酶、木瓜蛋白酶和胃蛋白酶对骨粉进行水解,以可溶性多肽得率为指标,筛选出水解度和可溶性多肽得率最高的酶。各酶的反应条件见表1。
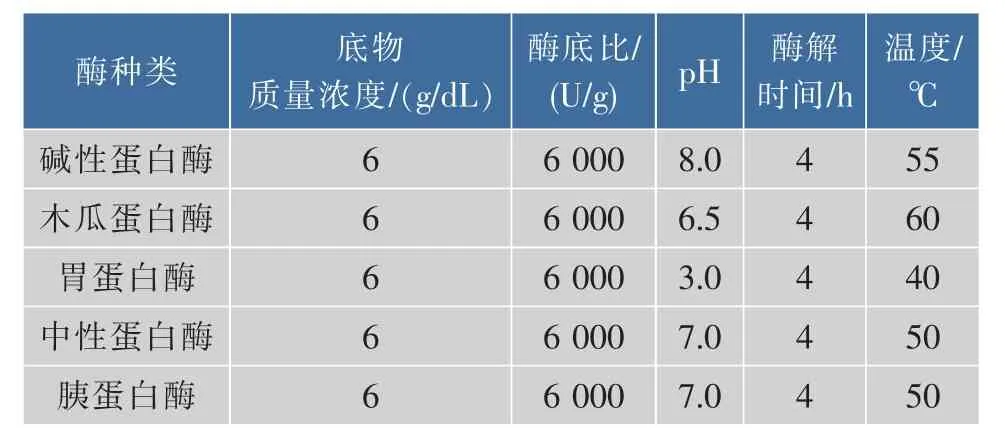
表1 各蛋白酶反应条件Table 1 Reaction conditions of different enzymes
1.3.3 最优酶酶解单因素试验 将牦牛骨粉样品按比例加入蒸馏水,分别在酶底比为2 000∶1、4 000∶1、6 000∶1、8 000∶1、10 000∶1、12 000∶1 (U/g),底物质量浓度 1、2、3、4、5、6、7 g/dL,酶解时间 3、4、5、6、7 h,酶解温度 40、45、50、55、60 ℃,pH 7.5、8.0、8.5、9.0、9.5、10的条件下进行酶解单因素试验,以多肽得率为主要指标,结合水解度筛选出最佳的酶解条件。
1.3.4 最优酶酶解响应面试验 在单因素实验基础上,选取底物质量浓度、酶底比、pH、酶解时间4因素,以多肽得率作为响应值,采用Design expert 8.0.6Box-Behnken进行实验设计和结果分析,探索制备可溶性多肽的最佳工艺。响应面设计如表2所示。

表2 响应面试验因素设计表Table 2 Factors and levels of RSM experiment
1.3.5 酶解产物加工特性测定 对牦牛骨酶解产物的稳定性、溶解性、起泡性及泡沫稳定性、乳化性及乳化稳定性进行测定。
1.3.6 指标测定
1)酶活的测定:SB/T 10317-1999[18]
2)水解度的测定:中性甲醛滴定法[19]
吸取5 mL待测酶解液于250 mL烧杯中,加入60 mL蒸馏水,用磁力搅拌器搅拌并滴加0.05 mol/L NaOH标准溶液至溶液pH显示8.2立刻加入5 mL甲醛,再边搅拌边滴加0.05 mol/L NaOH标准溶液至溶液pH变为9.2,记录加入甲醛后消耗的NaOH标准溶液的体积V(mL)。

式中:N0为总氮质量浓度 (g/dL);N1为酶解前游离氨基氮质量浓度(g/dL);N2为酶解后游离氨基氮质量浓度(g/dL)。
3)可溶性多肽得率测定:使用福林酚法蛋白含量检测试剂盒,根据鲁伟[20]的方法略作修改。
样品的处理:取一定体积的酶解液于离心管中,加入等体积的10 g/dL三氯乙酸(TCA)水溶液,混匀,静置 10 min,4 000 r/min下离心 15 min,取上清液备用。标准蛋白质溶液、碱性铜试剂工作液按试剂盒说明书配置。标准曲线的制作:取6支带盖1.5 mL离心管,按表3顺序加入试剂。

表3 标准曲线制作表Table 3 Steps of making standard curve
加入福林酚试剂混匀后于20~25℃放置30 min在750 nm下比色,以蛋白质质量为横坐标,吸光值为纵坐标绘制标准曲线。
4)样品多肽质量的测定:取20 μL样品溶液,按表3方法测出其吸光度值,通过标准曲线计算出样品中多肽的质量。
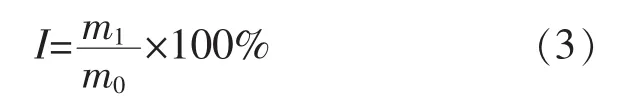

其中,M为氮溶指数;M1为滤液中的含氮质量分数;M2为样品总含氮质量分数。
6)稳定性:参考赵玉红[22]的方法,将20 mg样品溶于10 mL 0.1 mol/L NaCl溶液中,调解pH 7。于121℃高压蒸汽灭菌20 min后测含氮质量分数。

其中,I为可溶性的肽得率;m1为上清液中的肽质量;m0为总蛋白质质量。
5)溶解性:参考 Giménez B[21]的方法,将 20 mg样品溶于10 mL 0.1 mol/L NaCl溶液中,调解pH 7,于30℃恒温摇床放置60 min,过滤,用少量蒸馏水洗残渣。氮质量分数用凯氏定氮仪进行分析。氮溶指数表示溶解性。
其中,W为稳定性,%;W1为处理后的氮质量分数;W0为处理前的氮质量分数。
7)起泡性及起泡稳定性:参考曾庆祝[23]的方法,取5 mL 20 mg/mL样品溶液于100 mL离心管中,20 000 r/min匀浆90 s后记泡沫体积V1;室温放置30 min记泡沫体积V2。
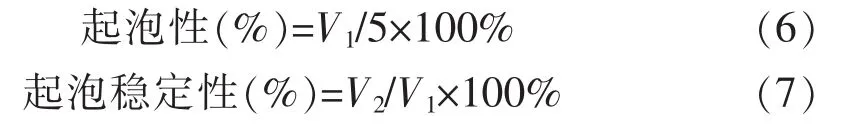
8)乳化性及乳化稳定性:参考于泓鹏[24]的方法,取20 mL 60 mg/mL样品溶液调 pH 7.0,加入20 mL精制大豆油混合后8 000 r/min均质2 min,等量分成2份分别倒进离心管和试管中。将离心管中的乳浊液在1 500 g下离心5 min,记录离心后乳化层体积V1和总体积V0。试管中的乳浊液于80℃保温15 min,取出冷却至室温后1 500 g离心5 min记录乳化层体积V2。
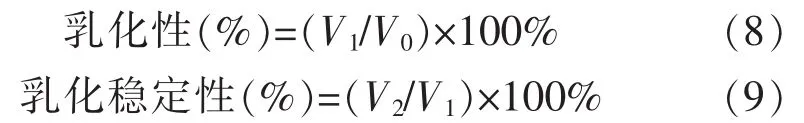
1.3.7 数据处理 试验数据为3组数据平均值,采用Excel 2007和Design Expert 8.0进行数据处理和分析。
2 结果与分析
2.1 酶筛选试验
不同蛋白酶对牦牛骨的酶解效果见图1。由图1可知胃蛋白酶的水解度最高,依次是胰蛋白酶、中性蛋白酶、碱性蛋白酶,木瓜蛋白酶最低。水解度高的原因可能是酸性环境有利于钙的溶出,使水解加深,也加大羟基磷灰石与溶液的接触面积从而增加钙的溶出造成双向促进[22]。但是胃蛋白酶解液中可溶性多肽的得率不高,可能是水解较为彻底,溶液中氨基酸得率较高而多肽得率并不高。碱性蛋白酶、胰蛋白酶和中性蛋白酶的可溶性多肽得率都较高,其中碱性蛋白酶最高,为18.13%。碱性蛋白酶酶活高,商业成本低,并且能够得到尽可能多的可溶性多肽,综合考虑,试验选取碱性蛋白酶作为试验最适酶制剂。

图1 各蛋白酶水解效果比较Fig.1 Hydrolysis effects of different kinds of enzymes
2.2 最适酶单因素试验
2.2.1 底物质量浓度对酶解效果的影响 在酶底比6 000 U/g,酶解温度55℃,酶解pH 8.5的条件下酶解5 h,考察底物对酶解效果的影响,结果如图2所示,酶解液水解度随酶底比的增加呈上升趋势,在3%以后上升较缓,5%时达到最大值后随底物质量浓度增大水解度减小。多肽得率随底物质量浓度的增加呈减小趋势,在4%后逐渐趋于平衡。底物质量浓度呈一定比例增加,溶液中的可溶性多肽质量分数增多,但其增加的比例小于底物增加的比例,这可能是导致得率逐渐减少的主要原因,而底物质量浓度过低降低试验效率,增加成本,综合考虑,底物质量浓度范围选取3~5 g/dL。
2.2.2 酶底比对酶解效果的影响 在底物质量浓度6 g/dL,酶解温度55℃,酶解pH 8.5的条件下酶解5 h,考察酶底比对酶解效果的影响,结果如图3所示,水解度和多肽得率都随酶底比增加呈先增大后减小的趋势,水解度在6 000 U/g时达到最大为29.94%,多肽得率在4 000 U/g处达到最大值15.26%后缓慢下降。反应初始阶段,增加酶的质量分数,使酶和底物充分反应,水解度和可溶性多肽得率增大,而当酶增加到与底物反应达到饱和时,再增大加酶量并不会促进蛋白的水解,造成酶的浪费,因此,酶底比范围选取4 000~8 000 U/g较为合适。
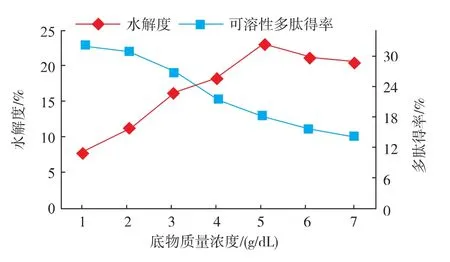
图2 底物质量浓度对酶解效果的影响Fig.2 Influence of substrate content on hydrolysis
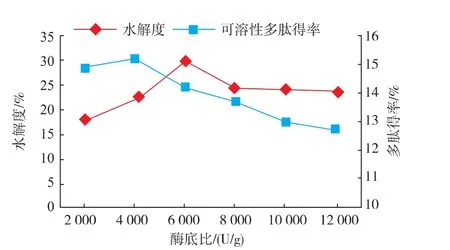
图3 酶底比对酶解效果的影响Fig.3 Influence of enzyme/substrate on hydrolysis
2.2.3 酶解时间对酶解效果的影响 在底物质量浓度6 g/dL,温度55℃,pH 8.5,酶底比6 000 U/g的条件下考察酶解时间对酶解效果的影响,结果如图4所示,在3 h时,两者已经处于较大值,后随时间的增加,二者都先上升后逐渐趋于平衡,最后水解度稳定在26%左右,可溶性多肽得率在4 h时达到最大14.37%。在酶解的初始阶段,酶解反应剧烈,水解度增大,可溶性多肽得率也增大,随着水解的进行,当蛋白质水解为多肽的速度小于多肽水解为氨基酸的速度时,多肽得率就会缓慢下降,最后当酶促反应达到动态平衡水解度和多肽含量也趋于平衡。所以,酶解时间选取3~5 h。
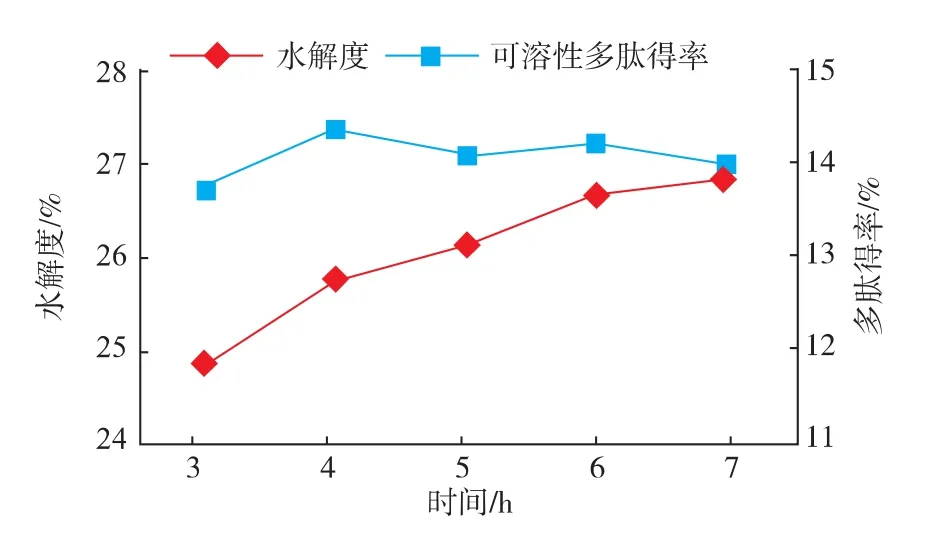
图4 酶解时间对酶解效果的影响Fig.4 Influence of time on hydrolysis
2.2.4 酶解pH对酶解效果的影响 在底物质量浓度6 g/dL,酶解温度55℃,酶底比6 000 U/g的条件下酶解5 h,考察酶解pH对酶解效果的影响结果如图5所示,水解度和多肽得率随pH的增大变化不明显,最高值分别为24.36%和13.61%。环境pH会影响酶分子的构象和酶及底物的解离状态,酶活性部位只有在酶蛋白保持一定的空间构象时才能体现出最大的催化功能,以此影响酶活性和酶促反应速度,从结果看来碱性蛋白酶在试验pH环境下均能较好的催化水解反应,而过高的pH对设备存在一定的腐蚀性也会引入较多的杂离子,所以pH范围考虑 7~9。
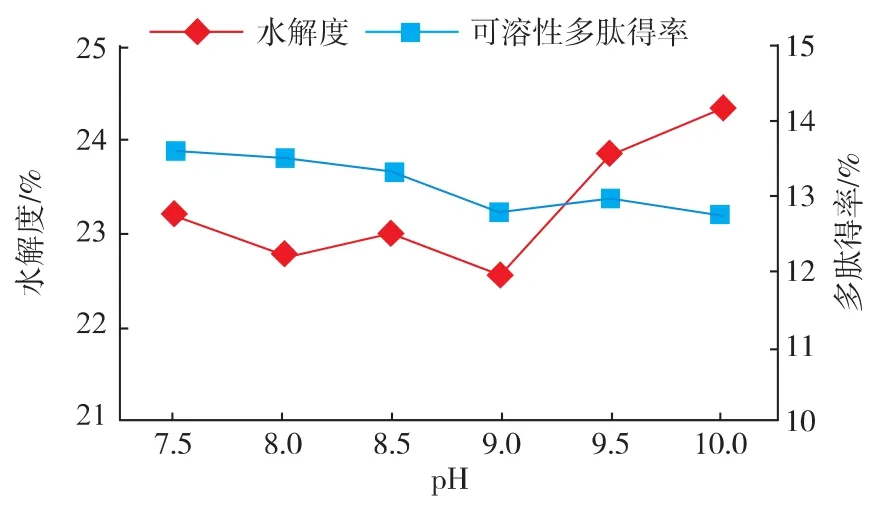
图5 酶解pH对酶解效果的影响Fig.5 Influence of pH on hydrolysis
2.2.5 酶解温度对酶解效果的影响 在底物质量浓度6 g/dL,酶解pH 8.5,酶底比6 000 U/g的条件下酶解5 h,考察酶解温度对酶解效果的影响结果如图6所示水解度在50℃、多肽得率在45℃时达到最大值,分别为26.38%、16.62%。二者随温度升高变化不明显,不同水浴环境下并不能完全控制温度的差异值,考虑到实验环境的具体影响,选取酶解温度为50℃。
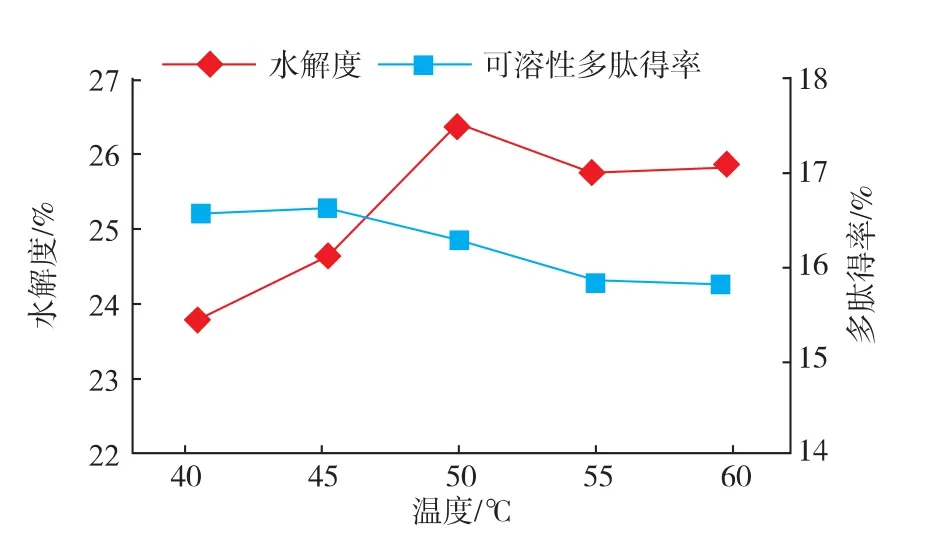
图6 酶解温度对酶解效果的影响Fig.6 Influence of temperature on hydrolysis
从以上结果可以看出,底物质量浓度对水解度和多肽得率的影响是显著的,其次是酶底比和酶解时间,酶解温度与pH最不明显,而当水解度处于最大值时,多肽得率并非最高,二者不呈明显的线性关系。水解度越高,水解越彻底,蛋白质水解得到的多肽可能被进一步水解为氨基酸,导致得率降低,所以在响应面优化试验时选取多肽得率为主要指标进行评价。
2.3 最适酶响应面优化试验
2.3.1 响应面模型建立与方差分析 采用Design Expert 8.0软件按照表2的编码水平共设计29组试验,结果见表4。
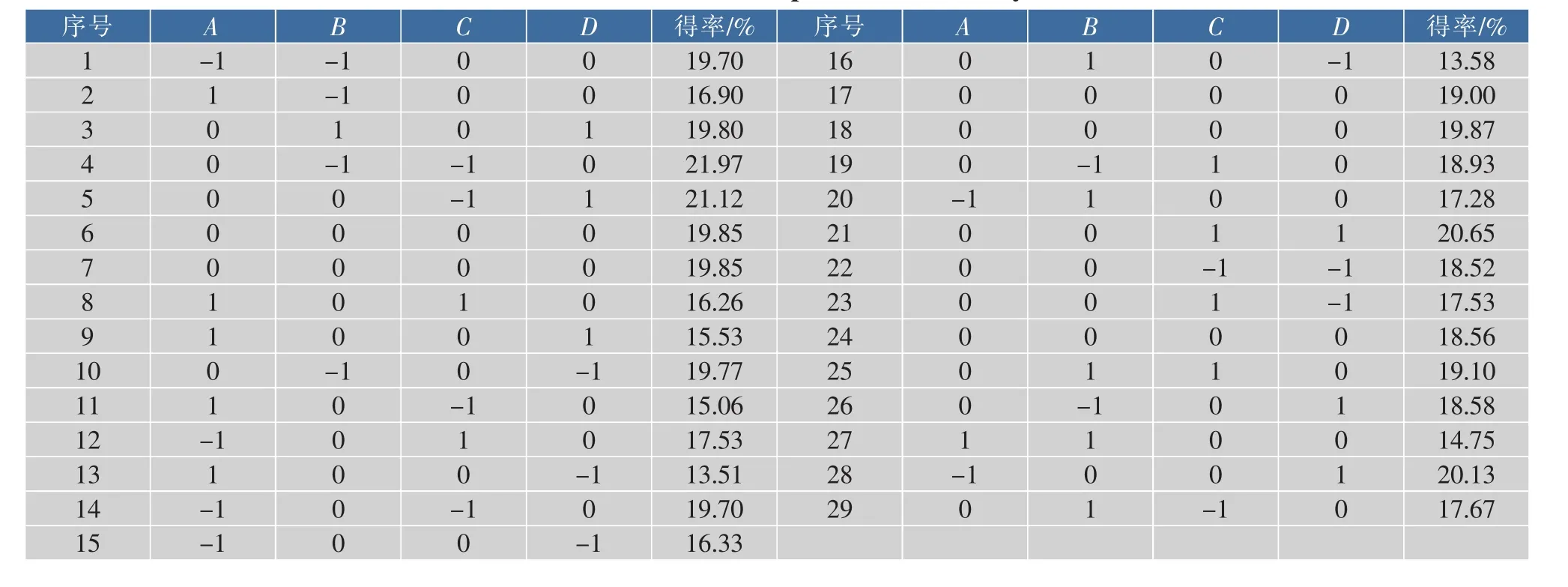
表4 响应面设计方案及试验结果Table 4 Results for response surface analysis
采用Design Expert 8.0软件对表4所示的数据进行多元回归拟合和显著性检验,结果见表5。以多肽得率为Y值,得到回归方程Y=19.43-1.56A-1.14B-0.34C+1.38D+0.07AB+0.84AC-0.45AD+1.12BC+1.85BD+0.13CD-2.29A2-0.37B2+0.38C2-0.74D2。对回归方程进行失拟性检验得F=0.86,P=0.616 5>P=0.05差异不显著。对回其进行显著性检验,F=27.95,P<0.000 1,极显著。 相关系数 R2=0.965 5,R2adj=0.930 9说明回归方程与实际情况拟合较好,使用该模型进行分析是可靠的。从表5还可以看出, 模型中,A、B、D、AC、BC、BD、A2、D2对得率影响显著,其中 A(底物质量浓度)、B(酶底比)、D(酶解时间)、BD(酶底比和酶解时间的交互作用)极显著。各因素影响顺序为:底物质量浓度>酶解时间>酶底比>pH。
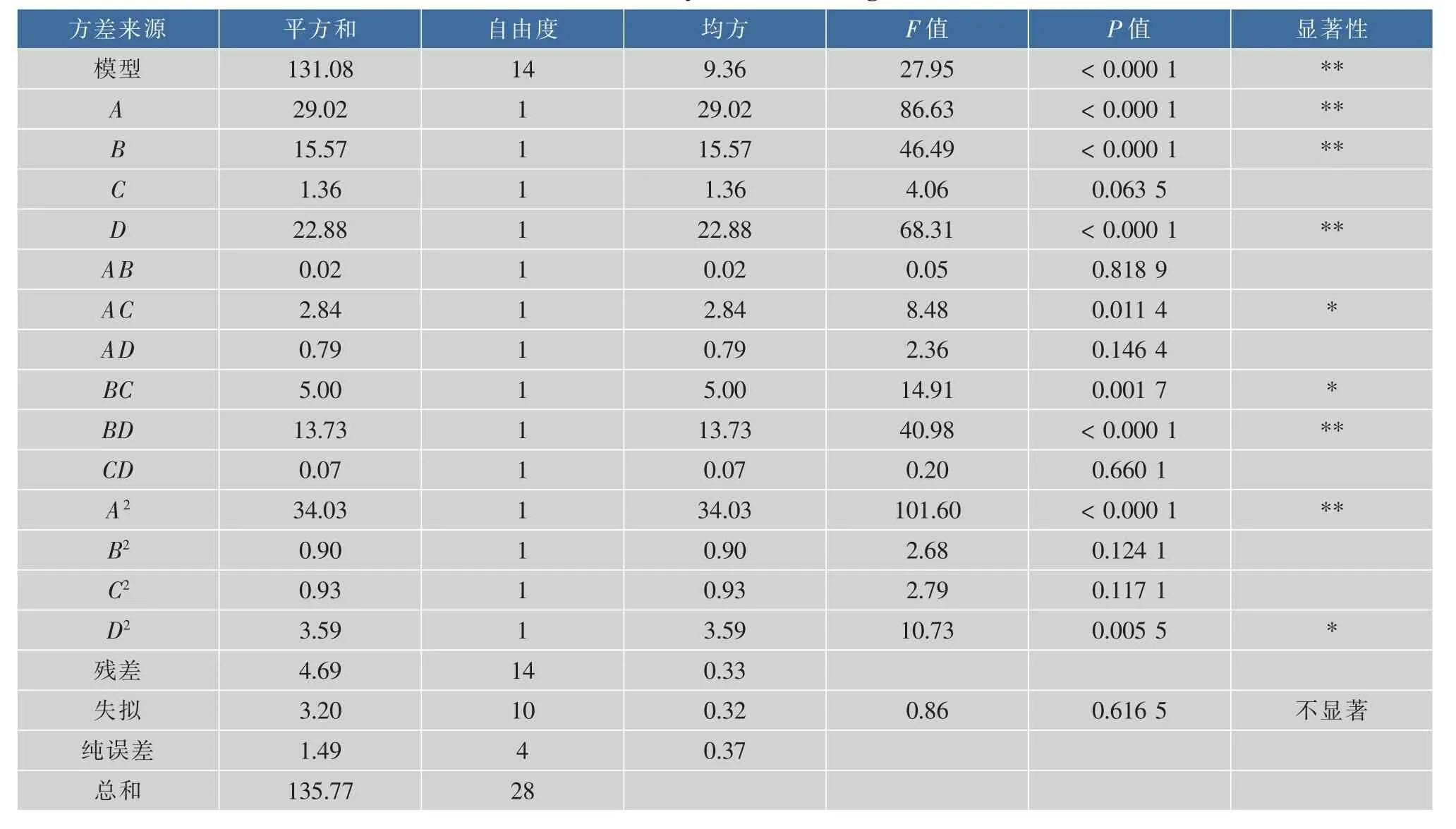
表5 试验结果及方差分析Table 5 Variance analysis for fitted regression model
2.3.2 因素间交互影响 从表5可看出AC、BC、BD之间的交互作用对多肽得率的影响是显著的,由方程模型所做的响应面曲面图见图7~9。如图7~9所示,响应值对底物质量浓度的变化最敏感,表现为曲面较陡,其次是酶解时间和酶底比的相互影响,随两者的增大,底物和酶接触得更充分,水解更彻底,生成的肽被进一步水解可能是多肽得率减小的主要原因。响应值对酶底比和pH的相互作用变化较不明显,与表5的结果一致。
2.3.3 响应面模型验证试验 由回归方程预测得到最佳酶解条件是底物质量浓度3.49 g/dL,酶底比4 000 U/g,pH 7.0,酶解时间 3.75 h,此时多肽得率为22.74%,为方便验证,将参数修正为底物质量浓度 3.5 g/dL,酶底比 4 000 U/g,pH 7.0,酶解时间4 h,此条件下制备的牦牛骨多肽得率为22.06%,接近于理论值,回归方程可用于实践。
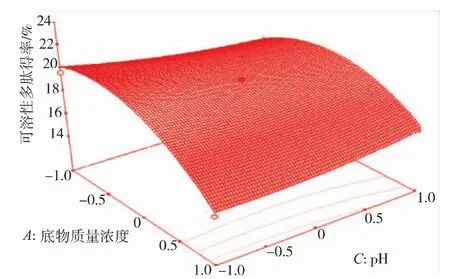
图7 底物质量浓度与pH交互影响多肽得率的响应曲面图Fig.7 Effects of substrate content,pH on polypeptide yield
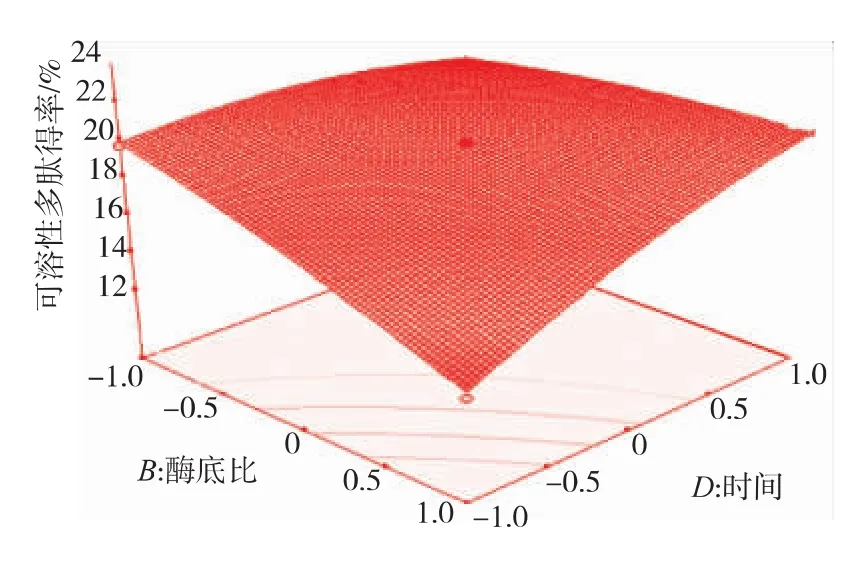
图8 时间与酶底比交互影响多肽得率的响应曲面图Fig.8 Effects of timeand enzyme/substrate on polypeptide yield
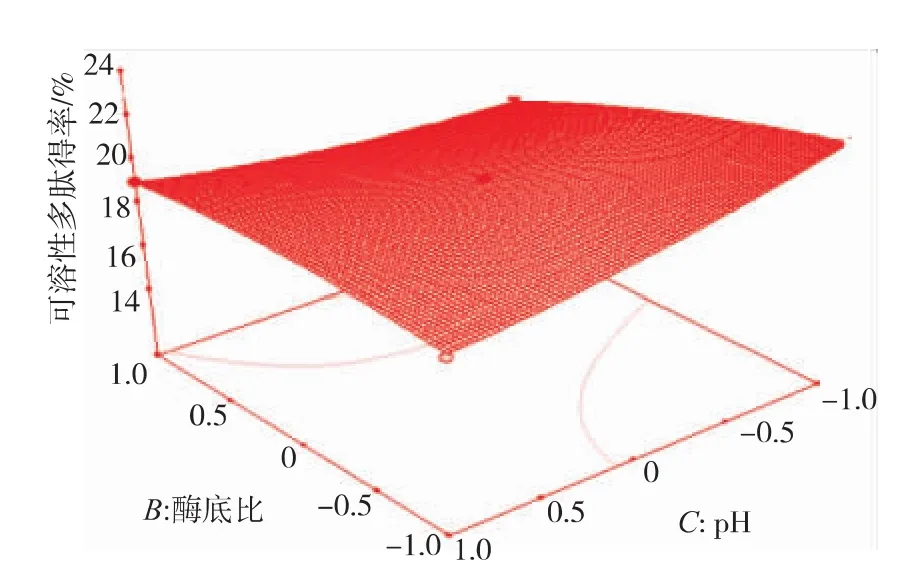
图9 pH与酶底比交互影响多肽得率的响应曲面图Fig.9 Effects of pH and enzyme/substrate on polypeptide yield
2.4 酶解产物加工功能特性测定
牦牛骨酶解产物的加工功能特性测定结果见表6。
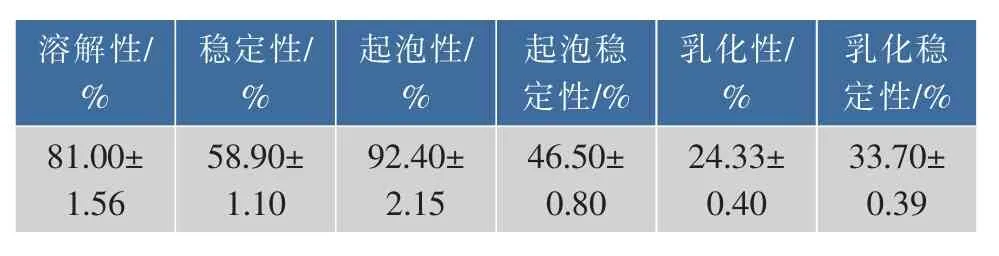
表6 牦牛骨酶解产物加工功能特性Table 6 Processing functional properties of Yak hy drolysates
从表6可以看出,牦牛骨的酶解产物具有良好的溶解性、稳定性和起泡性,但是起泡稳定性较差,静置30 min后的泡沫体积明显减少,乳化性和乳化稳定性一般,乳化性与肽链长短有关,为了提高多肽的得率,试验所制备的酶解液的肽链较短,而要获得良好的乳化性则需要120个氨基酸残基[25],推测是乳化性一般的主要原因。结果与Li&Fan[26]略有差异,可能与酶解原料和产物纯度有关。
3 结 语
碱性蛋白酶、胃蛋白酶、木瓜蛋白酶、胰蛋白酶和中性蛋白酶等不同酶种对酶解液多肽得率和水解度的影响表明试验最适用酶为碱性蛋白酶。单因素实验考察了底物质量浓度、酶底比、酶解时间、pH、酶解温度这5个因素对酶解液水解度和多肽得率的影响,结合Box-Behnken模型响应面法优化牦牛骨多肽制备工艺,得到最佳酶解条件为底物质量浓度 3.5 g/dL,酶底比 4 000 U/g,pH 7.0,酶解时间4 h,此时多肽得率为22.06%。对酶解液加工功能测定,表明其溶解性、稳定性、起泡性良好,分别是81%、58.9%、92.4%,乳化性和乳化稳定性分别为24.33%、33.7%,为牦牛骨多肽在食品加工中的应用提供了实验依据。
