毕赤酵母展示稻米脂肪酶催化乙酸乙酯研究
2018-08-20郑瑞娜
焦 玲,谢 定,文 李,姜 博,陈 平,郑瑞娜
(长沙理工大学 化学与生物工程学院,长沙 湖南410114)
乙酸乙酯又名醋酸乙酯,英文名Ethyl Acetate,具有水果香味,外观为无色透明液体。乙酸乙酯是一种非常重要的有机化工原料,同时,还是酿酒行业常用的调香物质,存在于所有的白酒之中[1,3]。目前在我国乙酸乙酯的生产基本上都是通过传统方式在无机催化剂存在条件下化学合成,国际上也有少量从天然植物中分离提取方法来获得[2]。而和化学合成法相比,酶法生物合成的乙酸乙酯不仅被认为是高质量的天然产品,而且具有反应条件温和、转化率高、专一性好、易提取、易控制等优点,被看成是很有希望工业化的新途径[3]。稻米脂肪酶是一类具有高活性的可以催化多种物质的生物催化剂,利用酵母展示技术,本实验室在人工合成酵母菌壁蛋白 (GCW14)与稻米脂肪酶 (RL)组合基因(GCW14-RL)后,将其亚克隆到pPIC9k载体后转化到GS115酵母菌中,成功构建了pPIC9k-GCW14-Rlipase载体,并将RL展示在毕赤酵母GS115表面[4-5],再将其进行应用。
本文作者将高密度发酵得到的毕赤酵母发酵液通过冷冻离心制得酵母全细胞[5],再将其用于催化,确定了反应最佳的稻米脂肪酶的酶活、底物摩尔比、反应温度、反应时间和3A分子筛添加量等,以及采用不同来源的脂肪酶对催化合成乙酸乙酯的影响。
1 材料与方法
1.1 主要材料与仪器
化学试剂:乙酸正戊酯(色谱纯):TCI(上海)化成工业发展有限公司产品;乙酸乙酯(色谱纯):天津市化学试剂研究所提供。正己烷(分析纯)、无水乙醇(分析纯)、乙酸(分析纯):国药集团化学试剂有限公司产品;展示稻米脂肪酶的毕赤酵母全细胞催化剂为本实验室自制[4]。
仪器:GC-14C型气相色谱仪(配氢火焰离子化检测器(FID)、N2000色谱工作站):日本岛津公司产品;色谱柱 (SUPELCOWAX-10 30 m×0.32 mm×0.25 μm):中国科学院兰州化学物理研究所提供;DT5-1型低速台式离心机:北京时代北利离心机有限公司产品;XMTD-4000电热恒温水浴锅:北京永光明医疗仪器厂制造。
1.2 实验方法
1.2.1 稻米脂肪酶酶活测定 采用对硝基苯酚法[6]。酶活力测定反应体系总体积为10 mL,包括1 mL p-NPP底物溶液(50 mmol/L)以及8 mL 50 mmol/L Tris-HCl(pH 8.0)及1 mL菌悬液;反应体系混匀后在加热振荡器中35℃,800 r/min预热5 min后,加入酶液进行反应,10 min后立即沸水浴加热终止反应,12 000 r/min离心终10 min取上清液在405 nm

式(1)中,X为脂肪酶活力,U/mL;c为脂肪酶浓度,μmol/mL;V 为脂肪酸溶液的体积,mL;V′为酶液的用量,mL;t为作用时间,min。
一个脂肪酶水解活力单位(U)定义为:在当前反应条件下,1分子酶每分钟催化水解底物p-NPP生成 1 μmolp-NP所需的酶量。
1.2.2 乙酸乙酯的合成 稻米脂肪酶催化乙酸乙酯的酯合成反应过程为,在150 mL的具塞三角瓶中,加入3.4 mL乙酸、2.9 mL无水乙醇和15 mL正己烷组成非水相酯化反应体系,在30℃的温度下预热摇匀,30 min后加入酶活为6 300 U/g的稻米脂肪酶和1.2 g的3A分子筛以移走产物中的水分。在35℃、转速为150 r/min的恒温摇床上振荡反应,定时取样经GC分析检测并测定该酶催化酯化合成反应体系中乙酸的转化率。
1.2.3 反应转化率的测定 将乙酸乙酯和底物测得的峰面积带入标准曲线拟合的线性方程,算出在反应体系中的各个物质的摩尔浓度。处测定吸光度A405值。酶活力计算公式如下:

式(2)中,R为转化率;M0为乙酸乙酯摩尔浓度;M1为生成的乙酸乙脂的摩尔浓度;M2为反应后乙酸剩余的摩尔浓度。
1.2.4 GC色谱分析 N2000色谱工作站。采用程序升温:起始柱温55℃,恒温1 min,以2℃/min升温至80℃,恒温2 min,再以20℃/min升温至180℃,保持5 min;进样口温度:200℃;采用氢焰离子化检测器 (flame ionizationdetector,FID), 检测器温度:220 ℃;进样方式:分流进样,分流体积比:10∶1;进样量:1 μL;载气:氢气;流量:60 KPa;空气流量:50 KPa。乙酸正戊酯为内标,内标法测定酯的含量,每个样品重复测定3次。
2 结果与讨论
2.1 稻米脂肪酶的酶活对合成乙酸乙酯的影响
按1.2.2的方法构成稻米脂肪酶催化合成乙酸乙酯的反应体系,当反应温度为35℃、反应时间为6 h,分别取酶活为 6 300、7 8750、10 500、15 750 U/g和31 500 U/g的稻米脂肪酶进行酶促酯合成反应,乙酸转化率随稻米脂肪酶的酶活的变化如图1所示。
结果表明,稻米脂肪酶合成乙酸乙酯的反应速度随着酶活的增加而加快,当稻米脂肪酶酶活从6 300 U/g增加到15 750 U/g时,反应速率逐渐增大,乙酸转化率从63.95%上升到87.94%,当稻米脂肪酶酶活达到15 750 U/g时,反应速度达到最大,当稻米脂肪酶酶活从15 750 U/g增加到31 500 U/g时,其反应速率变化很小。若再增加稻米脂肪酶的酶活使得脂肪酶相对底物是过量的,而酶相对于底物过量时,所有的底物都已经与脂肪酶活性中心结合,使得过量的酶对于反应没有贡献,出于反应转化率和工业化成本的考虑,因此,在所选底物浓度范围内,选择稻米脂肪酶酶活为15 750 U/g最为合适。
2.2 酸醇摩尔比对合成乙酸乙酯的影响
由于乙酸和乙醇都是具有较强极性的有机化合物,通过控制乙酸和乙醇在反应体系中的摩尔比,不仅可以改变反应速率,缩短反应所需时间,还可以有效的促进反应向生成乙酸乙酯的方向进行。因此,本作者通过对几种不同的酸醇摩尔比进行比较,以确定反应最佳的酸醇摩尔比。在15 mL正己烷中固定加入2.9 mL乙醇、酶活为15 750 U/g稻米脂肪酶、1.2 g 3A分子筛,通过改变反应体系中的乙酸量来调节酸醇的摩尔比,结果如图2所示。
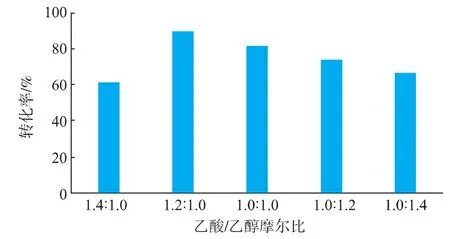
图2 酸醇摩尔比对合成乙酸乙酯的影响Fig.2 Effect of the molar ratio of acetic acid toethanol on the synthesis of ethyl acetate
对比这5组实验结果可以看出,在酸醇摩尔比为1.2∶1.0时,其乙酸转化率达最大值,其转化率高达89.43%,在酸醇摩尔比为1.4∶1.0时的乙酸转化率在5组实验中是最慢的,这表明乙酸的浓度过高,对脂肪酶的合成活性产生了负面影响,导致转化率偏低。 在酸醇摩尔比为 1∶1、1∶1.2、1∶1.4 这 3 组实验中,乙酸转化率与之相比逐渐的下降,这是因为反应体系中底物浓度过低,降低了酶与底物接触并催化其发生反应的概率,从而无法充分发挥其催化活性。因此,选取1.2∶1的酸醇摩尔比定为最适稻米脂肪酶催化合成乙酸乙酯的实验条件。
2.3 温度对合成乙酸乙酯的影响
按1.2.2的方法构成稻米脂肪酶催化合成乙酸乙酯的反应体系,每瓶加入稻米脂肪酶的酶活量为15 750 U/g、3A分子筛1.2 g,当反应温度分别为25、30、35、40 ℃和 45 ℃时,乙酸转化率随时间的变化如图3所示。

图3 温度对合成乙酸乙酯的影响Fig.3 Effect of temparature on the synthesis of ethyl acetate
结果表明,温度对稻米脂肪酶催化反应速度有很大的影响。随着反应温度的升高,乙酸转化率有所提高,当反应温度为40℃时,乙酸转化率达到最大值,然而当温度提高到45℃时,乙酸转化率有明显下降。这是因为高温可以提高反应初速度,因此在反应初始阶段温度越高,乙酸的转化率越高,然而提高温度同样也会加快酶失活,使得反应速率迅速下降。因此,从降低能量消耗的角度考虑,选取40℃作为最优反应温度。
2.4 反应时间的影响
按1.2.2的方法构成稻米脂肪酶催化合成乙酸乙酯的反应体系,每瓶加入稻米脂肪酶的酶活量为15 750 U/g、3A分子筛1.2 g,当脂肪酶反应温度为40℃时,反应时间对乙酸转化率的影响如图4所示。

图4 反应时间对合成乙酸乙酯的影响Fig.4 Effect of time on the synthesis of ethyl acetate
从图4看出,在加入稻米脂肪酶后0~4 h内,乙酸转化率随时间变化呈直线上升,随着时间的推移,上升趋势渐缓,当到达4 h以后,乙酸转化率已基本稳定。由于反应产物的累加,一般情况下,反应时间越长,产物越多。但考虑到时间成本,经济成本,当反应进行4 h后,乙酸转化率已达到89.93%,与最终趋于稳定的转化率相差不大。因此,选取反应时间为4 h较为合适。
2.5 3A分子筛添加质量的影响
按1.2.2的方法构成稻米脂肪酶催化合成乙酸乙酯的反应体系,在反应温度为35℃、稻米脂肪酶的酶活为15 750 U/g时,3A分子筛对乙酸转化率的影响如图5所示。

图5 3A分子筛的添加质量对合成乙酸乙酯的影响Fig.5 Effect of 3A molecular sieve on the synthesis of ethyl acetate
从上图可以看出,在分别加入3A分子筛0.4、0.6、0.8、1.0、1.2、1.4、1.6 g 时,乙酸转化率呈现出升高趋势,乙酸乙酯的纯度有所提高,当分子筛添加质量达到1.2 g(相当于质量分数8%的添加量)时乙酸乙酯转化率达最大值,这是因为3A分子筛能够吸附反应体系中的一部分水分,使得反应能够向生成乙酸乙酯的方向进行,当继续向反应体系加入分子筛时,由于反应体系中的水已被分子筛吸取使反应趋向生成乙酸乙酯的方向达到平衡,此时的乙酸乙酯含量已经达到一个稳定值。因此,选取1.2 g(相当于质量分数8%的添加量)分子筛为最合适的分子筛添加质量。
2.6 不同脂肪酶对合成乙酸乙酯的影响
按1.2.2的方法构成稻米脂肪酶催化合成乙酸乙酯的反应体系,分别测定稻米脂肪酶、国产碱性脂肪酶和标准脂肪酶3种脂肪酶在正己烷体系中的乙酸转化率,考察3种不同来源的脂肪酶对合成乙酸乙酯的影响。不同脂肪酶对乙酸转化率的影响如图6所示。

图6 不同脂肪酸对合成乙酸乙酯的影响Fig.6 Effect of different lipase on the synthesis of ethyl acetate
上图可知,在碱性脂肪酶、标准脂肪酶和稻米脂肪酶3种酶中,就乙酸转化率而言,碱性脂肪酶的效率最低,稻米脂肪酶比标准脂肪酶的催化合成效率略高。
3 结 语
通过研究发现,在有机溶剂中决定酯合成反应的关键还是脂肪酶的选择。不同来源的脂肪酶,由于其底物特异性的差异导致其合成酯的能力也不一样。即使是同种脂肪酶,根据其活力的大小也会对目的产物的合成造成影响。根据工业化生产的需要,选择一种适合目的产物高效合成的脂肪酶至关重要。在有机溶剂正己烷中,毕赤酵母细胞表面的稻米脂肪酶作为催化剂催化乙酸和乙醇合成乙酸乙酯的转化率高,是一种适合工业化生产的途径。通过单因素实验,确定了稻米脂肪酶添加量、反应温度、反应时间、底物摩尔比、3A分子筛的添加质量等一系列影响稻米脂肪酶合成乙酸乙酯的因素,确定了反应最优工艺条件:在15 mL正己烷中,稻米脂肪酶的酶活为15 750 U/g,3A分子筛的添加质量为1.2 g(相当于8 g/mL的添加质量浓度),底物摩尔比(乙酸∶乙醇)为1.2∶1,在 40℃条件下振荡反应4 h,合成乙酸乙酯的的转化率可达到90.92%。在测定稻米脂肪酶催化反应体系中乙酸乙酯浓度时利用毛细管气相色谱法可更有效、快速、准确地研究酶法合成乙酸乙酯的相关课题,也可在该法的工业化生产中,为乙酸乙酯质量分析提供借鉴。
