生物抑菌剂对4种常见腐败菌抑制效果
2018-08-20郑瑞生庄端宁陈健伟吴晓菲
郑瑞生,庄端宁, 杨 莹,陈健伟,吴晓菲
(泉州师范学院 海洋与食品学院,福建 泉州 362002)
随着食品安全意识的提高,民众对食品的防腐保鲜问题越来越重视。据估计,全世界每年约有10%~20%的食品由于腐败而废弃,由此造成巨大的经济损失[1]。应对食物防腐保鲜,人们第一反应是使用化学防腐剂,但过量添加化学防腐剂可致癌,而使用物理防腐的方法对食品的破坏性大。为此,开发出抗菌性强、安全无毒害的天然防腐剂已成为新的研究热点[2]。
ε-聚赖氨酸(ε-poly-L-lysine,简称 ε-PL)由单个赖氨酸分子在α-羧基和ε-氨基形成酰胺键而连接成的多聚体,有20~30个赖氨酸单体组成[3]。ε-PL抑菌谱广、pH值范围宽、安全性高,在高温下稳定,水溶性强,在人体内可分解为人体必需的L-赖氨酸[4]。作为一种天然、营养、安全特性的防腐剂,ε-PL已被FDA批准为安全食品保鲜剂。乳酸链球菌素也称乳酸链球菌肽或尼生素(简称Nisin),是世界公认的一种高效、无毒、安全的天然防腐剂,它是由牛乳和乳酪中自然存在的乳酸链球菌发酵而产生[5-7]。壳聚糖(chitosan,简写CTS)是甲壳素脱乙酰基后得到的产物,是自然界中唯一能够大量存在的碱性氨基多糖,具有抑菌的广谱性。正因为这种性质使得它作为一种天然的抗菌剂[8-10]。
本文中以ε-PL、Nisin、CTS 3种天然生物抑菌剂为材料,将食品中常见的腐败菌枯草芽孢杆菌(Bacillus subtilis)、蜡样芽孢杆菌(Bacillus cereus)、金黄色葡萄球菌(Staphylococcus aureus)和沙门氏菌(Salmonella)作为实验菌,通过控制生物抑菌剂质量浓度、pH值以及与螯合剂(甘氨酸(Gly)、乙二胺四乙酸二钠(EDTA))等复配进行抑菌效果研究,为获得较为安全,天然的生物保鲜技术,减少食品中腐败菌污染,延长食品保藏期提供实验依据。
1 材料与方法
1.1 材料
枯草芽孢杆菌、蜡样芽孢杆菌、金黄色葡萄球菌、沙门氏菌:均取自福建农林大学食品科学学院;营养琼脂培养基、蛋白胨:杭州微生物有限公司产品;牛肉浸膏、NaCl、HCl、NaOH、乙酸、葡萄糖、柠檬酸、磷酸氢二钠、Gly、EDTA、CTS,均购自国药集团化学试剂有限公司产品。ε-PL:产自兰州伟日生物工程有限公司产品;Nisin:产自浙江银象生物工程有限公司产品。
1.2 仪器与设备
YJ-875型洁净工作台:苏州三兴净化有限公司产品;UV-1200型紫外可见光光度计:上海美谱达仪器有限公司产品;DZF-6050型真空干燥箱:上海精宏实验设备有限公司产品;SPX-250B-Z型生化培养箱、BXM-30R压力蒸汽灭菌器:上海博迅实业有限公司产品;JM-B30002型电子天平,德国赛多利斯集团产品;电子万用炉:天津市泰斯特仪器有限公司产品;PHS-3C型pH计:上海雷磁仪器厂制造;SHA-B恒温振荡器:常州国华电器有限公司产品。
1.3 实验方法
1.3.1 菌种的活化与培养 将枯草芽孢杆菌、蜡样芽孢杆菌、金黄色葡萄球菌、沙门氏菌分别接种于营养肉汤培养基中,36℃摇床培养24 h,活化菌种。再用平板划线法分离单菌落,挑取单菌落接种于营养肉汤培养基进行培养。
1.3.2 不同的生物抑菌剂对四种腐败菌的最低抑菌浓度(MIC)的测定 含抑菌剂的液体培养基的配制:分别取1.0 g ε-PL溶解于200 mL无菌水中;取1.0 g Nisin溶解于50 mL 0.02 mol/L稀盐酸中,再用无菌水定容至200 mL;取1.0 g CTS溶解于50 mL 0.2 mol/L乙酸中,用无菌水定容至200 mL,调节pH值至中性,将上述3种生物抑菌剂配制成5 g/L ε-PL、Nisin、CTS的母液。 接着用无菌水稀释为:0、0.156 25、0.312 5、0.625、1.25、2.5、5.0 g/L。 分别取1 mL的稀释液于4 mL的营养肉汤培养基中,混匀,配制成质量浓度分别为:0、0.031 25、0.062 5、0.125、0.25、0.5、1.0 g/L的含生物抑菌剂的液体培养基。
接种培养:分别接种经36℃恒温摇床培养18~24 h的4种腐败菌液0.1 mL于上述含不同质量浓度生物抑菌剂的培养基中,使接种后培养基中菌液的细胞浓度控制在1.0~5.0×104CFU/mL,在36℃条件下培养24 h后,取出菌液在600 nm波长比色,记录数据。
1.3.3 不同生物抑菌剂对4种腐败菌最小致死浓度(MLC)的测定 取1..2所述生物抑菌剂质量浓度为:0、0.031 25、0.062 5、0.125、0.25、0.5、1.0、2.0、3.0、4.0、5.0 g/L的带菌液体培养基,取0.1 mL于固体平板培养基中,混匀,放入36℃的培养箱中培养24 h后,取出观察记录平板上的菌落数。
1.3.4 不同生物抑菌剂浓度对4种腐败菌抑菌效果的测定 取经36℃恒温摇床培养18~24 h的4种腐败菌液,加到(55±5)℃的固体培养基中,菌液浓度控制在1.0~5.0×104CFU/mL,混匀倒入平皿,制成含菌平板。在平板上安放直径为8 mm的牛津杯,分别加入 0.2 mL 质量浓度为 0、1、2、3、4、5 g/L 的ε-PL、Nisin、CTS溶液注入牛津杯。置于36℃培养箱中培养,待24 h后,取出并用游标卡尺测量抑菌圈的直径,进行3次平行实验。
1.3.5 不同pH值条件下生物抑菌剂对4种腐败菌的抑菌效果的测定 用0.1 mol/L,pH为3.0~8.0的磷酸氢二钠-柠檬酸缓冲液和0.1 mol/L,pH为9~10的甘氨酸-氢氧化钠缓冲液分别配置浓度为3 g/L的 ε-PL(pH 为 4、6、7、8、10)、3 g/L 的 Nisin(pH 为3、4、5、6)溶液、3 g/L 的 CTS(pH 为 3、4、5、6)。 分别移取不同pH的生物抑菌液0.2 mL,按1.3.4的方法加入含菌平板的牛津杯中,置于36℃培养箱中培养,待24 h后,取出并用游标卡尺测量抑菌圈的直径,进行3次平行实验。
1.3.6 不同螯合剂与生物抑菌剂复配对4种腐败菌抑菌效果的测定 将表1配置好的复合抑菌剂分组分别加入牛津杯中进行抑菌实验,36℃培养24 h,取出并用游标卡尺测量抑菌圈的直径,进行3次平行实验。抑菌剂配方见表1。

表1 生物抑菌剂的螯合试验Table 1 Chelating experiments of bio-inhibitor
1.3.7 数据分析与统计方法 采用DPS软件进行数据统计分析。
2 结果与分析
2.1 生物抑菌剂对4种腐败菌MIC、MLC的分析
生物抑菌剂对4种腐败菌的MIC实验结果见表2。
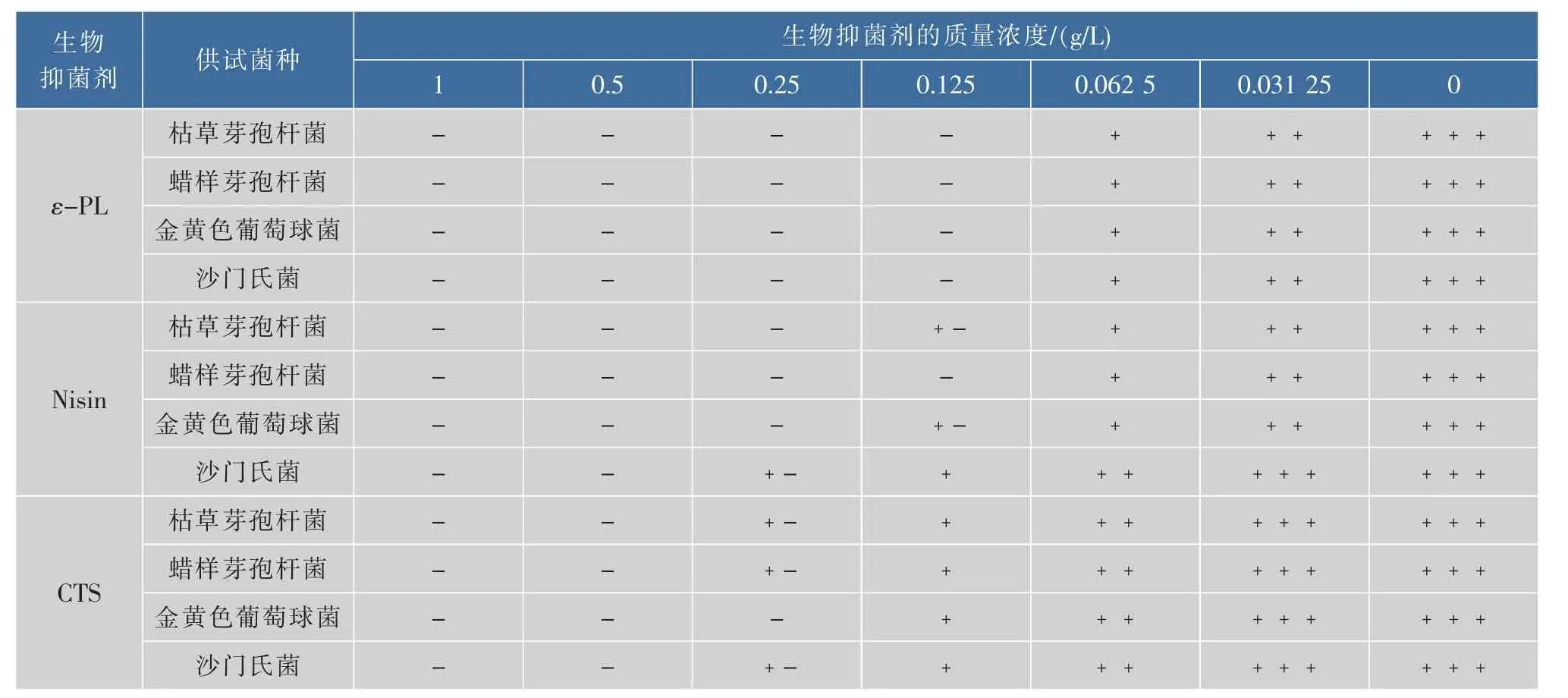
表2 不同生物抑菌剂的MICTable 2 MIC of different bio-inhibitors
由表2 可知,ε-PL、Nisin、CTS 对 4 种腐败菌的生长均有显著的抑制作用,并且抑制作用随着生物抑菌剂质量浓度的增加而增大。ε-PL对4种腐败菌的MIC均为0.125 g/L。Nisin对蜡样芽孢杆菌的MIC为0.125 g/L,对枯草芽孢杆菌、金黄色葡萄球菌的MIC均为0.25 g/L,对沙门氏菌MIC为0.5 g/L。除金黄色葡萄球菌MIC为0.25 g/L,CTS对其余3种腐败菌的MIC均为0.5 g/L。
ε-PL对革兰氏阳性、阴性菌均有较好抑菌效果,这是由于ε-PL是一种阳离子的聚合多肽,正电荷的存在有利于ε-PL与靶细胞表面上带负电的位点相结合,阻止了细胞内外间物质的运输,从而达到抑制细菌生长的效果[11]。Nisin中DHA和DHB能够和某些对应敏感菌株细胞膜中的某些酶的巯基发生反应,进而造成敏感细胞裂解[12]。CTS对4种菌的抑菌效果相对较弱,其主要是依靠CTS的阳离子吸附带有负电荷的细菌,让细胞壁和细胞膜上负电荷的分布不均匀,导致细胞膜不能承受渗透压的变化而变形破裂,引发细菌溶解死亡[16]。
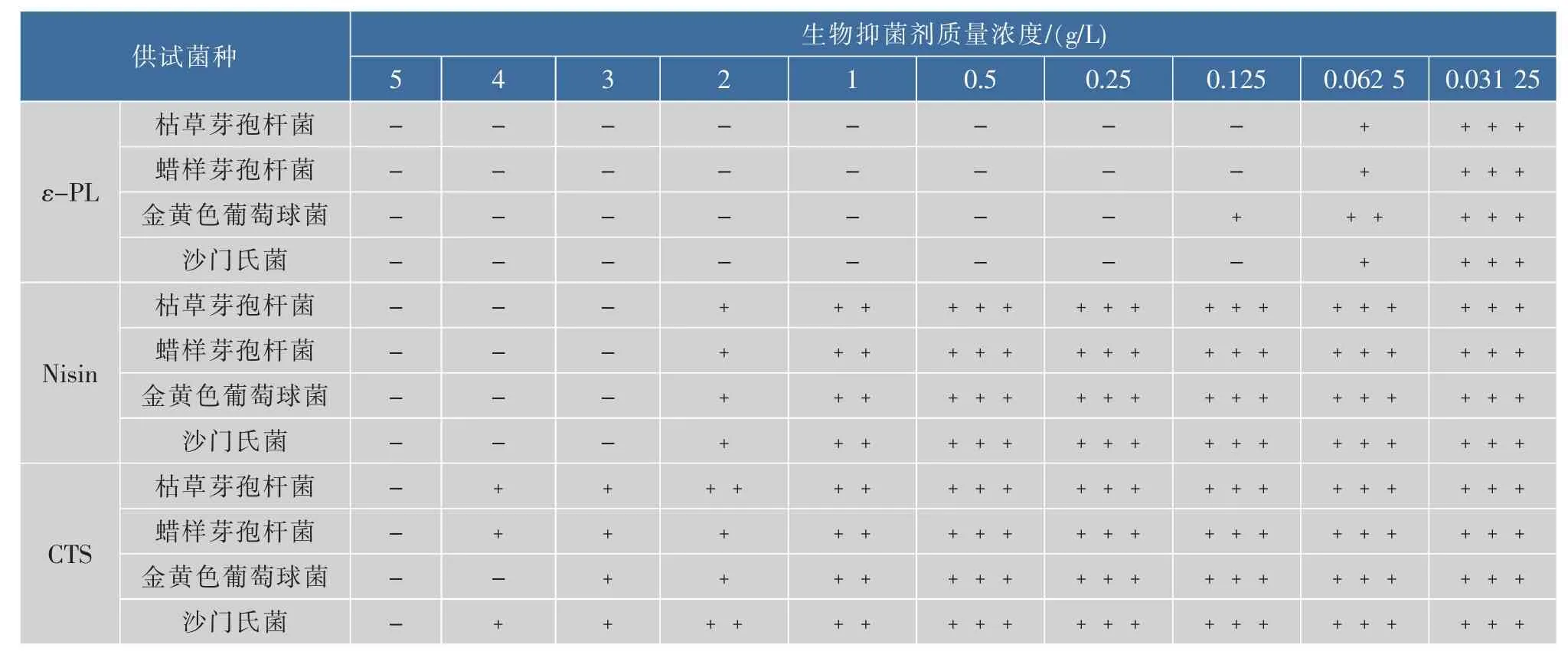
表3 不同生物抑菌剂的MLCTable 3 MLC results of different bio-inhibitors
腐败菌在平板上均无菌落生长,相应质量浓度作为其MLC。由表3可知,ε-PL对枯草芽孢杆菌、蜡样芽孢杆菌和沙门氏菌的MLC均为0.125 g/L,对金黄色葡萄球菌的MLC为0.25 g/L。Nisin对4种腐败菌的MLC均为3 g/L。CTS对金黄色葡萄球菌的最小致死浓度为4.0 g/L,其余3种均为5 g/L。ε-PL表现出的良好的抑菌性,其次是Nisin,而相对CTS的抑菌效果最差。ε-PL具有多聚阳离子,能破坏微生物细胞膜的结构,引起微生物细胞内物质、能量和信息传递中断,它还能与细胞内的核糖体结合从而影响生物大分子的合成,最终导致细胞裂解死亡[13]。
2.2 不同生物抑菌剂质量浓度对4种腐败菌的抑菌效果
由图1~4可知,在pH值相同条件下,随着抑菌剂的质量浓度增大,对4种腐败菌的抑菌效果也逐渐增强。ε-PL对4种腐败菌的抑菌效果最为明显,生长趋势差异极显著(P<0.01)。Nisin其次,差异也达到显著水平(P<0.05)。CTS的抑菌效果相对较差,在质量浓度3~5 g/L时差异不显著(P>0.05)。可见,ε-PL对4种腐败菌均能起到很好的抑制作用。这是因为ε-PL是一种靠肽键连接羧基与氨基基团的多聚L-赖氨酸,具有广谱抗菌性,对革兰氏阳性菌、革兰氏阴性菌均有抑制作用。据研究,ε-PL可直接吸附到细胞膜上,最终导致细胞死亡,或者抑制细菌的呼吸作用,同时作用于细胞膜和蛋白合成系统,与核糖体结合抑制蛋白质和酶的合成,从而达到杀菌目的[14-15]。而Nisin是一种由乳酸乳球菌核糖体上合成的并经过一系列酶学修饰的以含有羊毛硫氨酸和β-甲基羊毛硫氨酸等稀有氨基酸为特征的抗菌肽,Nisin与细胞膜通过结合,插入和孔道形成等多步过程形成孔道复合物,从而引起细胞液渗漏。Nisin的抑菌效率取决于其分子结构,受目标控制菌及其系统性质的影响,如Nisin抗性、膜干扰剂、亚致死伤害、阳离子、温度、pH、蛋白水解酶和其它防腐剂,能够抑制许多引起食品腐败的革兰阳性菌[16]。而CTS的抑菌效果不稳定可能受其分子量和脱乙酰度的影响,随分子量的变化表现出不规则的变化,且不同的分子量段有不同的变化趋势,导致抑菌效果不尽相同。

图1 不同生物抑菌剂对枯草芽孢杆菌的抑菌效果Fig.1 Antibacterial effects of different bio-inhibitors against Bacillus subtilis
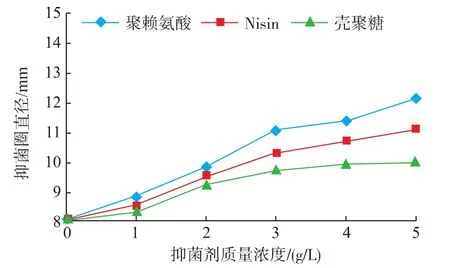
图2 不同生物抑菌剂对蜡样芽孢杆菌的抑菌效果Fig.2 Antibacterial effects of different bio-inhibitors against Bacillus cereus
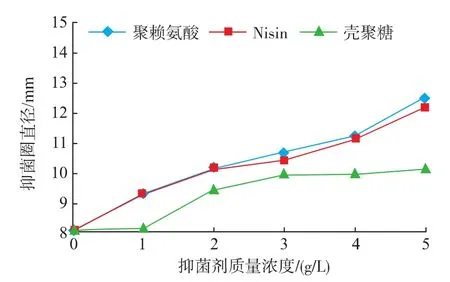
图3 不同抑菌剂对金黄色葡萄球菌的抑菌效果Fig.3 Antibacterial effects of different bio-inhibitors against Staphylococcus aureus
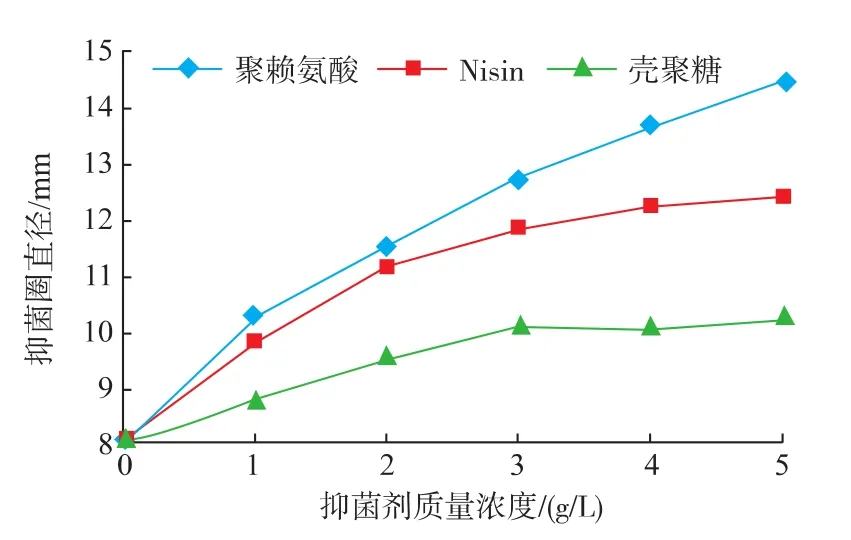
图4 不同生物抑菌剂对沙门氏菌的抑菌效果Fig.4 Antibacterial effects of different bio-inhibitors against Salmonella
2.3 不同pH值对4种腐败菌的抑菌效果
由图5~图8可知,ε-PL对4种腐败菌的抑菌圈大小随着pH升高呈先上升后减少的趋势,在中性条件下(pH=7)抑菌圈直径最大,抑菌效果最好。而在酸性及碱性条件下,ε-PL的抑菌活性较差,差异达到显著水平(P<0.05)。这可能是由于聚赖氨酸作为赖氨酸的聚合物在酸性和碱性条件下易分解的缘故。Nisin和CTS在中性和碱性的情况下难溶,在酸性情况下溶解度较大,因此实验的pH值控制在3~6。随着pH值降低,Nisin和CTS对4种腐败菌的抑制作用越好,Nisin和CTS在pH值3~4时抑制作用最好,但随着pH值的增加,抑制作用逐渐减弱。据研究表明,酸性条件下Nisin的活性较强,其对原生质的作用方式会使细胞质基质的失活,导致细胞溶解,细胞质如三磷酸腺苷的渗出,最终导致细菌的死亡。而CTS是一种碱性聚合物电解质,pH值的变化对CTS有效抑菌基团的数量及其抑菌效果的发挥有重要影响。当pH值高于6时,CTS分子中的氨离子会被氢氧根所中和,使得其分子中的有效抑菌基团的数量下降,进而导致其抗菌效果降低;而当pH低于6时,CTS所带的正电荷,会和带负电荷的微生物细胞膜上的阴离子相结合,影响微生物细胞壁的发育和细胞膜质代谢,增大细胞膜的通透性,引起细胞内物质的外泄,从而干扰微生物细胞正常的生理功能,达到抑制细菌生长的目的[17]。
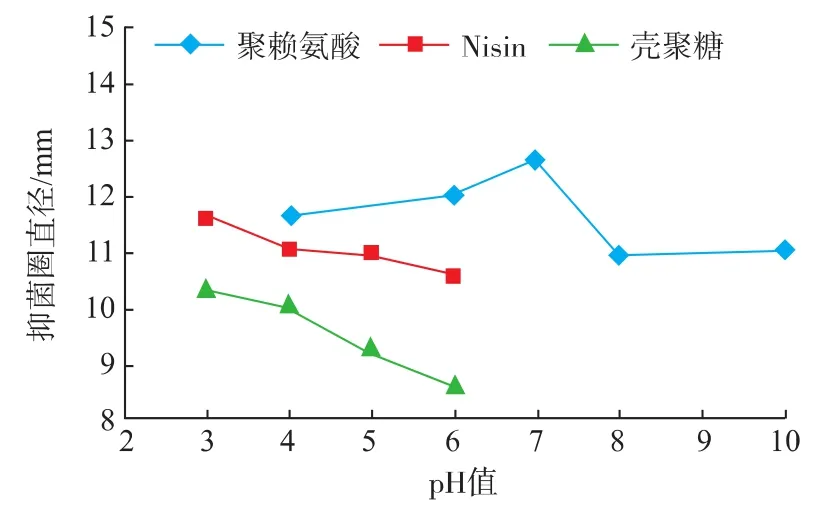
图5 不同pH值对枯草芽孢杆菌的抑菌效果Fig.5 Antibacterial effects of different pH values on Bacillus subtilis

图6 不同pH值对蜡样芽孢杆菌的抑菌效果Fig.6 Antibacterial effects of different pH values on Bacillus cereus
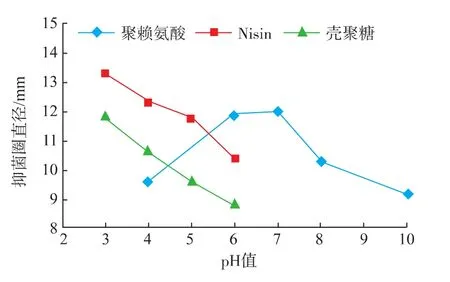
图7 不同pH值对金黄色葡萄球菌的抑菌效果Fig.7 Antibacterial effects of different pH values on Staphylococcus aureus
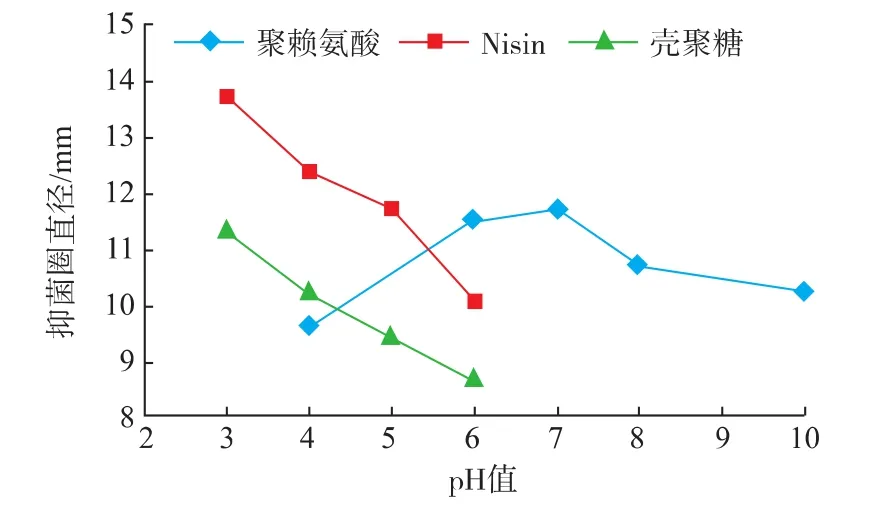
图8 不同pH值对沙门氏菌的抑菌效果Fig.8 Antibacterial effects of different pH values on Salmonella
2.4 不同螯合剂与生物抑菌剂复配对4种腐败菌的抑菌效果
由图9~图11 可知,单独使用 ε-PL、Nisin、CTS对四种腐败菌具有良好的抑菌效果,其中,尤以ε-PL的抑菌效果最佳。而单独使用Gly基本无抑制作用。单独使用EDTA,虽能对4种腐败菌起到一定的抑制作用,但是抑制的效果不长,容易发生反复,即初期效果明显,培养一段时间后细菌有恢复生长的现象。Gly与3种生物抑菌剂复配效果无明显的变化,但产生的抑菌圈有更为清晰持久,表明Gly对3种生物抑菌剂有一定的增效作用。将3种生物抑菌剂和EDTA复合使用抗菌作用显著增强,尤其以ε-PL最为显著,ε-PL综合了EDTA的抑制作用,可以增大抑菌圈范围,起到良好的抑制作用。3种生物抑菌剂与Gly和EDTA复配也能起到良好的协同增效作用,但效果不如生物抑菌剂与EDTA复配明显,表明EDTA的协同抗菌增效显著。
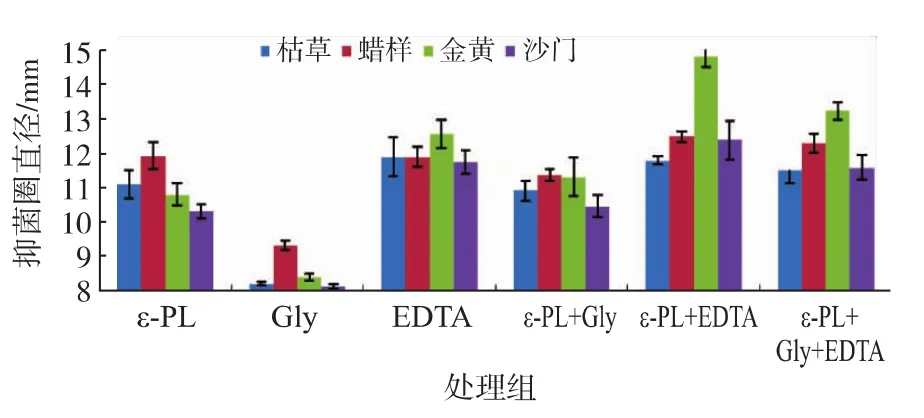
图9 螯合剂对聚赖氨酸抑菌效果影响Fig.9 Inhibitory effects of chelating agents with ε-PL
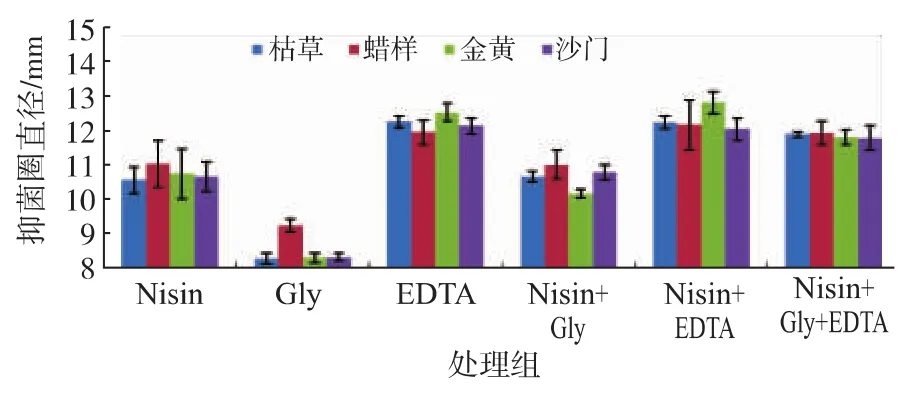
图10 螯合剂对Nisin抑菌效果影响Fig.10 Inhibitory effects of chelating agents with Nisin

图11 螯合剂对CTS抑菌效果影响Fig.11 Inhibitory effects of chelating agents with chitosan
3 结语
以食品中4种常见腐败菌 (枯草芽孢杆菌、蜡样芽孢杆菌、金黄色葡萄球菌、沙门氏菌)为实验菌,研究ε-PL、Nisin、CTS在不同条件下对腐败菌的抑制效果。结果如下:
ε-PL、Nisin、CTS均能对 4种腐败菌的生长起到抑制作用,其中以ε-PL的效果最好,Nisin其次,CTS由于受溶解性及pH影响,抑菌效果不太理想。ε-PL对枯草芽孢杆菌、蜡样芽孢杆菌、金黄色葡萄球菌、沙门氏菌的MIC,均为0.125 g/L,MLC除沙门氏菌为0.2 g/L,其余均为0.125 g/L;Nisin对4种腐败菌的 MIC分别为依次分别为 0.125、0.25、0.25、0.5 g/L;MLC 分别为 2.5、3.0、2.5、3.0 g/L。 CTS 对 4种菌的MIC除沙门氏菌为0.5 g/L外,其余均为0.25 g/L,MLC除金黄色葡萄球菌为4.0 g/L,其余均为5.0 g/L。ε-PL、Nisin对4种腐败菌均有良好的抑菌效果,抑菌剂质量浓度1~5 g/L的范围内,抑菌效果随质量浓度的增大而增强;CTS的抑菌效果相对较差,在质量浓度3~5 g/L时对4种腐败菌抑制效果差异不显著(P>0.05)。不同pH值对生物抑菌剂抑菌活性有着很大的影响。在pH值为7时,ε-PL对4种腐败菌的抑制效果最佳,随着酸性或碱性的增强,ε-PL的抑菌效果均有所下降。Nisin和CTS的抑菌效果随pH的降低而升高,表明酸性条件能够增强Nisin和CTS的抑菌能力。
3种生物抑菌剂与螯合剂复配的抑菌效果不尽相同:与Gly复配无明显的协同增效作用,但能提高抑菌效果的持久性;与EDTA的复配对腐败菌抑制具有较明显的增效作用,尤其是ε-PL与EDTA复配抑菌效果显著且稳定。
