利用PicoGreen作为检测探针建立基于核酸适配体识别的玉米赤霉烯酮快速检测方法
2018-08-20金庆日苗灵燕田广燕方维焕宋厚辉
金庆日, 苗灵燕, 田广燕, 方维焕, 宋厚辉*
(1.浙江农林大学动物科技学院;2.浙江农林大学外国语学院:浙江 临安 311300;3.浙江大学动物科学学院,浙江 杭州 310058)
食品安全问题是每个人日常生活中不可忽略的大问题,在全球各地已引起广泛关注。如何快速有效鉴别食品中是否存在有毒成分已成为世界各国积极推进的研究工作。根据有关调查显示,真菌毒素是造成谷物粮食数量和质量降低的元凶之一[1]。为有效控制此类事情的发生,针对存在于食品和农作物中的真菌毒素进行残留监控十分必要[2],如何有效检测真菌毒素已成为世界各国关注的焦点。
玉米赤霉烯酮(Zearalenone)简称为ZEN。ZEN的主要侵染对象为玉米、小麦、燕麦和大米等农作物。有研究表明,ZEN的阳性检出率在玉米中约为45%,在小麦中约为20%[3]。ZEN具有类似于雌激素的作用,它会使动物出现慢性或急性中毒的症状,动物血液中的雌激素水平也会显著升高,从而导致中毒动物的繁殖机能出现异常,出现头晕、精神抑郁、共济失调等神经症状,严重时甚至出现死亡[4],动物中对ZEN最易感的是猪[5]。
当前较为常用的ZEN检测方法主要有薄层层析法(TLC)[6]、高效液相色谱法(HPLC)[7]、气相色谱法(GC)[8]、液相色谱串联质谱法(LC/MS/MS)[9]和酶联免疫吸附法(ELISA)等[10]。但是这些方法具有检测时间长、灵敏度和特异性差、需要昂贵的仪器设备、大量有机溶剂以及需要通过净化洗涤,衍生或浓缩等十分繁复的样品预处理过程等缺点。而免疫学相关的检测方法是近期新发展起来的一种检测方法,主要方法有酶联免疫吸附(ELISA)法、放射免疫性鉴定(RIA)法[11]和胶体金免疫层析试纸条(CGIA)法[12]等。但CGIA法的缺点是检测灵敏度不高,放射免疫分析法可能造成放射性污染,不适合在基层推广应用。虽然ELISA 法的特异性和灵敏度都较高,操作步骤简单,但是ZEN的 ELISA 检测试剂盒价格昂贵。因此,急需建立一种价格低廉、灵敏准确的ZEN快速检测方法。
核酸适配体是一种单链DNA,是利用体外筛选技术-SELEX筛选富集进化技术[13],从DNA文库中筛选与相应的互补链发生特异性结合的DNA片段[14]。核酸适配体以其不同于抗体的检测方法目前已广泛应用于各类生物样品的检测[15]。只需先设计出相应的核酸序列,便可合成相应适配体,较抗体具有使用方便、易修饰、无免疫原性、经济实用等特点。目前关于核酸适配体的定量检测方法主要有:荧光标记法、胶体金法和磁珠法等[16]。
传统的ELISA方法检测ZEN虽具有较好的灵敏度与特异性,但抗体归根结底是一种蛋白质,容易在高温、不适宜pH值等环境因素下发生变性,且抗体制备价格较高。而适配体是比蛋白质小的DNA或RNA[17],不同于蛋白质的是经指数富集后,核酸适配体所具有的灵敏度和特异性与抗原-抗体反应相当,且它更易合成,也不易受环境影响而变性。
本文选用已报道的ZEN特异性核酸适配体,利用非标记荧光染料PicoGreen识别双链DNA的特异性,建立了一种快速、高效检测ZEN的方法,适用于尚缺高端检测设备(如HPLC和LC/MS/MS)的基层检测机构大批量样品的快速筛查,具有广阔的应用前景。
1 材料与方法
1.1 材料与仪器
ZEN、CTN、AFB1、OTA和FB1(美国Sigma 公司);PicoGreen(Life Technologies公司);氯化钠(Sodium Chloride)、氯化钾(Potassium Chloride)(西陇化工股份有限公司);碳酸钠(Sodium carbonate)、碳酸氢钠(Sodium Bicarbonate)、吐温-20(Tween-20)(life Sciences公司);磷酸二氢钾(potassium dihydrogen phosphate)、磷酸氢二钠(Disodium hydrogen phosphate)(Sangon Biotech公司);脱脂奶(skim milk)(碧迪医疗器械上海有限公司);ZEN抗体和ZEN-OVA由本实验室制备。
小型高速离心机(Beckman Coulter公司,型号为Microfuge 16);荧光检测仪(BioTek公司,型号为SynergyTMH1);超纯水仪(Thermo Fisher Scientific公司,型号为D11921);涡旋搅拌器(Scientific Industries公司);数显恒温磁力搅拌器(杭州仪表电机有限公司);数显恒温水浴锅(国华电器有限公司);电子分析天平(赛多利斯科学仪器有限公司);恒温金属浴(浙江纳德科学仪器有限公司)。
ZEN核酸适配体[18]、ZEN核酸适配体互补链[18]由苏州金唯智生物科技有限公司合成(表1)。

表1 ZEN核酸适配体及互补链名称与序列
1.2 检测原理
PicoGreen是一种可以定量检测双链DNA的新型染料,且不与单链DNA结合,其灵敏度可达pg级,与双链核酸结合以后产生的荧光强度可以增加1000倍及以上[19]。当ZEN存在时,核酸适配体与ZEN结合,空间构象会发生一定的变化,而不能与互补链(seq1)形成双链DNA,当ZEN不存在时,核酸适配体则能够杂交形成DNA双链。而DNA双链则可被PicoGreen结合从而激发荧光,可通过酶标仪检测其荧光信号强度,通过荧光信号的强弱检测样品中ZEN的浓度[20](图1)。

图1 ZEN检测原理图解[20]
1.3 PicoGreen与双链DNA最佳反应时间的优化
取50 μL核酸适配体溶液和50 μL互补链Seq1溶液于孔内混匀(1∶1),于25 ℃恒温金属浴反应20 min,每孔再加入10 μL PicoGreen[20]混合均匀后迅速置于酶标仪,连续检测30 min的荧光强度(激发波长:480 nm,发射波长:520 nm),重复4次。
1.4 ZEN检测的灵敏度试验
用缓冲溶液将ZEN分别稀释成终浓度为0.1、0.2、0.4、0.5和1 μg/L的溶液。取50 μL ZEN溶液与25 μL 40 nmol/L ZEN核酸适配体于离心管中震荡混匀,置于25 ℃恒温金属浴反应20 min,加入25 μL 40 nmol/L的互补链溶液,于25 ℃恒温金属浴继续反应5 min,最后每孔加入10 μL PicoGreen,混合均匀后立即置于酶标仪中检测其荧光强度(激发波长:480 nm,发射波长:520 nm),重复4次。
1.5 Aptamer/PicoGreen ZEN检测方法的建立
取50 μL样品溶液与25 μL 10 nmol/L核酸适配体于离心管中震荡混匀,在25 ℃恒温金属浴中反应20 min,再加入25 μL 10 nmol/L适配体互补链溶液,震荡混匀,于25 ℃恒温金属浴继续反应5 min,每孔中再加入10 μL PicoGreen,混匀搅拌,随即置于荧光检测仪中检测其荧光强度(参数设置:激发波长480 nm,发射波长520 nm)。
1.6 ZEN核酸适配体特异性试验
将ZEN、CTN、AFB1、OTA和FB1稀释为1 μg/L,分别取50 μL各毒素溶液与25 μL 40 nmol/L ZEN核酸适配体溶液震荡混匀,置于25 ℃恒温金属浴中反应20 min,加入25 μL 40 nmol/L互补链溶液于25 ℃继续反应5 min,最后每孔加入10 μL PicoGreen,于孔内混匀,随即置于酶标仪中检测其荧光强度 (参数设置:激发波长480 nm,发射波长520 nm)。
1.7 与ELISA检测法的一致性
牛奶用缓冲溶液稀释成1%的溶液作为样品。取28份样品,分别加ZEN,使溶液的终浓度依次为1、2、2.5、5、10、50和 100 μg/L,每种浓度检测4份样品。另取10份牛奶样品作为阴性对照。
100 μL OVA-ZEN(50 ng/mL)于微孔板上4 ℃包被过夜,PBST洗涤3次。加入200 μL 5%脱脂牛奶,室温下(25 ℃)孵育2 h(300 r/min),PBST洗涤3次。检测样品溶液时,每孔加入100 μL样品混合液(ZEN-Ab溶解于样品溶液,体积比为1∶50 000)。室温下(25 ℃)孵育1 h(300 r/min),每孔加入二抗100 μL,于室温(25 ℃)下孵育1 h(300 r/min),PBST洗涤3次。每孔加入100 μL TMB显色液,吹打混匀,室温(25 ℃)显色15 min,最后每孔加入100 μL终止液(0.2 M H2SO4),用酶标仪检测 450 nm处的波长。用Aptamer/PicoGreen ZEN检测方法和ELISA法检测牛奶样品,计算2种方法之间的 Kappa 值[21]。
2 结果与分析
2.1 PicoGreen与ZEN核酸适配体形成双链DNA的反应条件检测
检测PicoGreen与ZEN核酸适配体形成双链DNA的反应条件首先需要确定PicoGreen与缓冲液、核酸适配体DNA单链、互补链单链、核酸适配体与互补链杂交形成的双链DNA之间是否会单独反应并释放荧光,以及确定该荧光是否能被捕捉以用于实际应用中的检测。结果表明,PicoGreen与双链DNA杂交产物能够很好的结合并产生较强荧光,可用荧光检测仪进行检测(图2)。因此,本文建立的利用PicoGreen染料与双链核酸结合的特性,使用核酸适配体方法检测ZEN所需的反应条件满足该技术的开发要求。
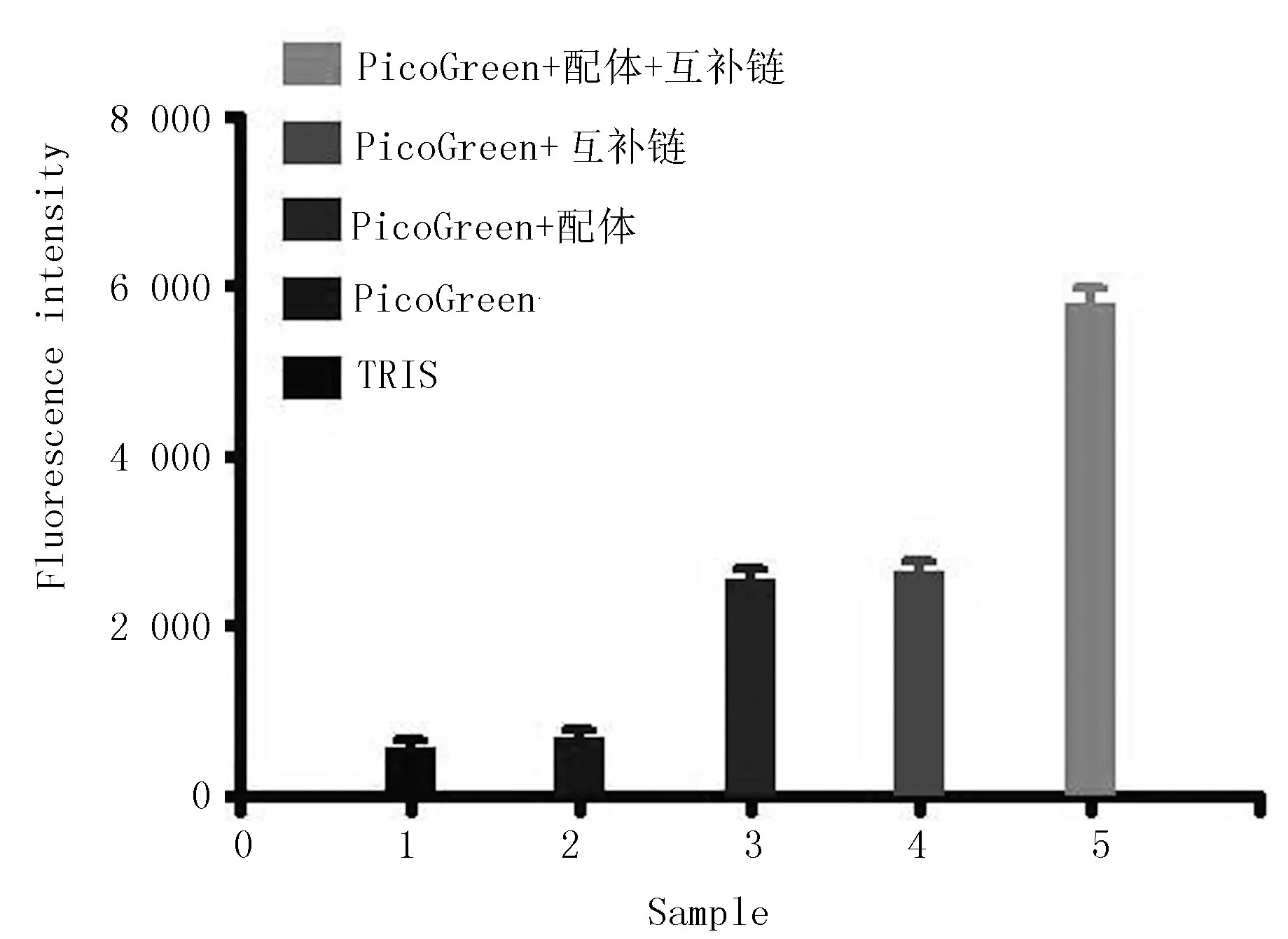
图2 ZEN核酸适配体形成的双链DNA与PicoGreen结合后的荧光检测
2.2 PicoGreen释放荧光峰值时间
该检测方法中,加入反应体系的PicoGreen为固定值,因此需要确定在特定浓度下荧光强度达到峰值的时间。试验结果表明,双链DNA与PicoGreen结合后所激发产生的荧光立刻达到最大值,随后荧光强度逐渐减弱(激发波长:480 nm,发射波长:520 nm)。主要原因是存在于反应体系中双链DNA全部与PicoGreen结合并释放出荧光以后,随着时间的推移,PicoGreen逐渐分解,使荧光信号强度逐渐减弱。由图3可知,被测物加入PicoGreen后,PicoGreen与双链结合并释放荧光,激发荧光值随即达到最大值,随着反应时间的推移,荧光强度逐渐减弱。且在图3中还可以看出,核酸适配体的浓度越大,结合的双链DNA越多,荧光强度越强。因此,后续的检测技术开发中,选择40 nM核酸适配体和加入PicoGreen后随即检测的方法。
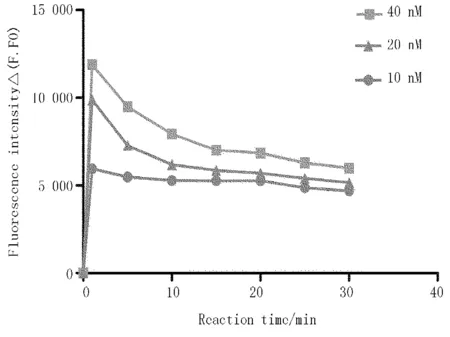
图3 PicoGreen与双链DNA最佳反应时间的确定
2.3 ZEN检测的灵敏度试验
一种检测技术的开发,其灵敏度是一个重要参数,又称最低检测限或敏感性。试验结果表明,反应体系中加入的ZEN初始质量浓度越大,荧光检测仪能够检测到的PicoGreen与双链结合所释放出的荧光信号就会越小。因核酸适配体的浓度固定不变,因此,与ZEN结合的核酸适配体越多,剩余能结合于适配体互补链的ZEN核酸适配体就会越少,能与PicoGreen结合的双链DNA的量也会随之减少,激发出的荧光信号强度也会逐渐减弱。试验结果表明,该检测方法的检测下限为0.1 μg/L(0.1 ppb),线性范围为 0.1~1 μg/L(0.1~1 ppb)(图4)。
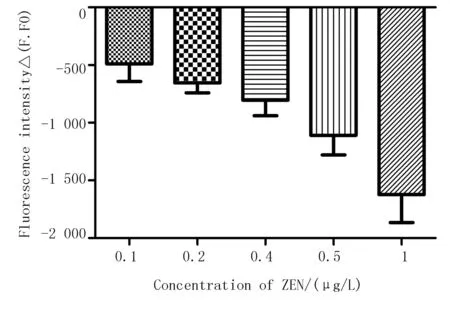
图4 ZEN 的灵敏度检测
2.4 基于核酸适配体的荧光检测法检测ZEN的特异性
在检测技术的开发过程中,评价其好坏的一个重要标志就是特异性。特异性又叫做交叉反应性。本文主要针对食品与农作物中毒性较大的几种霉菌毒素分别进行了检测。试验结果表明,加入PicoGreen后检测到的荧光强度较强的是 CTN、AFB1、FB1、OTA 4种毒素。在加入同样浓度ZEN的反应体系中,检测的荧光强度则较弱。这恰恰说明,当反应体系中加入ZEN时,ZEN核酸适配体就会与其发生特异性结合,只剩余少量核酸适配体与互补链结合形成双链DNA。另外4种毒素不能与ZEN核酸适配体结合,因此反应体系中核酸适配体就会全部与其互补链结合形成双链DNA,产生大量双链DNA,所激发产生的荧光强度增强。因此,该试验选用的核酸适配体能特异性识别并结合ZEN,与CTN、AFB1、FB1或OTA不会发生交叉反应(图5)。
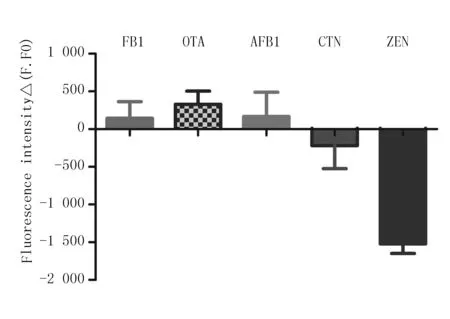
图5 基于核酸适配体与PicoGreen检测ZEN 的特异性试验
2.5 对照ELISA检测方法是否具有一致性
目前,抗原-抗体检测方法仍然是检测ZEN最常用的方法,此方法的优势就在于具有较高的灵敏度和特异性,但也具有成本高、抗体保存要求高、容易变性等缺点。本文建立的检测方法在弥补这些缺点的同时也具有和ELISA方法相似的灵敏度和特异性。为判定本文建立的检测方法与ELISA方法是否具有一致性,该试验通过牛奶样品中添加ZEN的方法制备样品并检测其荧光值和波长值,计算回收率(表2)。检测结果表明,当ZEN毒素的质量浓度较低时,相应回收率也较低。当浓度为10 μg/L时,回收率达到87.94%和96.52%(表3)。比较2种方法,计算得到的Kappa值为0.805(检测样品浓度分别为0、1、2、2.5、5、10 μg/L),表明2种方法的检测结果具有良好的一致性(表3)。因此,本文建立的基于核酸适配体和PicoGreen的检测方法可应用于样品中ZEN的检测。
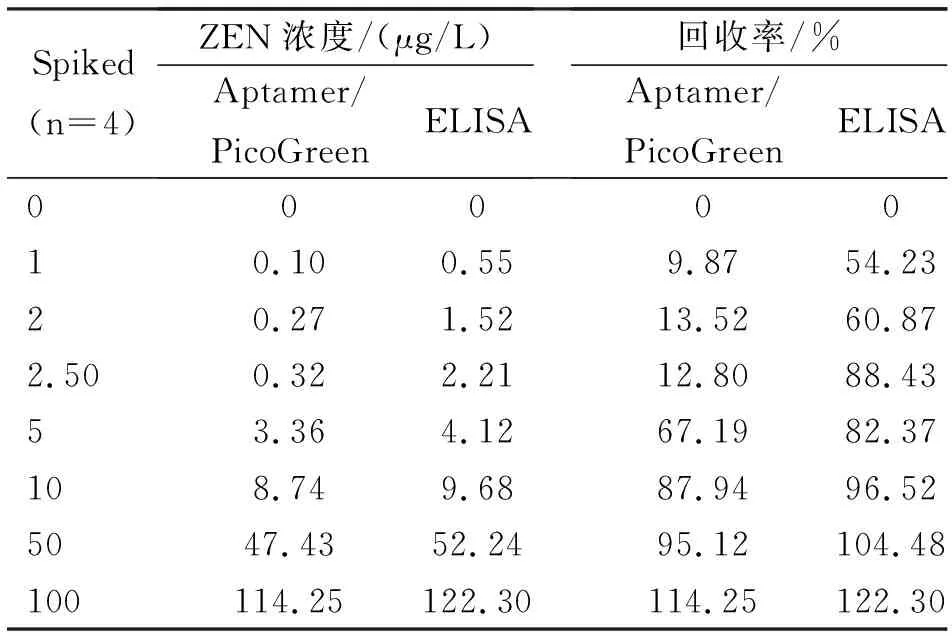
表2 2种检测方法回收率的比较
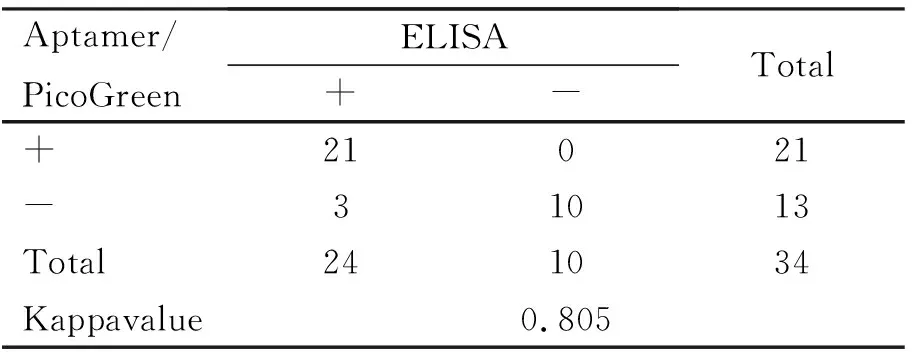
表3 Kappa 值
3 讨论与结论
目前,国内食品受生物毒素、农药、兽药污染问题严重。虽然国家和政府已高度重视并做了大量工作,但执行情况却差强人意。导致该问题的原因之一就是没有普及一种合适的检测方法。目前玉米赤霉烯酮的检测方法较常用的有薄层层析法、高效液相色谱法和气相色谱法,但这几种方法对检测样品前期处理要求都比较高,前处理过程也较繁琐,且仪器设备昂贵。而基于荧光染料PicoGreen和核酸适配体的ZEN检测方法是一种可靠、准确、特异、快速、低成本的检测方法,特别适用于基层检测机构大批量样品的快速筛选和检测,在我国具有广阔的应用前景。
在特异性检测方面,与ZEN最为相似的是α-玉米赤霉烯醇、β-玉米赤霉烯醇是ZEN的代谢产物,多在潮湿、腐烂的环境中出现。在谷物中,α-玉米赤霉烯醇、β-玉米赤霉烯醇的总量较ZEN的含量低,目前在谷物中还没有相应的检测标准和限量。因此,在实际的检测过程中,玉米赤霉烯醇的存在对于ZEN的检测影响不大,而且即使出现交叉反应也只体现在ZEN及其衍生物的总量上,所以本文没有对这2种物质进行特异性检测。本文选择谷物中污染率较高、危害较大的真菌毒素,如CTN、AFB1、OTA、FB1等作为特异性比较的抗原。这些毒素在抗原结构上与ZEN具有一定的相似性,测定其交叉反应是为今后同时进行多种真菌毒素检测时,能最大限度地消除它们之间的相互干扰,从而对每一种真菌毒素进行精准的定量。试验结果表明ZEN核酸适配体具有高度特异性,不会与这些真菌毒素出现交叉反应(图5),本文建立的ZEN检测方法的检测下限为0.1 μg/L(图4)。
本文检测的回收率是通过牛奶样品中添加已知浓度的ZEN后测得。在实际检测中,这些样品需要进行萃取回收,在回收之后才能按照上述的方法进行ZEN的检测。初始样品中ZEN的含量越低,回收率就会越低。如果样品中ZEN的浓度达到10 μg/L(μg/kg)时,回收率达到87.94%和96.52%(表2)。动物性饲料和食品中ZEN最大残留限量分别为2 000和1 000 μg/kg,大于10 μg/L(μg/kg)。因此,本文建立的ZEN检测方法符合该标准,可用于样品中ZEN的快速检测。
核酸适配体是一种单链DNA,因能够与碱基一一对应并识别的特性,已被广泛应用在各类生物学检测领域中。本文中应用的ZEN核酸适配体特异性较高,不会与一些常见的真菌毒素,如CTN、AFB1、FB1、OTA等出现交叉反应。基于适配体和PicoGreen检测ZEN方法的灵敏度为0.1 μg/L,与目前常用的检测方法ELISA法相比也具有高度的一致性,Kappa值为0.805(表3)。本文建立的检测方法可以在40 min内完成,且具有稳定性好、特异性强、灵敏度高、结果准确、易于判定,具备快速、易操作、经济实用等优点。在现场大批量样品的快速检测中可以体现出其独特的优势,而且原理和方法都十分简单,适合在基层推广应用。
