黄芪总黄酮对RAW264.7细胞细胞因子和介质分泌水平的影响
2018-08-20于逸凡李金霞葛冰洁张雪梅
于逸凡, 张 贤, 桑 锐, 李金霞, 葛冰洁, 张雪梅
(延边大学农学院动物医学系,吉林 延吉 133002)
巨噬细胞是机体重要的免疫细胞之一,存在于几乎所有的组织当中[1],具有抗原呈递、吞噬、分泌细胞因子等功能,在机体内参与清除病原体、抗感染、免疫应答和免疫调节等过程,为机体内环境稳态提供保障,在天然免疫中起重要作用[2]。
黄芪(Astragalusmembranaceus)是一味传统中草药,为豆科草本植物,临床应用的黄芪多为蒙古黄芪的干燥根[3]。其性温、味甘、归脾肺经[4],具有补中益气、温养脾胃的功效[5]。现代药理学表明,黄芪具有抑菌、抑制病毒、调节内分泌、抗衰老、抗疲劳及抑瘤等药理作用[6]。黄芪是一种复杂的多组分体系,其粗提物主要含有3种成分,即皂苷、多糖和黄酮类化合物[7]。其中,黄芪总黄酮被认为是黄芪的主要活性成分[8],具有保护心脑血管、利胆保肝、清除自由基、抗氧化、抗癌、抗过敏等多种生物活性[6,9]。目前对于黄芪总黄酮功效的研究以抗炎作用为主,能在炎症表达时抑制细胞因子及其他分泌物的过度分泌,以此来实现抗炎作用。而对于黄芪总黄酮免疫作用的研究较少,因此本试验以黄芪总黄酮为研究对象,以RAW264.7细胞为体外模型,通过测定相关细胞因子来研究黄芪总黄酮的体外免疫调节作用,为黄芪总黄酮的临床应用提供依据。
1 材料与方法
1.1 材料
RAW264.7细胞购于北京协和细胞中心,黄芪总黄酮购于南京泽郎生物公司,胎牛血清和DMEM均购于Gibco公司,DMSO和MTT均购于Sigma公司,NO试剂盒购于碧云天生物研究所,IL-6、IL-1β、IFN-γ、TNF-α和PGE2的ELISA试剂盒购于R&D公司,核蛋白提取试剂盒购于北京索莱宝试剂有限公司,一抗iNOS鼠抗人单抗、一抗COX-2鼠抗人单抗、β-Actin内参和二抗山羊抗鼠单抗均购于Santa Cruz公司,170 kDa蛋白质Marker购于Fermcntas公司。
1.2 方法
1.2.1 RAW264.7细胞培养
小鼠巨噬细胞系RAW264.7细胞用含10%胎牛血清(FBS)的DMEM培养基, 放置在37 ℃,5% CO2培养箱中培养, 细胞贴壁生长,每2~3 d用0.25%胰蛋白酶消化传代。取对数期细胞用于试验。
1.2.2 黄芪总黄酮细胞毒性测定
通过MTT法测定黄芪总黄酮对RAW264.7细胞的毒性作用。取对数生长期细胞,调整细胞数为5×105个/mL。将准备好的细胞悬液铺于96孔板内,每孔100 μL,于37 ℃含5% CO2培养箱中培养8~12 h。根据试验分组分别加入培养液、不同浓度梯度的黄芪总黄酮(0~200 μg/mL),每组5个重复孔。培养24 h后,每孔中加入5 mg/mL MTT 50 μL,培养4 h,细胞沉淀用1 μg/mL DMSO溶解,用酶标仪测定在490 nm处的吸光度并计算细胞存活率。
1.2.3 细胞因子IL-6、IL-1β、IFN-γ和TNF-α的含量测定
以RAW264.7细胞为模型进行试验分组。取对数期细胞,调整细胞数为5×105个/mL,将含有细胞悬液的96孔板放于37 ℃含5% CO2培养箱中培养12 h后,分别加入10、25和100 μg/mL黄芪总黄酮,保持正常培养水平,并设立空白对照组,每组设立5个重复孔。通过ELISA法测定不同浓度的黄芪总黄酮在3、6、12、24 h时对RAW264.7细胞上清液中IL-6、IL-1β、IFN-γ和TNF-α分泌水平的影响。
1.2.4 细胞介质NO和PGE2含量的测定
以RAW264.7细胞为模型进行试验分组。取对数期细胞,调整细胞数为5×105个/mL,将含有细胞悬液的96孔板放于37 ℃含5% CO2培养箱中培养12 h后,分别加入10、25和100 μg/mL黄芪总黄酮,保持正常培养水平,并设立空白对照组,每组设立5个重复孔。通过Griess法和ELISA法测定不同浓度的黄芪总黄酮在3、6、12和24 h时对正常条件下RAW264.7细胞上清液中NO和PGE2释放的影响。
1.2.5 iNOS和COX-2蛋白表达测定
以RAW264.7细胞为模型进行试验分组。取对数期细胞,调整细胞数为5×105个/mL,将含有细胞悬液的6孔板放于37 ℃含5% CO2培养箱中培养12 h后,分别加入10、25和100 μg/mL黄芪总黄酮,保持正常培养水平,并设立空白对照组,每组设立5个重复孔。12 h后分别收集各组的RAW264.7细胞,PBS洗涤2次,用1.5 mL离心管收集细胞悬液,1 500 r/min离心5 min,弃上清后每管加入1 mL RIPA细胞裂解液冰上裂解30 min,12 000 r/min离心10 min后收集上清蛋白,BCA法测定蛋白浓度。蛋白质样品经SDS-PAGE分离,转移至PVDF膜。用5%脱脂乳在室温下封闭1 h,然后与一抗(iNOS、COX-2)孵育,4 ℃过夜。用TBST洗涤3次并在室温下与二抗孵育1 h,然后ECL显影。
1.2.6 结果处理与统计分析
应用SPSS 12.0软件,对统计结果进行单因素ANOVA、t检验比较。P<0.01为差异极显著,0.01
2 结果与分析
2.1 细胞毒性测定结果
RAW264.7细胞经0~200 μg/mL浓度的黄芪总黄酮(TFA)刺激后,与空白组相比较,采用MTT法测定给药24 h后不同浓度的黄芪总黄酮剂量组对RAW264.7细胞存活率的影响,从而拟定其试验剂量范围。由图1可知,黄芪总黄酮在0~100 μg/mL 浓度范围内无明显毒性,150 μg/mL剂量组出现显著毒性(P<0.05),200 μg/mL剂量组出现极显著毒性(P<0.01)。结果表明,10~100 μg/mL黄芪总黄酮对RAW264.7细胞没有明显的毒性作用。

图1 黄芪总黄酮对RAW264.7细胞毒性测定结果
2.2 黄芪总黄酮对RAW264.7细胞细胞因子IL-6、IL-1β、IFN-γ和TNF-α分泌的影响
根据黄芪总黄酮细胞毒性测定结果拟定10、25和100 μg/mL为本次试验的黄芪总黄酮安全剂量,分别为低剂量组、中剂量组和高剂量组。
由表1可知,黄芪总黄酮低剂量组中IL-6含量与空白组比较,在3、6、12和24 h时差异极显著(P<0.01);中剂量组与空白组比较,在3和6 h时差异显著(P<0.05)。

表1 黄芪总黄酮对RAW 264.7细胞分泌IL-6的影响
注:与空白组比较,#P<0.05,##P<0.01,下同。
由表2可知,黄芪总黄酮低剂量组中IL-1β含量与空白组比较,在3、6和12 h时,差异极显著(P<0.01),24 h时差异显著(P<0.05);中剂量组与空白组比较,在3 h时差异极显著(P<0.01),6 h时差异显著(P<0.05);高剂量组与空白组比较,在3 h时,差异极显著(P<0.01)。

表2 黄芪总黄酮对RAW 264.7细胞分泌IL-1β的影响
由表3可知,黄芪总黄酮低剂量组中IFN-γ含量与空白组比较,在3、6、12和24 h时差异极显著(P<0.01);中剂量组与空白组比较,在3 h和6 h时差异极显著(P<0.01)。由表4可知,黄芪总黄酮低剂量组中TNF-α含量与空白组比较,在3、6和12 h时差异极显著(P<0.01);中剂量组与空白组比较,在3 h时差异极显著(P<0.01)。结果表明,黄芪总黄酮能促进RAW264.7细胞分泌IL-6、IL-1β、IFN-γ和TNF-α 4种细胞因子,且呈一定量效关系。

表 3 黄芪总黄酮对RAW 264.7细胞分泌IFN-γ的影响

表4 黄芪总黄酮对RAW 264.7细胞分泌TNF-α的影响
2.3 黄芪总黄酮对正常条件下RAW264.7细胞细胞介质NO和PGE2分泌的影响
由表5可知,黄芪总黄酮低剂量组NO含量与空白组比较,在3和24 h时差异显著(P<0.05),在6和12 h时,差异极显著(P<0.01);中剂量组与空白组比较,在6和12 h时差异显著(P<0.05);高剂量组与空白组比较,在6 h时差异显著(P<0.05)。

表5 黄芪总黄酮对RAW264.7细胞分泌NO的影响
由表6可知,黄芪总黄酮低剂量组PGE2含量与空白组比较,在3、6、12和24 h时差异极显著(P<0.01);中剂量组与空白组比较,在6 h时差异显著(P<0.05)。结果表明:黄芪总黄酮能上调正常条件下RAW264.7细胞NO和PGE2的水平,且呈一定量效关系。

表6 黄芪总黄酮对 RAW 264.7 细胞分泌PGE2的影响
2.4 黄芪总黄酮对正常条件下RAW264.7细胞iNOS和COX-2蛋白表达的影响
由图2可知,黄芪总黄酮各剂量组iNOS蛋白含量与空白组比较,差异极显著(P<0.01)。由图3可知,黄芪总黄酮低剂量组COX-2蛋白含量与空白组比较,差异极显著(P<0.01)。结果表明,黄芪总黄酮能提高正常条件下RAW264.7细胞iNOS和COX-2蛋白的表达水平,且呈一定量效关系。

图2 黄芪总黄酮对RAW264.7细胞iNOS蛋白表达的影响
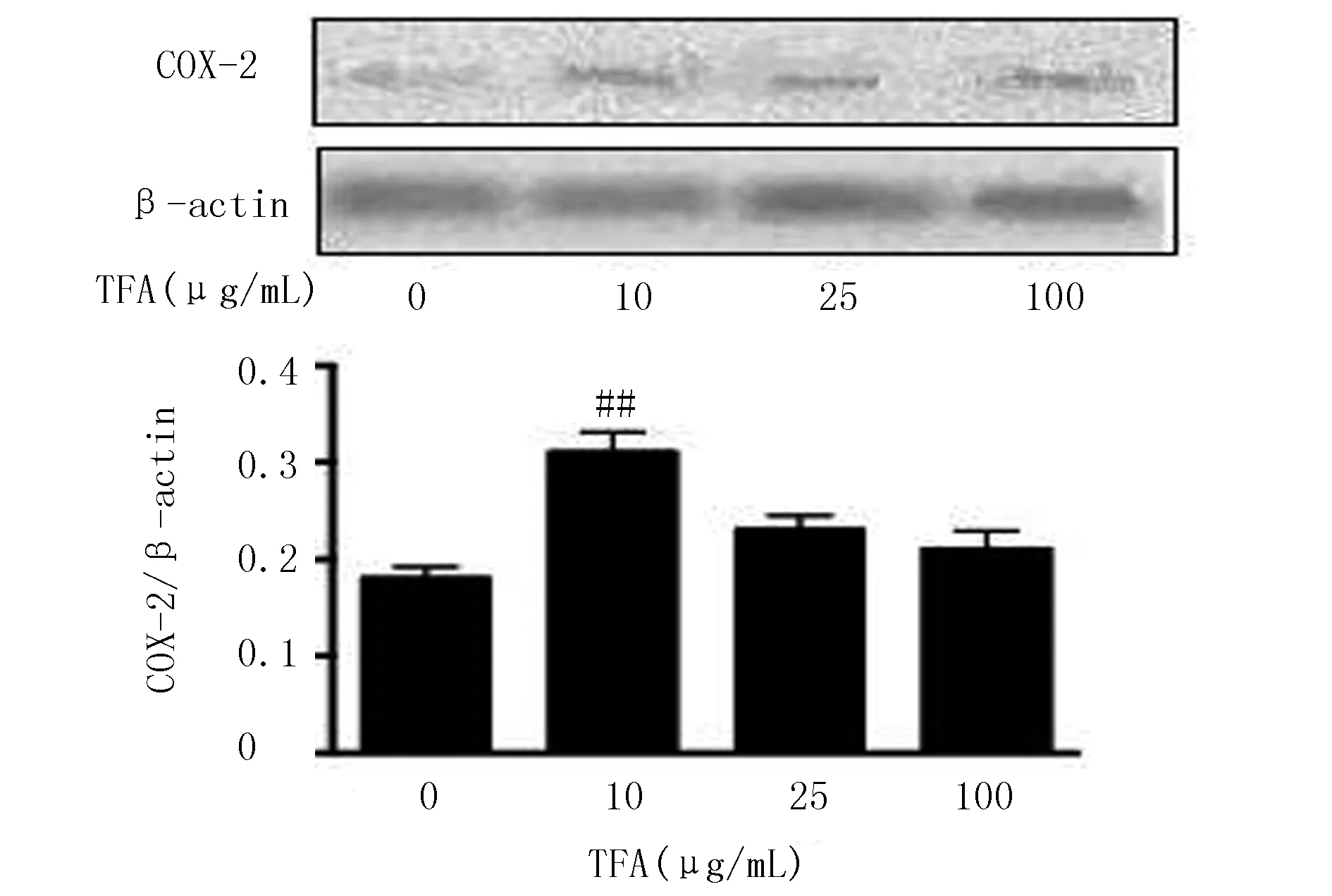
图3 黄芪总黄酮对RAW264.7细胞COX-2蛋白表达的影响
3 讨论与结论
免疫是动物机体的一种生理功能,机体靠这种功能识别“自己”和“非己”成分,从而破坏和排斥进入动物机体的抗原物质以维持机体的健康,抵抗或防止寄生虫的感染或其它微生物的侵入。当外界致病因素侵入时会激活机体的免疫应答,机体的免疫系统会做出识别、吞噬、清除等防御性反应[10]。
临床上针对免疫功能低下通常采用西药治疗,但由于多种药物本身能够不同程度地抑制机体免疫水平,降低机体免疫力,对一些重要的脏器有不同程度的损害[11]。因此,在增强免疫力方面应当着重开发高效、低毒的药物。中药具有调节激素的合成与分泌、调节免疫细胞功能、改善循环系统和提高机体防御屏障的效果[12-14]。同时,中药的毒副作用较低,治疗范围广,在开发免疫增强药方向具有很好的前景。试验以正常条件下RAW264.7细胞为体外模型,模拟机体在“无病”的情形下,黄芪总黄酮对细胞免疫因子的调控。
细胞因子是由细胞分泌产生的小分子蛋白,具有调节免疫应答及介导炎症反应的功能,如IL-6、IL-1β、IFN-γ和TNF-α等。这些细胞因子均具有多种生物活性的重要前炎症细胞因子,能协助调节免疫反应[15-17]。IL-6在组织中的表达比较广泛,又具有一定程度的组织特异性[18],是M2型细胞的标志性细胞因子,也是炎症反应初期的多功能细胞因子,适量释放可在免疫过程中起到调节作用[19]。IL-6还可以促进T、B细胞的增殖分化、急性期蛋白的产生和发热,在B细胞的分化及巨噬细胞的免疫应答过程中发挥重要作用。IL-1β是IL-1家族中最为重要的前炎性因子,IL-1β能够通过递呈细胞活化信号,激活补体系统、诱导B细胞活化同时可以激活T细胞及巨噬细胞,所以适量释放的IL-1β能调节机体免疫应答[20]。IFN-γ和TNF-α属于巨噬细胞极化为经典模式M1中的刺激因子,能够激活相应的模式受体从而活化巨噬细胞,活化信号通路进而参与机体的整体免疫调节[21]。IFN-γ作为II型干扰素,又称“免疫干扰素”,具有增强机体二次免疫应答、提高机体抵抗力和促进生长等作用[22],可以作用于病毒感染的组织细胞使其产生抗病毒蛋白,具有非特异性抗病毒、抗肿瘤及免疫调节等多方面功能[23-24]。TNF-α是一类具有双重活性的细胞因子,机体处于正常状态时,适量分泌的TNF-α能上调组织修复,增强免疫机能[25],参与机体天然免疫和获得性免疫,是特异性免疫性应答和炎症反应间的重要连接纽带,在宿主防御机制中发挥重要作用,可直接杀伤肿瘤细胞,同时还可以刺激一系列免疫调节介质的表达[26]。本试验中,通过ELISA测定结果表明,黄芪总黄酮低、中、高剂量组均能不同程度提高RAW264.7细胞IL-6、IL-1β、IFN-γ和TNF-α细胞因子的水平,且呈剂量依赖性,说明黄芪总黄酮具有提高RAW264.7细胞分泌免疫因子、增强机体免疫力的作用。
NO和PGE2是免疫应答过程中2种重要的细胞介质[27],NO是具有广泛生物活性的气体分子, 同时也是细胞间信息传递的重要调节因子, 具有介导细胞免疫的功能[28],对维持细胞正常生命活动起着十分重要的作用。内源性NO的合成是在NOS的参与下进行的[29],NOS分为结构型(nNOS、eNOS)和诱导型(iNOS)[30],其中iNOS主要在高活性的巨噬细胞和各种白细胞中表达,为NO的上游酶,能调控NO的表达[31]。PGE2是一类高活性的细胞介质,在机体稳态条件下几乎不表达[32-34]。但受到外界刺激时,会激活3个连续的酶促反应,微量的PGE2变化便会引起多种因子生物活性的改变,在免疫应答过程中起着非常重要的作用。PGE2是由COX催化花生四烯酸生成的,COX有3种形式存在,即COX-1、COX-2和COX-3,其中COX-2是诱导酶,受刺激后开始大量表达,主要催化介质PGE2的生成[35]。COX-2也可通过调剂血管内皮生长因子进而促进微血管通透性增加[36]。该试验中,通过Griess法和ELISA法分别对介质NO和PGE2测定的结果表明,黄芪总黄酮低、中、高剂量组均能不同程度提高这2种介质的水平,说明黄芪总黄酮作用于RAW264.7细胞后,可促进NO和PGE2的释放,同时通过Western blot法测定结果也表明,黄芪总黄酮能够提高iNOS和COX-2蛋白的表达水平,说明黄芪总黄酮能通过促进iNOS和COX-2的合成来提高NO和PGE2的生成量。
综上所述,黄芪总黄酮作用于RAW264.7细胞后,能促进其释放IL-6、 IL-1β、 IFN-γ和TNF-α等免疫细胞因子,同时也能提高NO和PGE22种细胞介质的含量且提高2种介质上游酶iNOS和COX-2蛋白的表达水平。说明,黄芪总黄酮对RAW264.7细胞具有免疫增强作用。
