LYRM1与LYRM2基因在白洗猪及其杜白杂交一代不同组织中的表达研究
2018-08-20骆金红苑洪霞
骆金红,苑洪霞 ,王 鑫,张 勇,陈 祥
(贵州大学高原山地动物遗传育种与繁殖教育部重点实验室,贵州省动物遗传育种与繁殖重点实验室,贵州大学动物科学学院,贵州贵阳 550025)
白洗猪又称苗寨猪,原产于施秉县白洗乡(今杨柳塘镇),是贵州省东南部的一个地方猪品种[1],具有肌纤维细腻、肌肉系水能力强[2]、不含氟烷基因[3]、生长缓慢、瘦肉率低[4]等特点。LYRM1 (LYR Motif Containing 1)基因是应用抑制性差减杂交技术从肥胖与正常人网膜脂肪组织中筛选出的差异性高表达基因,其开放阅读框369 bp,定位于人染色体16P11.2,mRNA全长1 589 bp,包含3个内含子和4个外显子,编码122个氨基酸[5-6],具有促进前体脂肪细胞增殖、抑制其凋亡的作用[6-7],可为提高瘦肉率以改善白洗猪肉质提供参考[8]。对白洗猪LYRM1基因5个外显子进行多态性分析发现,LYRM1基因不具多态性,在多个物种间进化上高度保守。与LYRM1基因一样,LYRM2(LYR Motif Containing 2)基因也是LYR复合体1超家族成员[9-10],定位于人类第6号染色体的长臂15区,在人类、小鼠、犬、大鼠和斑马鱼中高度保守,编码88个氨基酸[9,11]。目前,关于白洗猪、DBF1(杜洛克与白洗猪的杂交一代)猪的LYRM1和LYRM2基因的研究较少。因此,开展白洗猪、DBF1猪的LYRM1和LYRM2基因的研究对白洗猪种质资源开发及利用具有较高的价值。
1 材料与方法
1.1 实验动物 从白洗猪种质资源保护中心选取10月龄健康白洗猪8头、DBF1猪6头,屠宰后立刻采集心、肝、脾、肺、肾、胃、皮下脂肪、背最长肌,用锡箔纸包好并标记,保存液氮中,运回实验室,转入-80℃冰箱保存。
1.2 实验方法
1.2.1 组织RNA的提取与cDNA第1链的合成 采用Trizol法提取总RNA,HiFiScript cDNA第1链合成试剂盒逆转录mRNA获得cDNA,均用超微量紫外分光光度计和凝胶电泳分别测量其浓度和纯度。
1.2.2 引物的设计 根据GenBank提供的LYRM1基因序列(XM_005662096.2)、LYRM2基因序列(XM00 3121299.3)和GAPDH基因序列(NM_001206359.1)设计引物,引物由上海生物技术有限公司合成(表1)。
1.2.3 实时荧光定量PCR条件优化及反应 按照SYBR Green 1试剂盒推荐体系,在其他条件相同的情况下,对退火温度和引物浓度进行摸索、优化,筛选最佳退火温度和引物浓度。反应体系为10 μL:Master mix 5.8 μL,上、下游引物各 0.6 μL,cDNA 2 μL,ddH2O 1 μL。95℃ 预变性10 min,95℃变性 13 s;58℃退火28 s;72℃延伸32 s,43个循环,95℃,15 s,最后从60℃到95℃按0.5℃增值进行熔解曲线分析,荧光采集时间为5 s。本实验采用的最佳引物浓度为100 ng/μL,每个样品进行3管平行实验。
1.3 统计分析 应用 2-△△Ct法[12]分析 LRYM1、LYRM2基因在白洗猪和DBF1猪的心、肝、脾、肺、肾、胃、皮下脂肪、背最长肌中的表达水平。应用Excel 2013进行前期数据的排序等整理,应用SPSS 19.0中Duncan's法在0.01和0.05水平进行差异显著性分析。
2 结果与分析
2.1 组织 RNA的特异性检测 提取RNA的A260/A280均在1.8~2.0,表明提取的RNA质量较好;凝胶电泳鉴定发现28 s、18 s条带清晰、未出现拖尾和降解(图1),满足下一步实验要求。
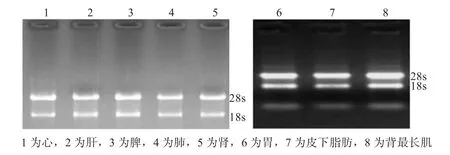
图1 不同组织LYRM1、LYRM2和GAPDH基因提取RNA的凝胶电泳图
2.2 LYRM1、LYRM2基因各组织PCR扩增产物的检测用反转录获得的组织cDNA为模板进行普通PCR扩增,用1.5%的琼脂糖凝胶电泳检测扩增产物(图2),可见产物清晰度高、特异性强,未发现有引物二聚体,且扩增片段与目的片段大小一致,可用于下一步实验。
2.3 实时荧光定量PCR产物特异性 扩增反应结束后,LYRM1、LYRM2基因扩增曲线均呈现“S”形,无明显上扬趋势且整体平行性较好(图3);LYRM1、LYRM2基因熔解温度分别是76.7、76.1℃,熔解曲线均呈单峰,无引物二聚体,无杂峰,符合实验要求。

图2 LYRM1、LYRM2和GAPDH基因普通PCR验证凝胶电泳图
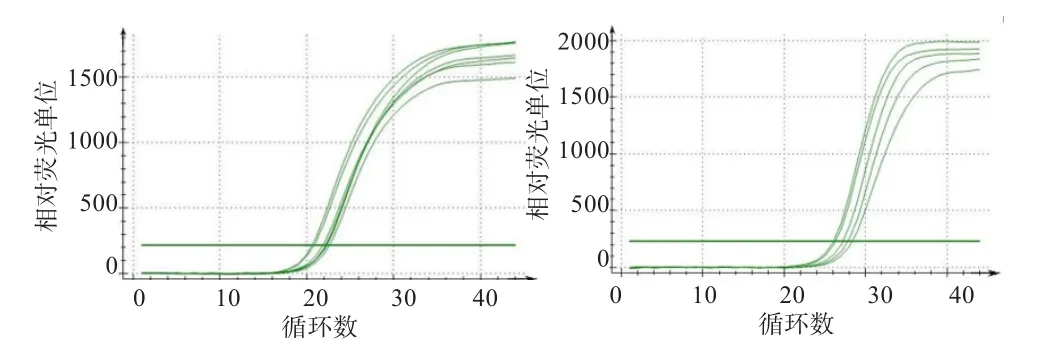
图3 LYRM1(左)、LYRM2(右)基因扩增曲线
2.4 LYRM1基因在白洗猪和DBF1猪不同组织中的表达 LYRM1基因表达量的分析发现,LYRM1基因在白洗猪和DBF1猪心、肝、脾、肺、肾、胃、皮下脂肪、背最长肌中均有表达,在皮下脂肪组织中高表达,在背最长肌低表达(图4)。
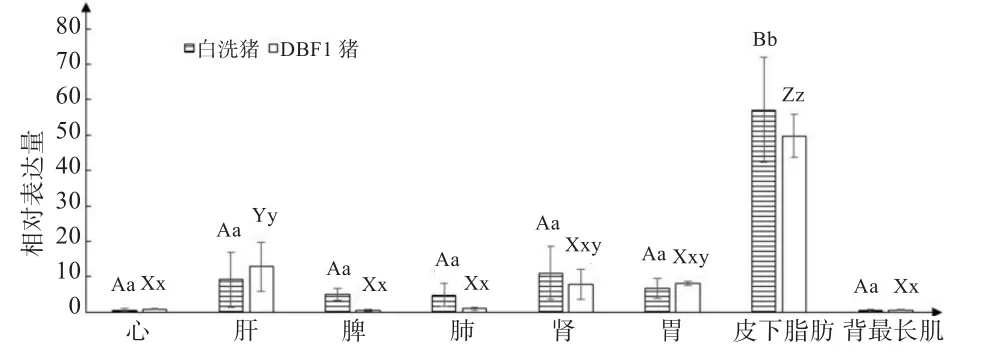
图4 LYRM1基因在白洗猪和DBF1猪8个组织中的相对表达量
LYRM1基因表达量在白洗猪中8个组织中高低顺序为皮下脂肪>肾>肝>胃>脾>肺>心>背最长肌,其中,皮下脂肪组织中表达量极显著高于其他各组织(P<0.01),其他各组织之间无显著差异。LYRM1基因表达量在DBF1猪中高低顺序为皮下脂肪>肝>胃>肾>肺>心>脾>背最长肌,皮下脂肪组织中表达量极显著高于其他各组织(P<0.01),除皮下脂肪,胃、肾、肝表达量显著高于心、脾、肺、背最长肌(P<0.05),其中,肝与其他各组织达到差异极显著水平(P<0.01)。LYRM1基因表达量在白洗猪和DBF1猪各组织间均未达到差异显著水平。
2.5 LYRM2基因在白洗猪和DBF1猪组织中的表达LYRM2基因在白洗猪和DBF1猪8个组织中均有表达,且表达趋势为皮下脂肪组织中最高,背最长肌中最低,且皮下脂肪中表达量与其他各组织差异极显著(P<0.01)(图5)。在白洗猪中,LYRM2基因表达量高低顺序为皮下脂肪>脾>肝>肾>肺>心>胃>背最长肌,除皮下脂肪,脾、肝中表达量显著高于心、胃、肾、肺、背最长肌(P<0.05)。在DBF1猪中,LYRM2基因表达量高低顺序为皮下脂肪>肾>肺>胃>肝>心>脾>背最长肌;除皮下脂肪,胃、肾、肺中表达量显著高于心、脾、肝、背最长肌(P<0.05),其中肾中表达量与其他6个组织中表达量差异极显著(P<0.01)。白洗猪皮下脂肪中LYRM2基因表达量显著高于DBF1猪(P<0.05)。

图5 LYRM2基因在白洗猪和DBF1猪8个组织中的相对表达量
3 讨 论
本实验采用SYBR Green I荧光嵌合染料法[13-14]检测白洗猪和DBF1猪LYRM1、LYRM2基因 mRNA的相对表达量,实验熔解曲线呈单峰且无其他杂峰,表明所用引物特异性良好[15]。LYRM1基因是在人网膜脂肪组织中高度表达的基因,具有抑制前体脂肪细胞的凋亡、促进前体脂肪细胞增殖的功能[6]。但是,LYRM1基因过表达则会下调3T3-L1 脂肪细胞中线粒体的代谢关键酶基因表达水平,提示LYRM1基因可能参与调节脂肪细胞线粒体的代谢,从而影响脂肪细胞的凋亡和增殖[16]。张翔等[17]发现,白藜芦醇可能通过降低LYRM1 mRNA水平来抑制3T3-L1前脂肪细胞增殖。邱洁等[5]应用在线分析工具分析LYRM1基因的mRNA序列,发现存在多个与肥胖密切相关的转录因子结合位点,提示该基因可能受到其他脂代谢调节基因的调控。Li等[18]发现,LYRM1基因可能通过脂肪沉积对秦川牛肉质性状有潜在的影响,可用于标记辅助选种。本实验结果发现,LYRM1 mRNA在白洗猪和DBF1猪心、肝、脾、肺、肾、胃、皮下脂肪、背最长肌均有表达,总体趋势趋于一致,均在皮下脂肪组织中表达最高,背最长肌组织中表达最低,与邱洁等[6]的研究结果相一致。白洗猪皮下脂肪组织中LYRM1基因表达水平均高于DBF1猪,推测白洗猪瘦肉率低可能与LYRM1基因高表达有关,杂交有望提高DBF1猪瘦肉率。
LYRM2和LYRM1基因同是LYR复合体1超家族成员[9-10],这个家族被认为可能参与了真核细胞NADH复合体的组成。本实验发现,LYRM2基因在白洗猪和DBF1猪中均有表达,且在皮下脂肪组织中表达最高,背最长肌中表达最低,与LYRM1基因在白洗猪和DBF1猪中表达情况类似。白洗猪和DBF1猪皮下脂肪组织中,LYRM1基因表达量均高于LYRM2,推测LYRM1基因在皮下脂肪沉积中较LYRM2基因发挥着更大的作用。
4 结 论
本实验研究显示,LYRM1和LYRM2基因表达均高于白洗猪和DBF1猪的皮下脂肪组织,相对低于背最长肌,且表达趋势趋于一致,LYRM1基因在白洗猪皮下脂肪组织中表达水平略高于DBF1猪,LYRM2基因在白洗猪皮下脂肪组织中的表达水平显著高于DBF1猪。本研究结果表明,LYRM1与LYRM2基因可能为影响猪脂肪沉积的候选基因。
