高固形物浓度对风味蛋白酶催化制备改性大豆分离蛋白功能特性的影响
2018-08-19陈穗王海萍崔春
陈穗,王海萍,崔春
(1.广东美味鲜调味食品有限公司,广东中山 528437)(2.华南理工大学食品科学与工程学院,广东广州 510640)
大豆分离蛋白(soy protein isolate,SPI)具有价格低廉、蛋白含量高和氨基酸比例均衡等特点,已被广泛应用于食品加工的各个领域,是目前我国大豆蛋白市场上产量最大、应用最广泛的一种大豆蛋白产品。但是由于大豆分离蛋白中存在抗原性成分(7S,11S)和蛋白酶抑制因子,直接食用则会影响其消化吸收,因此限制了大豆分离蛋白的使用。为了解决这种问题,目前人们通常以大豆分离蛋白为原料,通过控制酶解技术制备改性大豆蛋白(mSPI)[1]、功能性大豆肽[2,3]和高品质呈味基料[4]来达到高度利用大豆蛋白的目的。酶法改性指的是将蛋白质在酶制剂(植物蛋白酶、动物蛋白酶或微生物蛋白酶)的作用下,肽键断裂,大分子被切割成小分子,从而形成某些特殊的基团,以此来改善蛋白质的某些功能特性[5]。研究表明,影响大豆蛋白酶解反应的因素主要有:底物浓度、酶解温度、酶与底物浓度比、pH值、是否存在激活剂和抑制剂[6~8]。
底物浓度,即固形物浓度,指的是酶解反应中底物在酶解体系中所占的比例。一般而言,常规酶解技术中底物蛋白质的浓度在8%~16%之间。本文中高底物浓度指底物蛋白质的浓度在24%~32%之间。与常规浓度酶解技术相比,高固形物浓度酶解反应具有终产物浓度高、废水产量少、冷却和浓缩能耗低、设备尺寸小等优点[9,10]。目前利用蛋白酶酶解技术对大豆蛋白改性提高其乳化性、起泡性等功能特性已有较多研究成果,然而迄今为止尚未见高浓酶解技术对大豆蛋白进行改性的研究报道。因此,本文拟利用风味蛋白酶对不同浓度的大豆分离蛋白进行酶法降解制备系列改性大豆蛋白,探讨不同固形物浓度对大豆蛋白功能特性的影响。
1 材料与方法
1.1 原料
大豆分离蛋白,购于山东香驰豆业科技有限公司;风味蛋白酶MG500,中国诺维信公司提供;金龙鱼调和油为市购。
1.2 仪器
Sartorius BP211D分析天平,德国赛多利斯仪器公司;600高效液相色谱仪,美国waters公司;KDN-103F微量凯式定氮仪,上海纤检仪器有限公司;八孔消化炉,上海纤检仪器有限公司;LGJ-1冷冻干燥机,上海医用分析仪器厂;UV1810S紫外可见分光光度计,上海佑科仪器仪表有限公司。
1.3 试剂
氢氧化钠、盐酸、硼酸、硫酸、硫酸钾、甲醛、溴甲酚绿、甲基红、十二烷基磺酸钠、甘氨酸、β-巯基乙醇、丙烯酰胺、四甲基乙二胺、三羟甲基氨基甲烷、过硫酸铵、考马斯亮蓝 R-250、磷酸二氢钠、磷酸氢二钠等试剂来自阿拉丁试剂公司,均为分析纯。
1.4 实验方法
1.4.1 轻度酶解大豆分离蛋白制备不同水解度的改性SPI
分别称取8、16、24、32 g的大豆分离蛋白,缓慢倒入100 mL的水中,边倒边缓慢搅拌,直至将其制成均匀的溶液,将溶液的pH调到6.5后,添加大豆分离蛋白质量1%风味蛋白酶,50 ℃分别酶解(摇床震荡)不同的时间,水解结束后沸水浴20 min灭酶,之后快速冷却酶解液,该过程对于酶解液中的蛋白质以及酶解之后的肽都会产生影响,使蛋白质发生部分聚集,从而影响其功能特性,由于未酶解和酶解的蛋白均采取沸水浴灭酶处理,故其影响程度相当,且所有的测定都具有可比性。取部分灭酶后的样品不离心直接测定水解度,其余样品进行冷冻干燥,得改性大豆分离蛋白粉,密封于干燥器中备用。
水解度(DH)是水解过程中断裂的肽键数占总肽键数的百分比。DH(%)=(水解后生成的α-氨基氮/样品总氮)×100%。其中,水解后生成的α-氨基氮由甲醛滴定法测得,样品总氮由凯氏定氮法测得。
1.4.2 酶解产物分子量分布测定
参考 Cui等[8]的方法。采用 TSK-Gel G400sw(7.5*600 mm)分析柱;洗脱液为含0.2 M氯化钠的50 mmol/L pH 6.8的磷酸盐缓冲液,流速为1 mL/min,检测波长为214 nm。柱温为25 ℃,分析时间为45 min。
1.4.3 酶解产物溶解性(NSI)测定
称取300 mg冻干酶解产物分散于30 mL的去离子水中,用1 mol/L的氢氧化钠或者盐酸溶液调节酶解产物溶液的pH值,25 ℃搅拌30 min后8000 r/min离心20 min,去除沉淀。用凯氏定氮法测上清液总氮含量。结果用氮溶解指数溶解性(NSI)来表示,定义为上清液的总蛋白含量与原料总蛋白含量的比值。
1.4.4 分散稳定性的测定
参照王章存等[11]的方法,将冻干蛋白酶解产物配制为浓度1.0 mg/mL溶液,用分光光度计测定大豆分离蛋白溶液在280 nm处吸光值,将初始吸光值和10 min后的吸光值分别记为Amax和Amin,二者的比值反映酶解产物的分散稳定性,比值越小,说明样品分散越稳定。分散稳定性%=Amax/Amin×100。
1.4.5 持水力(WHC)的测定持水力为每克大豆蛋白酶解产物结合的去离子水的质量(g)。参照唐传核[12]的方法,准确称取大豆蛋白酶解产物(0.2 g)于10 mL的离心管中,记离心管和蛋白的总重为W1,缓慢加入4 mL的去离子水,涡旋振荡分散至无明显颗粒,静置30 min后3000 r/min离心
20 min,倒掉上清液,称取离心管质量记为W2,即蛋白质、水、离心管的总重量,持水力计算公式为:
WHC=(W2-W1)/m。
1.4.6 乳化性的测定
乳化性测定方法参照Pearce等[13]的方法并做适当的修改。将蛋白样品配制为1%样品溶液9 mL,水化30 min,加入3 mL玉米油,10000 r/min高速剪切2 min,制成乳化液。然后立即在烧杯底部吸取 50 μL乳状液,加入至5 mL 0.1% SDS溶液中,涡旋振荡混合均匀。以0.1% SDS溶液为空白,测定500 nm下吸光值。蛋白乳化性以乳化活力指数EAI表示:
EAI(m2/g)=(2×2.303×A500/(φ×L×C))×N×10-4
其中,EAI是每克蛋白质的乳化面积(m2/g);φ:体系中油相所占的体积分数(本实验中为0.25);N:稀释倍数(本实验中为100);C:蛋白浓度(g/mL);L:比色池光径(1 cm)。
1.4.7 起泡性和起泡稳定性的测定
参照 MartaCorzo-Martínez[14]的实验方法进行测定。
1.4.8 数据统计与分析
所有测定数据重复三次,结果表示为平均值±标准偏差,使用SPSS 16和EXCEL软件进行数据分析。
2 结果与讨论
2.1 固形物浓度对mSPI蛋白分子量分布的影响

图1 固形物浓度对改性大豆分离蛋白酶解产物分子量分布的影响Fig.1 Influence of the solid concentration on the molecular weight distribution of the SPI hydrolyzate by Flavourzyme
固形物浓度对mSPI分子量分布的影响规律见图1。图1a为不同水解度下,8%和32%浓度下mSPI的分子量分布图。由图1a可见随着水解度的增大,mSPI中大分子的肽段含量逐渐减少,小分子肽段的含量逐渐增多。在固形物浓度为8%时,当水解度从7%增大为10.3%时,水解产物中分子量小于10 ku的肽段含量从34.37%增长为42.64%。图1b为相同水解度下,不同固形物浓度对mSPI分子量分布的影响。由图1b可见,在水解度相同的条件下,在8%和16%浓度下mSPI的分子量分布差异较小,当固形物浓度达到24%和32%时,mSPI中小于10 ku的肽段组分含量减小。这表明高浓体系条件下制备的mSPI中小分子组分明显低于低浓体系,这可能是因为在高浓条件下体系粘度大物质交换受到阻碍,限制了大分子物质的降解
[15]。
2.2 固形物浓度对mSPI溶解性的影响

图2 固形物浓度对风味蛋白酶酶解产物溶解性的影响Fig.2 Influence of the solid concentration on the NSI of the SPI hydrolyzate by Flavourzyme
溶解性(NSI)是SPI的重要功能特性之一,是其乳化性、起泡性和凝胶性等其他功能特性的基础,而蛋白质酶解是提高蛋白溶解性的常用手段。一般而言,pH值是影响蛋白溶解性的重要因素之一,大豆分离蛋白在其等电点附近溶解性很低,这就限制了其在酸性食品如饮料、酸奶等中的应用,因此提高大豆蛋白在酸性条件下的溶解性成为大豆蛋白改性研究的热点。图2为不同固形物浓度不同水解度下制备的mSPI在中性和酸性条件(pH 7.0,pH 4.0)下溶解性。
由图2可知,在中性条件下和酸性条件下,风味蛋白酶制备的mSPI的溶解性与水解度呈正相关,且与酶解体系的固形物浓度无关,在同一水解度条件下,随着底物浓度的增加,溶解性并未呈现显著性变化。这与Hardt等人利用风味蛋白酶酶解小麦面筋蛋白的研究结果一致[16]。mSPI在中性条件下溶解性由原料的 40.7%提高到 54.6%(DH7%)和 64.25%(DH10.87%),分别提高了34.5%和58.3%。在酸性条件下时,溶解性分别由原料的 27%提高到 47.54%(DH7.00%)和 56.16%(DH10.87%),分别提高了76.1%和1.08倍。这主要是因为SPI在风味蛋白酶的催化下SPI的肽键断裂,形成许多小分量的寡肽及多肽,极性增大。
2.3 固形物浓度对mSPI分散稳定性的影响

图3 固形物浓度对风味蛋白酶酶解产物分散稳定性的影响Fig.3 Influence of the solid concentration on the dispersion stability of the mSPI by flavourzyme
目前文献中对mSPI功能特性的研究往往局限于其可溶性部分,而实际上,mSPI只要在水中有很好的分散性就可大大拓展其在实际生产中的应用,如用于肉脯、火腿肠等凝胶型食品和蛋白饮料等液体型食品的开发中。图3a、3b为mSPI在中性和pH 4.0条件下的分散稳定性图。由图3可见,在同一固形物浓度下,随着水解度的增大,mSPI在中性和酸性环境下分散稳定性均增大,这主要是因为酶解越深,蛋白分子越小,在水中分散性越好,易溶于水而不至于沉淀。其中,在酸性条件下随水解度增大,mSPI分散稳定性增加最为明显。24%浓度下制备得到的mSPI,其分散稳定性为83.63%(DH10.87%)为原料的1.55倍。此外,无论是在中性还是酸性条件,mSPI的分散稳定性随着酶解固形物浓度的增加而提高(无显著性差异)。这与王章存等研究固形物浓度对碱性蛋白酶酶解小麦面筋蛋白分散性的结论一致。
2.4 固形物浓度对mSPI持水力的影响
由图4所示,SPI原料的持水性最高,改性大豆分离蛋白的持水力均低于原料蛋白。原料蛋白持水力为4.26 g/g;mSPI(固形物浓度32%,DH6.47%)的持水力为 4.19 g/g。这主要是因为大豆分离蛋白在复水时形成凝胶网络结构,而经过酶解作用后,小分子肽增多,不利于形成蛋白质网络结构,从而持水力下降[17]。此外,随着水解度的增大,mSPI的持水力呈下降趋势,而在相同水解度下,随着酶解固形物浓度的提高,mSPI的持水力呈上升趋势。其原因是高浓度条件下,酶解产物中大分子量的蛋白质和多肽含量更多。

图4 固形物浓度对风味蛋白酶酶解产物持水力的影响Fig.4 Influence of the solid concentration on the water binding capacity of the SPI hydrolyzate by Flavourzyme
2.5 固形物浓度对mSPI乳化性的影响
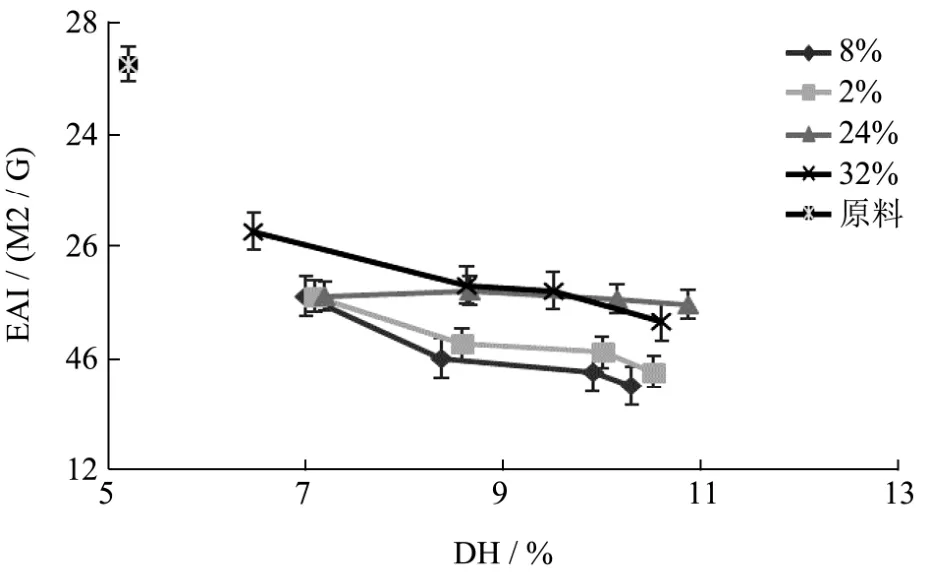
图5 固形物浓度对风味蛋白酶酶解产物乳化活性的影响Fig.5 Influence of the solid concentration on the emulsifying ability of the SPI hydrolyzate by Flavourzyme
表面活性是大豆分离蛋白最基本的性质之一,而乳化性是其非常重要的表现形式,它可以吸附在油水界面,降低界面张力,在油水混合时起到乳化的作用,形成多分散体系,这主要是由蛋白质分子链内部分布的亲水或疏水基团所决定的。
由图5可知,mSPI的乳化活性低于原料蛋白,且水解度越大乳化活性越低。这是因为随着水解度的提高,大分子蛋白降解为小分子多肽,亲水性基团大量暴露而疏水性基团被破坏,使得油滴表面的保护层变薄,产物乳化性降低。由于高浓环境下,分子之间的空间较为拥挤,限制了大分子蛋白分解为小分子肽,因而其产物乳化活性高于低浓环境下的酶解产物。
2.6 固形物浓度对酶解产物起泡性和起泡稳定性的影响

图6 固形物浓度对风味蛋白酶酶解产物起泡性和泡沫稳定性的影响Fig.6 Influence of the solid concentration on the foaming capacity of the SPI hydrolyzate by Flavourzyme
固形物浓度对改性大豆分离蛋白起泡性和起泡稳定性的影响如图6所示。由图6a可知原料大豆分离蛋白起泡性较差,而酶解产物起泡性均有所提高,且随着水解度的提高,起泡性大致呈先升高再降低的趋势,而最佳水解度的差异可能与原料的不同及水解度测定方法差异有关。酶解初期起泡性升高主要是因为液膜的形成是蛋白质肽链相互作用的结果,蛋白分子在酶的作用下肽链展开,溶解性提高,更多的肽参与到液膜的形成,从而使得起泡性增强。而随着水解度的进一步提高,形成的肽链越小,不足以稳定液膜,泡沫易破裂,起泡性随之降低。此外,起泡性的高低与可溶性蛋白的含量、分子量、结构等密切相关,是多种影响因素共同作用的结果。
当水解度<8%时,低浓度酶解产物起泡性高于高浓,而水解度超过 8%时,高浓酶解产物起泡性大体高于低浓酶解产物。可能的原因是,低水解度下,低浓酶解产物溶解性较高,分子量小于高浓,蛋白质分子大小合适,当水解度进一步增大时,低浓条件下蛋白分子过小而高浓由于酶解受到限制而获得合适大小的蛋白质分子而具有较高起泡性。
通过图6b可知,酶解处理降低了大豆分离蛋白的泡沫稳定性,且高浓条件下酶解产物泡沫稳定性高于低浓,其原因可能是酶解使得产物中小分子肽段增多,疏水基团暴露导致液膜变得脆弱,且小分子肽段的形成增加了蛋白分子电荷量,静电作用阻碍蛋白质分子的吸附作用,从而使得泡沫稳定性下降。
3 结论
本文利用风味蛋白酶酶解不同固形物浓度的大豆分离蛋白,并对酶解产物的功能特性进行了分析,结论如下:
(1)大豆分离蛋白经过风味蛋白酶控制酶解制备的mSPI,其产物溶解性、分散稳定性、起泡性均提高,持水力、乳化性、起泡稳定性降低。
(2)在相同水解度下,随着固形物浓度的提高,mSPI的分散稳定性、持和水力和乳化性均呈上升趋势。当水解度<8%时,低浓度酶解产物起泡性高于高浓,而水解度超过 8%时,高浓酶解产物起泡性大体高于低浓酶解产物,而就起泡稳定性而言前者也高于后者,以上说明高浓和常浓状态酶解模式存在差异性。
(3)风味蛋白酶催化制备的mSPI的溶解性与酶解固形物浓度无明显关系。