野葛根酸性多糖的结构鉴定及免疫活性
2018-08-19董洲李惠娴张猛猛赖富饶张晓元吴晖
董洲,李惠娴,张猛猛,赖富饶,张晓元,吴晖,
(1.华南理工大学食品科学与工程学院,广东广州 510640)(2.韶关市华工高新技术产业研究院,广东韶关 512027)
葛根是豆科葛属多年生落叶藤本植物的块根,药食同源,分为粉葛和野葛。粉葛富含淀粉,是重要的食材及食品添加剂;野葛为中医中常用的祛风解毒药,始载于《神农本草经》,具有解肌退热、生津、透疹和升阳止泻等功效。因富含异黄酮类、多糖类、氨基酸及微量元素等物质,素有“南方人参”的美誉。现代科学已证明其具有广泛的药理和保健功能,其有效成分在维持心血管系统稳定性、保护脑神经、抗氧化、防止肝肾损伤、改善代谢与免疫功能等方面均有一定的药理作用,葛根黄酮具有改善心脑血液循环,扩张冠状动脉,降血压,降血糖等作用;大豆苷元有明显抗心律失常作用,抑制白血细胞的增殖及黑色素瘤细胞的分化,具有可观的临床应用前景[1,2]。
多糖是构成生命的四大基本物质之一,由多个单糖分子缩合、失水而成,是一类分子结构复杂且庞大的糖类物质。分子量从几万到几千万,具有许多生物活性,包括抗感染、抗肿瘤、增强免疫、降血糖和抗病毒等作用。多糖广泛存在于高等植物、动物细胞膜、微生物细胞壁中,不但是生物体的重要组成部分还参与多种生理功能[3~5]。
野葛根多糖是一种天然的高分子聚合物,安全无毒,具有显著的生物活性和广泛的药理作用,是潜在的辅助治疗肿瘤药物以及其它重要保健品的原材料[6~9]。国内外针对葛根的研究主要集中于其中黄酮类物质的生物活性,以及葛根多糖的抗氧化性研究,对于野葛根多糖的免疫活性研究却鲜有报道。
本文以野葛根为原料,对其多糖进行分离纯化,结构鉴定,免疫活性的研究,为野葛根多糖在食品和医药领域的应用与开发奠定扎实基础,指明出新的方向。
1 材料与方法
1.1 试剂与材料
野葛根购于广州清平中药材市场;碳酸氢钠、无水乙醇、苯酚、硫酸、氯化钠、氯仿、正丁醇(均为分析纯),广东光华科技股份有限公司;重水分析纯Damas-beta;刚果红、甲基红、溴甲酚绿(均为分析纯),天津大茂化学试剂厂;PBS磷酸缓冲液,Gibco公司;葡聚糖标准品,美国Sigma公司;羊血鸿泉生物;小鼠IL-6 Elisa试剂盒、小鼠TNF-αElisa试剂盒,欣博盛生物科技有限公司;一氧化氮(NO)测试盒,南京建成生物工程研究所等。
1.2 仪器与设备
JC101型不锈钢鼓风干燥箱,上海福玛实验设备有限公司;BSZ-16OF自动部份收集器,上海精科实业有限公司;SCIENTZ-18N低温冷冻干燥机,宁波新芝生物科技股份有限公司;凝胶渗透色谱柱,美国Waters公司;气相色谱仪,美国惠普公司;傅里叶变换VERTEX33红外光谱仪,Brucker公司;紫外-可见分光光度计,上海棱光技术有限公司;扫描电子显微镜(Scanning Electron Microscope,SEM)S-3700N,日本日立公司;HP4890D气相色谱仪,美国惠普公司;600 MHz核磁共振波谱仪(Nuclear Magnetic Resonance,NMR),Brucker公司等。
1.3 试验方法
1.3.1 野葛根粗多糖的提取
将野葛根用粉碎机粉碎后过120目筛,过筛后加入80%的乙醇,85 ℃冷凝回流2.5 h进行脱脂处理。称取脱脂后葛根20 g,按料液比1∶30,在99 ℃条件下搅拌浸提2.5 h后,离心(3000 r/min,10 min),取上清液旋转蒸发浓缩至1/3~1/5体积,以Sevag法除蛋白,离心(3000 r/min,10 min)去除中间有机相与水相交界处乳化层,合并上清液,加入4倍的无水乙醇沉淀多糖,4 ℃条件下静置过夜,离心(3000 r/min,10 min)收集沉淀,收集的沉淀物用蒸馏水复溶,透析48 h后冻干得野葛根粗多糖[10~11]。
1.3.2 野葛根粗多糖的纯化
准确称取100 mg上述野葛根粗多糖干品充分溶解于10 mL无菌水中,用胶头滴管将配好的粗多糖溶液全部滴加上样至 DEAE-Sepharose Fast Flow(3.6 cm×20 cm)纤维素阴离子交换层析柱中,依次用0,0.1,0.2,0.3,0.5 mol/L NaCl溶液洗脱,流速 1 mL/min,每管收集10 mL,苯酚-硫酸法跟踪显色定性,将洗脱液分开收集,浓缩,透析,冷冻得到不同野葛根多糖组分;称取20 mg的干品溶于4 mL超纯水后,上样至Sephacryl S-200 HR凝胶柱(1.6 cm×70 cm)中,蒸馏水洗脱,流速0.4 mL/min,每管5 mL,苯酚-硫酸法跟踪显色,洗脱液收集,浓缩、透析、干燥得到较纯的野葛根多糖GE-2。
1.3.3 GE-2的分子量及纯度测定[12]
采用高效凝胶渗透色谱法对GE-2的分子量进行测定。样品与不同分子质量的葡聚糖标准品用 0.02 mol/L的KH2PO4溶液配制成1.0 mg/mL的溶液,过0.45 μm滤膜,上样20 μL,检测45 min,色谱条件:TSK G-5000PWXL凝胶柱(7.8 nm×300 mm)和TSK G-3000PWXL凝胶柱(7.8×300 mm)串联,流动相0.02 mol/L的KH2PO4缓冲溶液,pH 6.0,流速0.6 mL/min,柱温35 ℃,所用检测器为2414示差检测器。
1.3.4 电子显微镜扫描(SEM)[13]
将制得的少量样品GE-2分散固定在金属样品台上,清除多余的不能被粘附在样品台上的粉末,使得样品台上保留一层薄薄的待测样品。将黏附有样品的样品台置于镀膜仪中镀金后,在扫描电子显微镜下放大不同的倍数来观察样品的表面结构。
1.3.5 紫外全波段扫描[14]
称取一定量的野葛根多糖GE-2,配成浓度为0.05 mg/mL的溶液,用UV2300紫外可见光分光光度计在190~400 nm下进行连续扫描,扫描间距为0.5 nm,以蒸馏水为空白绘制紫外扫描光谱图,并对其进行分析。
1.3.6 红外光谱分析[15]
称取少量的GE-2样品(1~5 mg),与适量的干燥的KBr粉末混和,研磨均匀后压片。将制好的压片置于傅里叶变换红外光谱仪中在 4000~400 cm-1范围内进行红外扫描,对采集到红外吸收图谱进行分析。
1.3.7 单糖组成测定[16,17]
1.3.7.1 GE-2水解
称取10 mg GE-2于安瓿瓶中,加入4 mL 2 mol/L三氟乙酸(TFA),将安瓿瓶封口后置于110 ℃下反应6 h。反应完后,冷却至室温,减压旋干TFA,加入1 mL甲醇混合后,继续蒸干,重复3次。
1.3.7.2 衍生化反应
向GE-2的水解物中加入1 mL吡啶和10 mg盐酸羟胺,置于90 ℃下恒温震荡反应30 min反应完后冷却,加入1 mL醋酸酐,于90 ℃下进行乙酰化反应30 min,最终生产糖腈乙酸酯衍生物,冷却过有机膜,转移至进样瓶待测。所有的单糖标准品和混标也按照上述步骤进行衍生化并转移至进样瓶中待测。
1.3.7.3 GC条件
使用Agilent HP-5毛细管柱(30 m×320 μm×0.25 μm);载气为N2,载气流量为20.0 mL/min,进样量为1.0 μL,分流比为 10∶1。程序升温:165 ℃后以0.5 ℃/min变速升至171 ℃,再以1 ℃/min速度升温至180 ℃。
1.3.8 三螺旋结构[20]
5 mg GE-2加入2 mL去离子水和2 mL 80 μmol/L刚果红试剂,逐渐加入4.0 mol/L NaOH,使溶液中减浓度在0~0.5 mol/L,用400~600 nm进行紫外扫描,测各碱性条件下最大吸收波长。
1.3.9 核磁共振谱分析[21~23]
称取50 mg左右的GE-2溶于600 μL重水中,震荡混匀使其完全溶解后转移至核磁管中,于核磁共振仪上进行一维1H谱、13C谱测量分析。
1.3.10 GE-2的免疫调节活性研究[24]
1.3.10.1 GE-2溶液的配制
将GE-2用DMEM培养基溶解后配成1 mg/mL的母液,并等梯度稀释成1000 μg/mL、500 μg/mL、250 μg/mL、125 μg/mL 和 62.5 μg/mL 五个剂量组。
1.3.10.2 细胞培养
解冻小鼠巨噬细胞 RAW264.7,迅速将解冻细胞转移到15 mL的无菌离心管,加入12 mL DMEM培养基,混匀后低速离心(1000 r/min,5 min)。除去培养基,加入新鲜的培养基,将细胞悬浮后转移至细胞培养瓶中。置于CO2培养箱中培养(37 ℃,5% CO2),每隔两天换一次培养基。
1.3.10.3 GE-2对小鼠巨噬细胞RAW264.7分泌细胞因子的影响
将处于对数生长期的RAW264.7细胞用胰蛋白酶消化后,配成细胞浓度为1×106个/mL的细胞悬液,反复吹打均匀后接种于 96孔板中(100 µL/孔),置于CO2培养箱培养使细胞重新贴壁。24 h后,吸去培养基,加入100 µL 不同浓度(1000 μg/mL、500 μg/mL、250 μg/mL、125 μg/mL 和 62.5 μg/mL)的 GE-2 溶液,阳性对照组加入100 µL脂多糖(20 μg/mL),空白组加入100 µL DMEM培养基,每组设3个平行孔。将细胞放回CO2培养箱中培养24 h,用一氧化氮检测试剂盒和Elisa试剂盒测定细胞上清液中NO和细胞因子(TNF-α和IL-6)的表达量。
1.3.11 数据处理
所有实验平行测定3次,采用Origin 8和SPSS 19.0软件对实验数据进行分析。
2 结果与分析
2.1 野葛根多糖离子交换柱层析
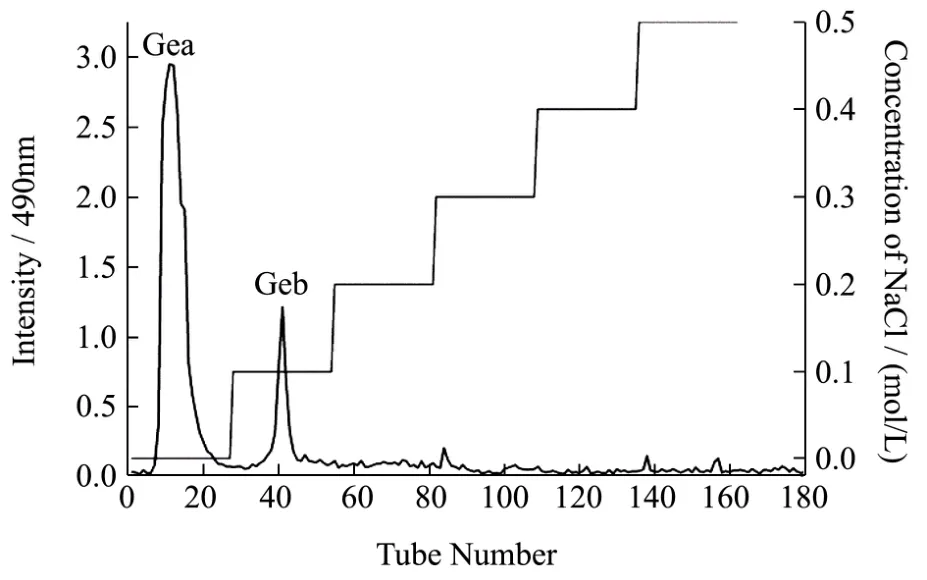
图1 GE在DEAE-Sepharose Fast Flow阴离子交换柱上的洗脱曲线Fig.1 Anion-exchange chromatography (DEAE-Sepharose Fast Flow) of GE
将制得的野葛根粗多糖用 DEAE-Sepharose Fast Flow阴离子交换层析进行分离。作为大多数的中性多糖可被蒸馏水顺利洗脱,而被吸附的酸性多糖则可用不同浓度的 NaCl溶液洗脱。经过蒸馏水和梯度浓度(0.1,0.2,0.3,0.5 mol/L)的NaCl洗脱后得到不同的吸收峰,如图1所示,一共出现两个峰值大于1.0的峰,分别为蒸馏水以及0.1 mol/L NaCl的洗脱峰,命名为GEa(蒸馏水洗脱组分)、GEb(0.1 mol/L NaCl洗脱组分)以及数个峰值小于0.25的杂峰。分别收集两个吸收峰对应的收集管中的洗脱液,经浓缩-透析-真空冷冻干燥后得到较纯的野葛根多糖 GEa和 GEb进行下一步研究,GEa为中性多糖,GEb为酸性多糖。得率分别为:12.34%和5.68%。由于关于野葛根酸性多糖的研究近乎没有,本文选择对酸性多糖GEb进行研究。
2.2 GEb的凝胶过滤柱层析
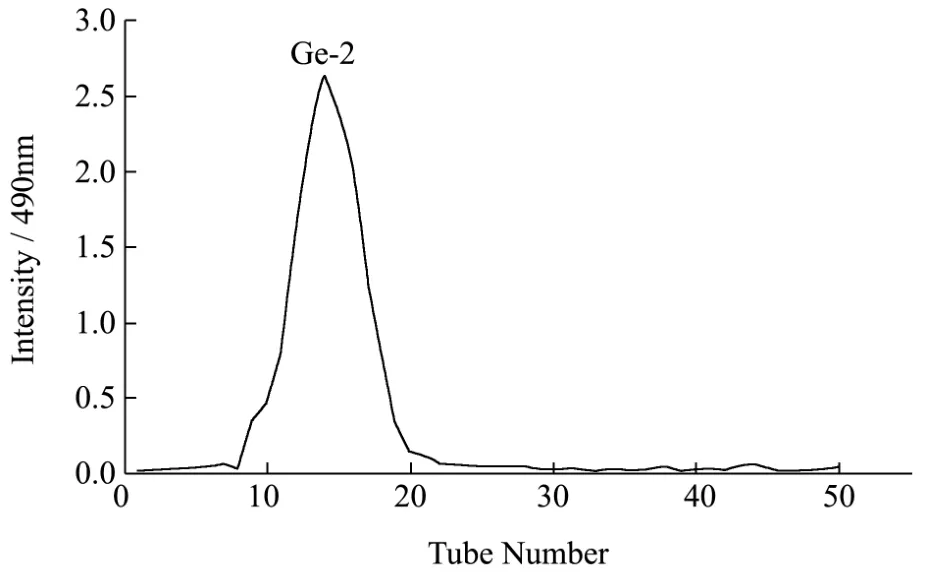
图2 GEb的Sephacryl S-200 HR凝胶层析洗脱图Fig.2 Elution profile of GEbOnSephacryl S-200 HR column
将制得的GEb用Sephacryl S-200 HR凝胶柱进一步分离纯化,如图2所示,只出现一个洗脱峰,该吸收峰峰值较高且无杂峰,说明多糖的分离效果较好,纯度较高。收集吸收峰相对应的收集管内的溶液,进一步浓缩、透析、真空冷冻干燥后得到白色絮状固体,命名为GE-2,经苯酚-硫酸法分析得到GE-2的糖含量为98.3%,经硫酸-咔唑法测定GE-2中葡萄糖醛酸含量为21.65%,将GE-2用于后续的结构鉴定。
2.3 GE-2的分子量及纯度测定
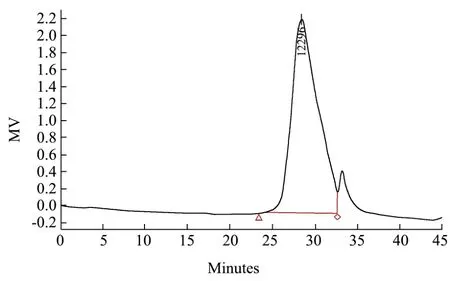
图3 GE-2的GPC色谱图Fig.3 Chromatography of GE-2 by GPC
如图3所示,在33 min前出现样品的单一洗脱峰;在34 min出现的为溶剂水的洗脱峰。通过软件计算得出GE-2数均分子量Mw为12300 u。比起大部分的植物多糖,GE-2的分子量较小,且该分子量的葛根多糖之前未见报道,证明GE-2属于一种新型多糖。
2.4 GE-2的SEM分析
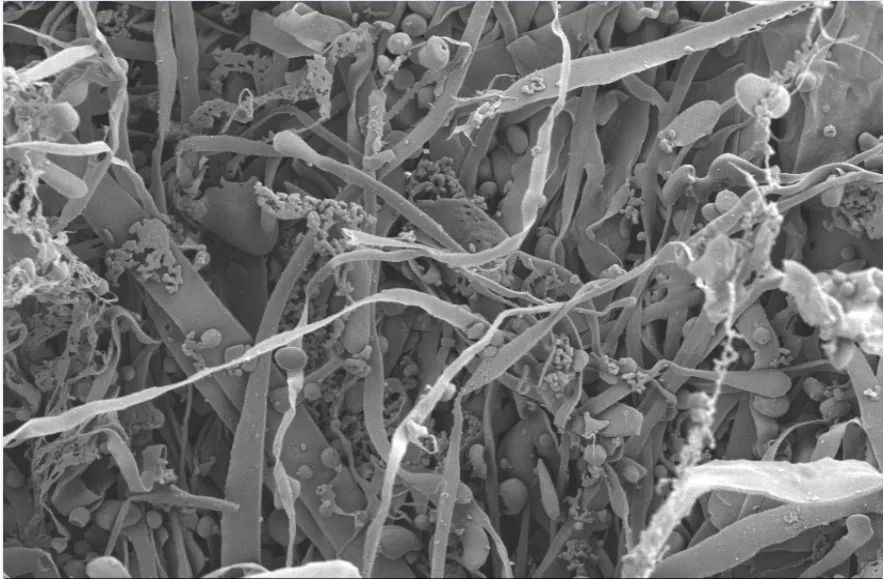
图4 GE-2的SEM图Fig.4 SEM images of GE-2
利用扫描电子显微镜(SEM)观察葛根多糖GE-2的固态表观形貌,图4所示是GE-2放大1000倍的电子显微镜扫描结果,从图中可观察到GE-2多糖主要呈条带状,表面光滑,分子间存在大量的无规则交叉结构。局部可观察到聚集态乳状结构,分子的规整性不强,可初步猜测该多糖结构中可能存在支链,且结构中存在较强的分子间相互作用力[24]。多糖表面均匀,光滑,没有大面积的褶皱出现。
2.5 紫外全波段扫描

图5 GE-2的紫外扫描光谱图Fig.5 Ultraviolet scanning spectra of GE-2
如图5所示GE-2在260 nm和280 nm附近没有出现特征吸收峰,表明分离得到GE-2不含多肽、蛋白质和核酸,通过Sevage法除蛋白以及经离子柱和凝胶柱分离后得到了纯度较高的多糖。
2.6 红外光谱分析
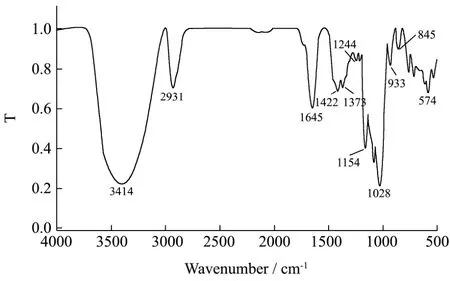
图6 GE-2的红外扫描图Fig.6 FT-IR spectrum of GE-2
红外光谱法是用来研究不同原子之间和极性键间的振动,是糖类物质结构研究的一个重要手段。一般来说,吸收峰出现在3600~3200 cm-1区域内的为分子内羟基O-H键的伸缩振动。C-H键的伸缩振动吸收峰出现在 3000~2800 cm-1范围内,1400~1200 cm-1区出现的较小的吸收峰为C-H的变角振动吸收,这两个区域为判断糖类的特征性吸收峰。全谱中最强的吸收峰出现在1200~1000 cm-1区间,由C-O-H和糖环C-O-C的两种C-O键伸缩振动所引起的。1200~800 cm-1以下为多糖的指纹区,此区域可以判断糖的类型和构型。GE-2的红外吸收光谱如图6所示。
GE-2在3414 cm-1处出现吸收峰,峰型较宽,是由于糖链中非游离 O-H伸缩振动引起的。2931 cm-1处的吸收峰是由于C-H反对称伸缩振动引起的,这些都证明了GE-2为糖类物质。1645 cm-1为多糖结合水引起的吸收峰值或者为 C=O的伸缩振动峰。1417~1245 cm-1范围出现吸收峰是由于O-H变角振动和C-O的伸缩振动引起的。图谱在1245~1022 cm-1的三个峰值1154 cm-1、1084 cm-1、1028 cm-1是吡喃环中的伸缩振动引起的,表明了GE-2糖链中含有吡喃型糖环。845 cm-1处的吸收峰表明α-葡萄吡喃糖存在。764 cm-1为D-吡喃环的对称环伸缩振动峰。红外分析表明,该组分多糖亚基可能是由含有中性单糖的单糖残基组成的聚合体,单糖残基中存在α-吡喃糖苷。
2.7 单糖组成分析

图7 单糖标准品(a)和GE-2(b)糖腈乙酸酯的气相色谱图Fig.7 Ion exchange chromatography of monosaccharides mixture (a), and GE-2 (b)
图7a为混标的出峰时间图,出峰先后顺序为:鼠李糖,核糖,阿拉伯糖,木糖,甘露糖,葡萄糖,半乳糖醛酸,果糖,内标出峰时间为12.377 min。图7b中出现的两个峰分别为葡萄糖以及内标,且出峰时间与混标相吻合,因此GE-2的单糖组成只含有葡萄糖。王振斌从葛根中提取出三种多糖组分 PS-D1、PS-D2和PS-D3。PS-D1主要含有D-果糖和D-葡萄糖,摩尔比为1∶12.3;PS-D2主要含有D-果糖和D-葡萄糖,摩尔比为1∶11.4;PS-D3主要含有D-果糖、D-葡萄糖、D-阿拉伯糖和 D-半乳糖,摩尔比为 8.9∶22.3∶1∶1[25]。显然GE-2的单糖组成不同于PS-D1、PS-D2和PS-D3,这种差异的原因可能是与葛根的的种类、产地以及分离纯化方法有关。GE-2可能为一种新型多糖。
2.8 三螺旋结构

图8 不同碱浓度下刚果红与多糖混合液的波长变化Fig.8 Absorption wavelength change of Congoredpolysaccharide complex at different NaOH solutions
刚果红是一种常被用于验证多糖链状结构的染料,它能与三螺旋构象的多糖形成络合物,使刚果红的最大吸收波长发生偏移,在一定的NaOH浓度范围内,其最大波长的特征为颜色由红色变成紫红色,当NaOH浓度超过某一数值后,多糖三螺旋结构被破坏,其最大吸收波长急剧下降[26~27]。
本实验采用刚果红法对GE-2是否具有三螺旋结构进行测定和分析。如图8所示,GE-2与刚果红形成其形成络合物,与刚果红相比最大吸收波长并没有发生红移,当NaOH浓度的不断增大,GE-2的最大吸收波长也没有发生急剧的下降,可以判断出GE-2不具有三螺旋结构。
2.9 核磁共振谱分析
核磁共振(NMR)是分析多糖结构最为精确、高效的方法之一。本文中采用一维核磁共振波谱技术1H谱,13C谱对葛根多糖GE-2中糖苷键类型、单糖残基的种类和异头碳等结构特征进行分析。
从一维碳谱图中可以看出,异头碳的共振峰集中在δ60.44~100.13范围内,α-型糖苷异头碳的化学位移通常在δ95~101范围内,而多数β-型糖苷异头碳的化学位移位于δ101~105,由图9b可知GE-2是以α-型糖苷构型存在。13C谱在δ103~112以及δ82~84区间均没有信号,表明GE-2不含呋喃糖,从而也可确定单糖残基为吡喃糖构型。δ99.55和100.01处出现的异头碳信号分别代表(1→4)和(1→4,6)糖苷键,δ60.32为(1→4)糖苷键中C→6 的特征峰,δ73.2、71.49、70.94和 76.72处出现的共振峰分别代表(1→4)糖苷键中C→3、C→2、C→5 和 C→4。δ76.23、72.7、73.24和 73.38处出现的共振峰代表(1→4,6)糖苷键中的C→3、C→2、C→4和C→5。在一维氢谱图中可以看出,GE-2的1H信号大多集中在δ3.50~5.50处,δ5.28和 5.12处出现的异头质子信号代表(1→4)和(1→4,6)糖苷键[28,29]。在δ5.00~5.40、5.04、5.07、5.10、5.15,5.19、5.27、5.28和5.32出现信号峰表明GE-2中存在α-型吡喃糖。这与红外测得的结果相符。δ3.5~4.50为C-2、C-3、C-4和C-5位的氢信号所在的区域,此区域的氢信号较复杂地重叠在一起。
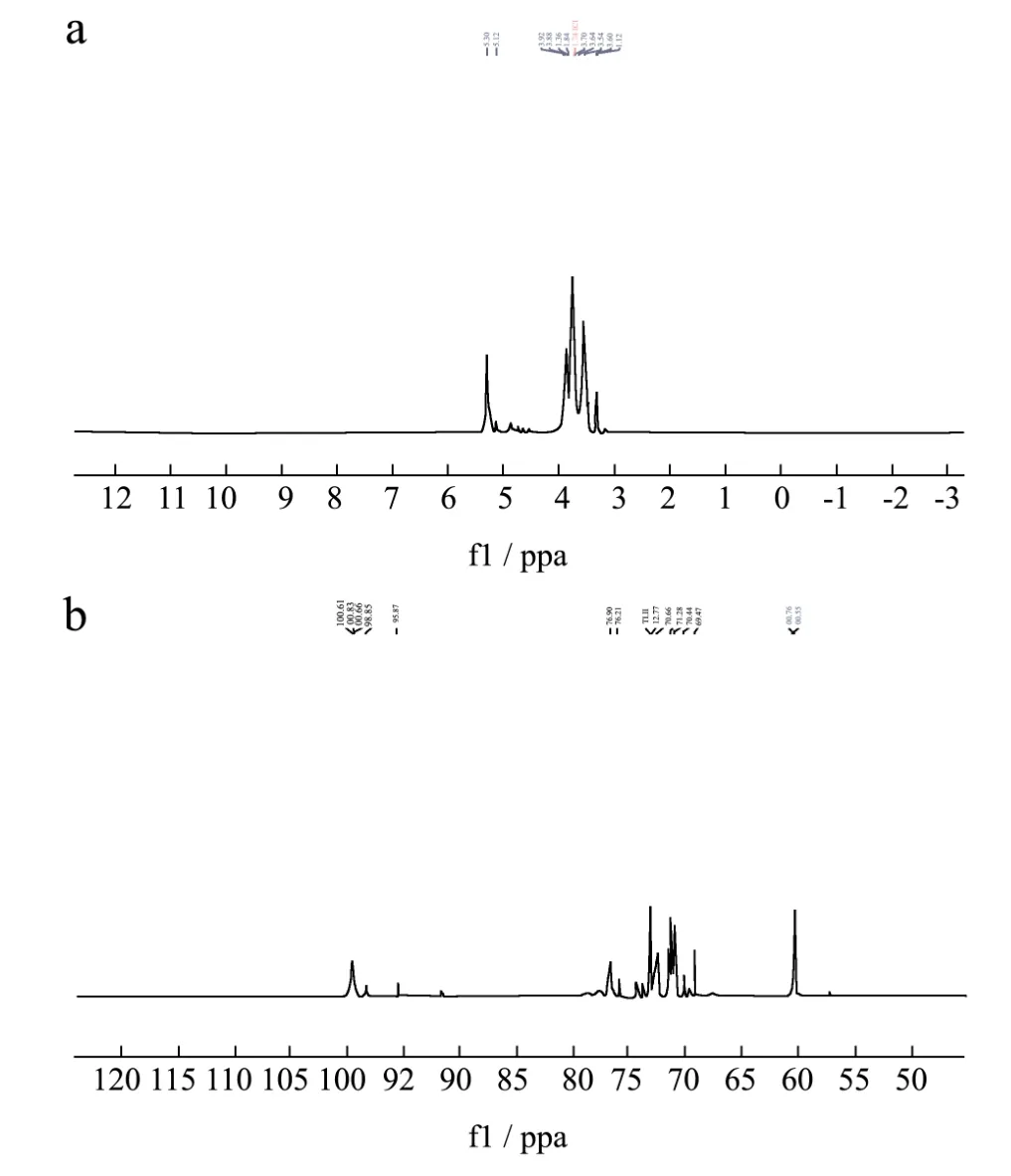
图9 GE-2的核磁共振波谱图Fig.9 NMRspectrum of GE-2
2.10 GE-2的免疫调节活性研究
先天性免疫应答的刺激调节可以增强机体对抗外源病原体的威胁。一般认为,免疫系统的刺激调节主要是通过激活巨噬细胞系统和补体系统来实现的[30~32]。

图10 GE-2对小鼠巨噬细胞RAW 264.7的毒性实验Fig.10 Effect of GE-2 on the viability of RAW 264.7 cells

图11 不同浓度的Ge-2对小鼠巨噬细胞表达NO(a)、TNF-α(b)和IL-6(c)的影响Fig.11 Effects of different concentrations of GE-2 on macrophage (a) NO, (b) TNF-α and (c) IL-6 secretion
本文研究了不同浓度GE-2对小鼠巨噬细胞分泌细胞因子NO、TNF-α和IL-6的影响。如图10所示,随着GE-2浓度的上升,小鼠巨噬细胞存活率稳定在98%左右,且不同浓度下得细胞存活率间无显著性差异,说明GE-2的浓度梯度不会对小鼠细胞造成毒害作用。如图11所示,经过GE-2处理后,小鼠巨噬细胞中NO、TNF-α和IL-6的表达量均显著升高,且表达量随着GE-2浓度的升高而升高,呈现出明显的剂量效应。图11a显示,GE-2对NO的表达在浓度250µg/mL到500 µg/mL内上升速度放缓,在1000 µg/mL浓度时NO表达量最高。图11b显示,TNF-α的浓度在GE-2低浓度时为阴性对照的2倍左右,GE-2浓度在500 µg/mL 到1000 µg/mL范围内时,TNF-α浓度上升速度明显放缓,TNF-α的表达量无明显差异;经过1000 µg/mL GE-2处理的细胞其TNF-α的表达水平为阴性对照的3倍左右。图11c显示,GE-2对IL-6的激活表达较为显著,小鼠巨噬细胞经1000 µg/mL的GE-2处理后其IL-6的表达水平将近是阴性对照组的40倍。综合以上指标,表明GE-2具有显著的免疫调节活性。
3 结论与展望
通过热水浸提及离子层析分离从野葛根体粗多糖中分离纯化得均一酸性多糖 GE-2。GPC测得其分子量为12300 u。经紫外光谱、FT-IR、SEM、GC、NMR、刚果红分析,结果显示,Ge-2的单糖组成为葡萄糖,含有α-(1→4)和α-(1→4,6)糖苷键,没有三螺旋结构,具有无序的空间结构。本文研究不同浓度GE-2对小鼠巨噬细胞分泌细胞因子NO、TNF-α和IL-6的影响,发现小鼠巨噬细胞中NO、TNF-α和IL-6的表达量随着GE-2浓度的升高而升高,呈现出明显的剂量效应,说明其有很强的免疫调节活性。本文的研究结果为野葛根多糖类产品的开发和利用提供了一定的科学证据和研究思路。