双色上转换纳米荧光探针在套细胞淋巴瘤细胞靶向成像中的应用*
2018-08-18杨光郑如意董程骥陈梦茜金在顺
杨光,郑如意,董程骥,陈梦茜,金在顺
(1.牡丹江医学院,黑龙江 牡丹江157011;2.江苏省徐州市矿山医院,江苏 徐州221006)
套细胞淋巴瘤(mantle cell lymphoma,MCL)是非霍奇金淋巴瘤(non-hodgkin lymphoma,NHL)中的一种亚型,约占全部NHL的6%[1]。免疫表型为成熟的B细胞表型,即细胞表面表达有大量的CD20和CD5抗原[2-3]。由于其恶性程度高、侵袭速度快[4],因此MCL的早期诊断及早期治疗成为延长生存期的关键。
上转换纳米颗粒(upconversion nanoparticles,UCNPs)作为一种新型的荧光标志物,具有上转换功能强大、检测敏感性高[5-7]、化学稳定性好以及细胞毒性很低等[8]一系列优点,在980 nm近红外光(near infrared,NIR)激发下将释放出明亮的上转换荧光(upconversion fluorescence,UCL)。基于抗原、抗体之间的特异性免疫反应原理,本研究将采用UCNPs与相应抗体偶联的方法,使该粒子具有靶向性,进而对MCL细胞株进行靶向成像。现将对UCNPs在MCL细胞靶向成像中的应用进行探讨。
1 材料与方法
1.1 试剂与仪器
1.1.1 试剂 NaYF4:Er3+和NaYF4:Yb3+,Tm3+纳米颗粒由牡丹江医学院电镜室提供,磷酸盐缓冲液(phosphate buffered solution,PBS)购自北京亚太恒信生物科技有限公司,2-吗啉乙磺酸(2-morpholinoethanesulfonic acid,MES,99%)、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸酸[1-(3-dimethy laminopropyl)-3-ethylcarbodiimide hydrochloride,EDC·HCl,98%]、N-羟基硫代琥珀酰亚胺(N-Hydroxysuccinimide,NHS,98%)购自上海阿拉丁试剂公司,RPMI 1640培养基和胎牛血清(fetal bovine serum,FBS)购自美国Gibco公司,双氧水(H2O2,30%)购自辽宁泉瑞试剂有限公司,CD20(Clone:2H7)和CD5(Clone:UCHT2)单克隆抗体购自美国BD生物科技公司,Jeko-1细胞株购自中国科学院上海生命科学研究院细胞资源中心。
1.1.2 仪器 Night OWL小动物活体成像系统购自德国Berthold公司,Eclipse Ti-S倒置荧光显微镜购自日本尼康公司,傅里叶转换红外光谱仪(fourier transform infrared spectroscopy,FT-IR)购自美国Thermo Fisher Scientific公司,WG1233B3-980 nm半导体激光系统购自北京艾纳捷光电科技有限公司,超声波细胞破碎仪购自宁波新芝生物科技股份有限公司,温控磁力搅拌器购自常州普天仪器制造有限公司,CO2培养箱、离心机和微量移液枪均购自美国Thermo公司,Statspin Cytofuge 12细胞甩片机购自北京自然基因科技有限公司。
1.2 纳米颗粒疏水性向亲水性的转化
双氧水作为一种强氧化剂,对纳米颗粒表面油酸盐配体碳碳双键进行直接氧化。通过该方法可将有疏水特性的纳米颗粒转变为亲水性。将0.1 g预先制备好的NaYF4:Yb3+,Tm3+纳米颗粒和8 ml的H2O2混匀,在室温下磁力搅拌1 h。氧化结束后,通过离心弃除上清液。氧化后的沉淀加入去离子水在超声波细胞破碎仪下充分粉碎洗涤,之后离心,最后将沉淀在70℃恒温箱中干燥24 h。使用同样的方法NaYF4:Er3+纳米粒子也由最初的亲水性转变为疏水性。
1.3 氧化后的纳米颗粒与CD20/CD5抗体偶联
取氧化后的NaYF4:Yb3+,Tm3+纳米颗粒0.05 g,向其中加入MES并将混合液在超声波细胞破碎仪的作用下充分粉碎5 min。超声降解粉碎机功率为600 W。在转速4 000 r/min的条件下离心,弃除上清液。然后向沉淀中加14 ml MES、0.005 g EDC、0.015 g NHS在室温下磁力搅拌2 h。磁力搅拌结束后,将混合液离心、去除上清液。再向沉淀中加入PBS在超声波细胞粉碎机作用下充分粉碎洗涤2次,离心、去上清液并向沉淀中加5 ml PBS和50 μl CD5单克隆抗体(1:100稀释),将其放在摇床上振荡2 h。最后将加入抗体的混合液放在4℃冰箱保存备用。即连接有CD5抗体的NaYF4:Yb3+,Tm3+纳米粒子成功制备。使用同样的方法,偶联有CD20单克隆抗体的NaYF4:Er3+纳米探针也成功制备。
1.4 UCNPs上转换性能检测及傅里叶波谱分析
取适量偶联有相应抗体的UCNPs悬液,使用配备有980 nm近红外激光的Night OWL小动物活体成像系统对其进行成像。激发功率分别为0、0.7和1.0 W,以此来验证UCNPs的发光性能。取仅仅氧化后的,与NHS、EDC反应后的以及与相应抗体偶联后的UCNPs,使用FT-IR对其进行波谱分析,以此间接验证该粒子最终是否已被成功的生物功能化以及是否已与相应的抗体成功偶联。
1.5 UCNPs细胞毒性检测
吸取200 μl Jeko-1细胞悬液(细胞数:6.3×105个)接种到24孔培养板内,共接种15个孔。其中实验组12个孔,对照组3个孔。然后向15个培养孔内分别加800 μl含有10%胎牛血清的RPMI 1640培养基。实验组中的12个培养孔每4个孔为一组,共分为3组。每组分别滴加20、40、80、160 μl UCNPs悬液。将24孔培养板在37℃、CO2浓度为5% 的条件下分别培养24、48和72 h。在不同的时间点使用台盼蓝对细胞进行染色并利用血球计数板进行活细胞计数。通过以下公式计算细胞活性进而评估UCNPs的细胞毒性:细胞活性(%)=(实验组活细胞数/对照组活细胞数)×100%。
1.6 细胞培养和成像
细胞在含有10%胎牛血清的RPMI 1640培养基中培养,培养箱温度为37℃、CO2浓度为5%。取对数生长的细胞用于该实验。为了使细胞均匀的分布于载玻片上,吸取Jeko-1细胞悬液100 μl(细胞数:1.5×105个)加入细胞甩片机加样孔内,1 000 r/min离心5 min,使细胞均匀分布于载玻片。丙酮固定细胞后,向Jeko-1细胞所在区域滴加CD20抗体NaYF4:Er3+纳米探针悬液和CD5抗体NaYF4:Yb3+,Tm3+纳米探针悬液的混合液300 μl,室温下湿盒内孵育2 h。在对照实验中,向Jeko-1细胞所在区域滴加NaYF4:Er3+纳米探针悬液和CD5抗体NaYF4:Yb3+,Tm3+纳米探针悬液的混合液300 μl;向Jeko-1细胞所在区域滴加CD20抗体NaYF4:Er3+纳米探针悬液和NaYF4:Yb3+,Tm3+纳米探针悬液的混合液300 μl;向Jeko-1细胞所在区域滴加NaYF4:Er3+纳米探针悬液和NaYF4:Yb3+,Tm3+纳米探针悬液的混合液300 μl,在同样的条件下进行孵育。孵育结束后用PBS充分洗涤3次,彻底去除多余的、没有和细胞结合的纳米探针,使用配备有980 nm近红外激光的尼康Eclipse Ti-S倒置荧光显微镜进行细胞成像。
2 结果
2.1 UCNPs细胞毒性及上转换性能
为了探究UCNPs的细胞毒性,使用台盼蓝对Jeko-1细胞染色的方法来确定不同量的UCNPs与细胞培养不同时间后其对细胞生长所产生的影响。设定UCNPs探针悬液体积梯度,即20、40、80和160 μl,在同样的生理条件下分别与Jeko-1细胞培养24、48和72 h,然后进行台盼蓝染色、活细胞计数,并计算细胞活性。由图1A可见,随着UCNPs探针悬液体积的增加以及UCNPs探针与细胞孵育时间的延长,各组细胞的细胞活性几乎均处于90%以上,并未发生明显的降低。同时,将台盼蓝溶液与细胞悬液按1:1的比例混匀,然后将混合液加入血球计数板内,通过倒置显微镜直观的观察活细胞的比例。由于已经死亡的细胞可以被台盼蓝染为深蓝色,见图1B可见,可以看出血球计数板内死细胞数是非常的少,而透亮的活细胞则占较高比例。此外,为进一步明确UCNPs的上转换性能的高效性,吸取少量偶联有相应抗体的UCNPs悬液,通过使用小动物活体成像系统对粒子探针的上转换发光性能进行检测。由图2可见,在未给予近红外光激发的情况下,UCNPs并未产生UCL。然而当近红外光的激发功率达到0.7 W时,UCNPs探针悬液却释放出明亮的UCL。并且通过肉眼观察发现,随着近红外光激发功率的增加(P=1 W),该探针所产生的UCL的强度也随之增强。

图1 UCNPs细胞毒性检测结果

图2 UCNPs悬液的上转换成像
2.2 UCNPs的表面氧化及生物功能化
由于最初的UCNPs表面被油酸所包覆,因而其表现为疏水特性。为了使其具有水溶性,使用H2O2对粒子表面油酸配体上的碳碳双键(R-HC=CH-R’)进行氧化,以此形成带有更多羧基(-COOH)的壬二酸。为了确定UCNPs是否已与单克隆抗体成功偶联,采用一种间接的检测方法对其进行验证,即使用傅里叶转换红外光谱仪(FT-IR)对粒子进行波谱分析检测。见图3,a、b、c分别代表仅仅氧化后UCNPs、与NHS、EDC反应的UCNPs和与单克隆抗体反应后的UCNPs的波谱。可以看出波数在2 849 cm-1和2 926 cm-1处,a、b、c所代表的3种经过不同处理的粒子的吸收峰强度逐渐下降。

图3 UCNPs的FT-IR波谱分析结果
2.3 细胞免疫标志和成像
在这项研究中,由于细胞表面的抗原与UCNPs上偶联的单克隆抗体之间发生特异性的免疫反应,Jeko-1细胞得以被特异性的识别标志。抗体的羧基基团和纳米粒子表面的氨基基团在NHS和EDC的辅助下将发生冷凝反应[9],进而UCNPs与单克隆抗体发生共价交联,见图4。因此根据以上原理,氧化后的NaYF4:Yb3+,Tm3+纳米颗粒与CD5抗体发生交联进而牢固连接形成CD5抗体-UCNPs轭合物,同样CD20抗体通过该方法与NaYF4:Er3+纳米粒子共价结合形成CD20抗体-UCNPs轭合物。基于Jeko-1细胞表面表达大量CD20和CD5抗原,以及细胞表面的抗原与纳米颗粒上的抗体之间发生的特异性免疫反应,Jeko-1细胞能够被NaYF4:Yb3+,Tm3+UCNPs和NaYF4:Er3+UCNPs特异性标志。
为了通过细胞实验来证实功能化后的UCNPs可以对Jeko-1细胞进行免疫标志,将Jeko-1细胞与UCNPs-CD20抗体轭合物和UCNPs-CD5抗体轭合物的混合液室温孵育2 h,再使用PBS对细胞充分清洗以除去未与细胞结合的残存粒子。然后使用配备有980 nm近红外激光的共聚焦显微镜对细胞进行上转换成像,激发功率为1.5 W,曝光时间为2 s。由图5可见,将明场像和暗场像进行重叠,细胞的形状和位置并未发生任何改变。在×20物镜下发现该细胞表面释放明亮的蓝、绿双色UCL,且释放双色荧光的UCNPs在细胞表面分布的部分区域并未发生重叠,同时在细胞外区域也未见残存的发光粒子,这意味着UCNPs的确仅仅分布于细胞上。

图4 细胞的免疫标志

图5 Jeko-1细胞与NaYF4:Er3+-CD20抗体和NaYF4:Yb3+,Tm3+-CD5抗体共同孵育后上转换荧光图像 (20 μm)
进一步验证是否细胞与UCNPs之间的连接是基于抗原/抗体介导的特异性免疫反应。在同样的孵育条件下,将Jeko-1细胞与NaYF4:Er3+纳米探针悬液和CD5抗体NaYF4:Yb3+,Tm3+纳米探针悬液的混合液共同孵育。在UCNPs未与CD20抗体偶联的情况下与Jeko-1细胞共同孵育后,细胞表面仅可见NaYF4:Yb3+,Tm3+释放明亮的蓝色UCL,而未见NaYF4:Er3+所释放的绿色荧光(见图6)。此外,将Jeko-1细胞与CD20抗体NaYF4:Er3+纳米探针悬液和NaYF4:Yb3+,Tm3+纳米探针悬液的混合液共同孵育,一定时间后进行UCL成像。UCNPs在未与CD5抗体偶联的情况下与Jeko-1细胞共同孵育后,细胞表面仅可见NaYF4:Er3+释放的明亮的绿色UCL,而未见NaYF4:Yb3+,Tm3+释放的蓝色UCL(见图7)。最后将Jeko-1细胞与未偶联任何抗体的NaYF4:Er3+纳米探针悬液和NaYF4:Yb3+,Tm3+纳米探针悬液的混合液共同孵育,然后进行上转换成像。由于UCNPs悬液中未添加任何抗体,Jeko-1细胞表面并未释放出蓝、绿双色UCL(见图8)。
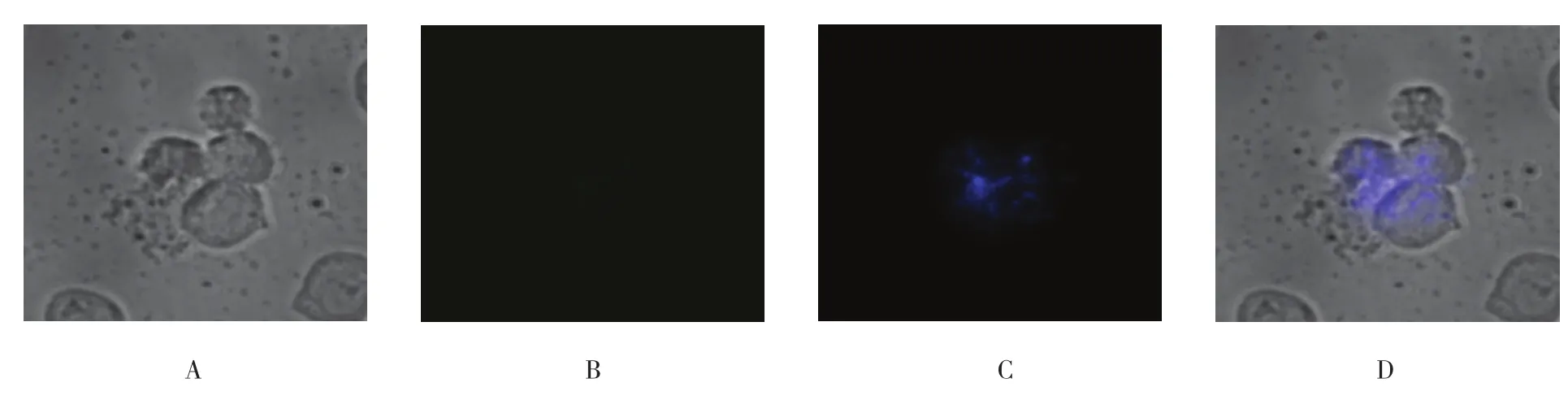
图6 Jeko-1细胞与NaYF4:Er3+和NaYF4:Yb3+,Tm3+-CD5抗体共同孵育后上转换成像

图7 Jeko-1细胞与NaYF4:Er3+-CD20抗体和NaYF4:Yb3+,Tm3+共同孵育后上转换成像

图8 Jeko-1细胞与NaYF4:Er3+和NaYF4:Yb3+,Tm3+共同孵育后上转换成像 (20μm)
3 讨论
UCNPs在一定量的范围内无毒性,对细胞的生长并未产生抑制作用,同时也不会导致细胞死亡。该粒子具有强大的上转换性能,即使激光的功率非常低依然能够高效的将低能量的近红外光转变为高能量的可见光,在将来极有可能成为一种非常理想的生物探针应用于生物医学成像。通过FT-IR波谱分析,在波数2 849 cm-1和2 926 cm-1处a、b、c波谱显示UCNPs的吸收峰强度逐渐降低,间接证明氧化后UCNPs与NHS、EDC成功连接以及与单克隆抗体成功偶联。双氧水对UCNPs表面的氧化处理以及NHS、EDC与UCNPs的成功结合为UCNPs与单克隆抗体的成功偶联奠定基础,最终UCNPs与单克隆抗体共价结合,具有靶向性的UCNPs得以被成功制备。在UCNPs偶联有CD20和CD5单克隆抗体的情况下,UCNPs与Jeko-1细胞孵育一定时间后进行上转换成像,细胞表面释放出明亮的双色UCL,这说明细胞表面已标记有大量的上转换纳米粒子,CD5抗体-UCNPs轭合物和CD20抗体-UCNPs轭合物能够和Jeko-1细胞表面相结合。而UCNPs未与某种抗体偶联直接与Jeko-1细胞孵育,细胞表面则并未释放出相应的UCL,这意味着细胞与UCNPs的成功结合与UCNPs是否与相应的抗体成功偶联有着必然的联系,细胞之所以被UCNPs所标记是由于细胞表面的抗原和UCNPs上已偶联的抗体之间发生的特异性免疫反应所致,偶联有相应抗体的UCNPs能够对MCL细胞株进行靶向标记。
目前,用于淋巴瘤细胞株靶向成像的方式主要有细胞免疫荧光技术、量子点靶向标志技术、纳米粒子靶向标志技术、放射免疫示踪法等。细胞免疫荧光技术是最为常用且较为成熟的一种细胞靶向标志技术,同样是根据抗原/抗体之间的特异性免疫反应,细胞被特定的荧光素所标志。然而,由于荧光素具有较高的光漂白性[10],易发生荧光淬灭,因此该技术对实验条件要求较为苛刻,自加荧光二抗起所有的步骤必须在避光、黑暗的环境中进行,实验结束后需尽快在荧光显微镜下观察,以防荧光淬灭影响观察效果。量子点虽然已经成功的克服以上缺点,但是其固有毒性和化学不稳定性却引起人们的广泛关注[11]。放射免疫示踪法也已被研究应用于细胞的靶向标志,其具有检测敏感性高、特异性强、简便易行等优点[12],然而该方法所使用的标志物为同位素示踪物,该示踪物具有一定的放射性,长时间接触会对实验人员的身体健康造成一定的辐射损伤[13]。
而UCNPs则具有独特的光学性能,其检测敏感性高且不具有光漂白性[14],同时细胞对980 nm近红外光的吸收非常低,将导致来自细胞的自体荧光强度较低,进而增加了图像信噪比,极大地改善了图像的质量[15]。基于以上优点,在医学基础研究和临床应用方面,UCNPs有潜力替代传统的荧光探针应用于生物分子标志、细胞靶向成像和动物活体成像[16-17]。最近,有研究人员[9,18-19]已报道,上转换纳米探针在体内和体外生物成像中的应用进展。在以上的生物成像研究中,经常选择宫颈癌细胞、卵巢癌细胞、结直肠癌细胞、人口腔表皮样癌细胞等贴壁细胞作为靶细胞进行实验且均取得理想的实验结果。证实在生物成像应用中,基于上转换纳米材料的荧光探针可以被应用于肿瘤细胞的靶向生物标志。然而关于MCL细胞株甚至其他悬浮细胞的相关报道却并未多见。UCNPs在MCL细胞靶向成像中的应用,为其将来应用于小鼠体内以及临床病人体内MCL病灶的靶向检测奠定基础。同时,CD20单克隆抗体又被称之为美罗华,是一种高效的临床化疗药物用于治疗B细胞来源的淋巴瘤[20]。因此,UCNPs与CD20抗体的结合不仅仅有助于MCL的靶向检测,同时对肿瘤病灶也起到精准治疗的效果,减少对正常细胞、组织造成不必要的损伤。受此启发,UCNPs还具有巨大的潜力应用于其他恶性肿瘤的早期检测、靶向定位和精准治疗,对未来医学事业的发展具有重要的指导意义。
综上所述,本研究发明一种新颖的上转换纳米粒子的氧化方法,仅仅使用双氧水对粒子表面进行氧化。与勒米厄—冯鲁德洛夫试剂相比,该氧化方法步骤更加简便、耗时更少。且该方法并未对纳米粒子的形态大小、结构、组成、上转换发光性能产生不利的影响。通过体外实验,在MCL细胞表面看到强烈、明亮的上转换荧光信号。同时在980 nm近红外光的激发下,并未看到肿瘤细胞产生的自体荧光。表面修饰功能化后的UCNPs在NHS、EDC的作用下与抗CD20/CD5抗体结合形成UCNPs-CD20/CD5抗体耦合物。UCNPs-CD20/CD5抗体耦合物作为一种高效的荧光标志物应用于Jeko-1细胞的免疫标志和成像。通过对照实验,本研究发现,UCNPs-CD20/CD5抗体耦合物具有靶向性,能够对MCL细胞进行特异性标志,为以后活体内MCL病灶的靶向检测奠定基础,同时也为以后对其他恶性肿瘤的早期诊断、靶向定位、精准治疗提供理论基础和实验依据。
