4种禽流感病毒M2e多肽的串联表达和小鼠口服免疫效果
2018-08-14罗斌钱凯徐万祥唐海平季朝能谢毅顾少华
罗斌,钱凯,徐万祥,唐海平,季朝能,谢毅,顾少华
1. 复旦大学生命科学学院遗传学研究所,上海 200438; 2. 上海市计划生育科学研究所国家人口和计划生育委员会重点实验室,上海 200032; 3. 上海市工业菌株工程技术研究中心,上海 200438
根据甲型流感病毒(influenza A virus,IAV)两个主要膜蛋白血凝素(hemagglutinin,HA)和神经氨酸酶(neuraminidase,NA)的不同,分为18个HA亚型和11个NA亚型[1-2]。甲型流感病毒通过HA与宿主细胞表面的唾液酸受体结合进入候鸟、家禽、猪和人等宿主。由于不同种属唾液酸受体的结构不同,甲型流感病毒存在种属特异性,难以跨种属传播,有禽流感病毒、猪流感病毒和人流感病毒之分[3-4]。甲型流感病毒的最初宿主为禽类[5],其HA发生突变后就可能跨种属传播,因此禽流感病毒为甲型流感的元凶。
目前研制禽流感疫苗的策略是:每年根据流行病学监测进行预测,大约提前6个月决定疫苗所用的禽流感病毒株;针对所用病毒株的HA和NA编码基因制备新的禽流感疫苗,以匹配可能流行的禽流感病毒[6]。由于HA和NA编码基因极易发生突变,或因不同亚型病毒株之间基因重配,目前尚难以对将要流行或暴发的禽流感病毒株进行准确预测,所以研制对不同禽流感病毒具有广谱作用的疫苗极其重要。
基质蛋白2(matrix protein 2,M2)是禽流感病毒的第3个膜蛋白[7],其N端1~24位残基为M2胞外区(M2 ectodomain,M2e)。M2e在不同亚型禽流感病毒之间高度保守[8],是研制广谱性禽流感疫苗的靶标之一,但其免疫原性较弱[9]。霍乱弧菌肠毒素亚单位A1(Vibriocholeraeenterotoxin subunit A1,CTA1)和来自金黄色葡萄球菌蛋白A的两个Ig结合域(two Ig-binding domains,DD)串联组成的CTA1-DD能起黏膜免疫佐剂作用[10-11]。本课题组前期研究中获得4种以禽类为宿主的M2e多肽序列(M2e1:SLLTEVETPTRNGWESKSSDSSD;M2e2:SLLTEVETPTRNEWESRSSDSSD;M2e3:SLLTEVETPTRNGWESRSSDSSD;M2e4:SLL-TEVETPTRNEWESKSSDSSD),并将其与肠炎沙门菌鞭毛蛋白(Salmonellaentericflagellin,Sef;Accession No:WP_000079833.1)融合构建成的Sef4M2e注射小鼠,发现具有体液免疫效果(未发表)。在此基础上,本研究将这4种M2e多肽序列与CTA1-DD串联,构成重组蛋白CTA1DD-AVI4M2e,探讨其黏膜免疫和体液免疫效果。
1 材料与方法
1.1 材料
1.1.1菌株、重组质粒和蛋白大肠埃希菌BL21(DE3)为本实验室保存。pET-28a(+)-CTA1DD-AVI4M2e重组质粒由上海旭冠生物科技发展有限公司合成,pXXGST-2、pXXGST188-M2e1、pXX-GST188-M2e2、pXXGST188-M2e3和pXXGST188-M2e4质粒为本实验室保存。Sef4M2e蛋白为本实验室保有(其特征是在Sef的C端融合4M2e),M2e1、M2e2、M2e3和M2e4多肽(1 mg/mL,纯度>90%)由合肥博肽生物科技有限公司合成。
1.1.2主要试剂6×His单克隆抗体、辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗鼠IgA和IgG购自Abcam公司,蛋白酶抑制剂购自Roche公司,酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒购自上海冠泰生物科技有限公司。
1.1.3实验动物45只6周龄BALB/c雄性小鼠及标准小鼠饲料购自上海西普尔-必凯实验动物有限公司。每15只分笼饲养于上海市计划生育科学研究所普通级小鼠动物房内,室温(20±2) ℃,并保证良好的通风和光照条件。
1.2 方法
1.2.1原核表达载体pET-28a(+)-CTA1DD-AVI4M2e构建根据美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库提供的CTA1(Accession No:P01555)和DD(Accession No:AAB05743)序列,组成CTA1DD序列,再将4个禽流感M2e序列串联在CTA1DD下游,利用常见的GPGP和GG寡肽作为连接接头,构成CTA1DD-GPGP-M2e1-GG-M2e2-GG-M2e3-GG-M2e4,由上海旭冠生物科技发展有限公司进行全合成,并在上下游分别引入EcoRⅠ和HindⅢ的限制性内切酶位点,插入pET-28a(+)载体,构成重组质粒pET-28a(+)-CTA1DD-AVI4M2e。
1.2.2重组融合蛋白的表达、优化、鉴定与纯化将重组质粒pET-28a(+)-CTA1DD-AVI4M2e转化大肠埃希菌BL21(DE3),在含有终浓度为50 μg/mL卡那霉素的LB液体培养基中37 ℃培养至OD600为0.6~0.8,加入终浓度为1 mmol/L 的异丙基硫代半乳糖苷(isopropyl β-D-thiogalactoside,IPTG),分别于16 ℃诱导24 h、25 ℃诱导8 h和37 ℃诱导4 h优化表达条件。取1 mL菌液,12 000 r/min离心1 min,收集菌体,按1∶10(质量体积比)加入磷酸盐缓冲液(phosphate buffered saline,PBS)重悬,用超声破碎仪破菌,离心分别收集上清液和沉淀。分别将pXXGST-2质粒和4个pXXGST188-M2e质粒转化大肠埃希菌BL21(DE3),在含有终浓度为50 μg/mL氨苄西林的LB液体培养基中37 ℃培养至OD600为 0.6~0.8,42 ℃ 诱导4 h,收菌制样,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)和蛋白免疫印迹分析。待重组蛋白实验结果和优化条件确定后进行大量诱导表达,收集诱导后的菌体,以Start Buffer(含10 mmol/L咪唑)重悬,用破菌仪破菌3次,离心后将上清液经镍柱亲和层析,探索合适比例的Elution Buffer(含250 mmol/L咪唑)洗脱杂蛋白,然后进行梯度洗脱目的蛋白,最后超滤管浓缩、换液,获得高浓度重组蛋白。以Image J软件对目的蛋白进行灰度分析,将分装好的蛋白于液氮中迅速冻存后保存在-80 ℃冰箱。
1.2.3灌服免疫BALB/c小鼠将目的蛋白和Sef4M2e蛋白用1×PBS稀释至适宜浓度,加入终浓度为1%的明胶,最终每只小鼠灌服体积为200 μL。小鼠灌服前24 h断食断水,灌服前30 min灌服30 μL含10% NaHCO3的水溶液。第1组小鼠每只灌服CTA1DD-AVI4M2e蛋白200 μg,第2组小鼠每只灌服CTA1DD-AVI4M2e蛋白和Sef4M2e蛋白各100 μg,第3组为空白组,每只灌服相应体积含1%明胶的1×PBS溶液。小鼠灌服2 h后恢复食物和水的供给。每周灌服1次,共4次。
1.2.4免疫后小鼠肠液和血清制备最后一次灌服后第10天,以摘眼球方式获取小鼠血液,待血液流尽后断颈处死小鼠,用解剖剪剪开腹腔,自胃以下部位依次剪取3段肠样,每段约5 cm。采集的血液于37 ℃静置1 h,4 ℃冰箱过夜,5 000 r/min低温离心10 min,吸取血清置于无菌EP管中。将小鼠肠样置于1.5 mL无菌EP管,加入500 μL含2%蛋白酶抑制剂的1×PBS,用无菌剪刀剪碎后,将EP管置于旋涡振荡器振荡10 min,最后4 ℃离心吸取上清液置于新的无菌EP管。将获取的每个样品按小鼠实验分组做好标记,保存于-80 ℃冰箱待检测。
1.2.5ELISA免疫原性分析将重组融合蛋白CTA1DD-AVI4M2e按50 ng/孔包被96孔板,待检测样品分别按1∶40、1∶120、1∶360、1∶1 080、1∶3 240、1∶9 720 的比例,用ELISA试剂盒中的血清稀释液和非血清稀释液稀释。以稀释后的样品作为一抗,200 μL/孔加至酶标板,37 ℃孵育1 h,以HRP标记的山羊抗鼠IgA作为肠液二抗、HRP标记的山羊抗鼠IgG作为血清二抗,按1∶10 000 稀释后进行ELISA检测,测量OD450值。
1.2.6M2e特异性鉴定本研究所用蛋白为融合蛋白,为进一步验证其产生的IgA抗体对4个M2e的特异性,将分别表达4个GST188-M2e的全菌裂解液作为实验组,由pXXGST-2表达的截短GST188作为对照组,以随机抽取的5个肠液样品稀释200倍后的肠液IgA抗体作为一抗,HRP标记的山羊抗鼠IgA按1∶10 000 稀释作为二抗,进行蛋白免疫印迹分析。将4个合成的M2e多肽和Sef4M2e按50 ng/孔包被96孔板,以随机抽取的5个肠液样品稀释200倍后的肠液IgA抗体作为一抗,HRP标记的山羊抗鼠IgA按1∶10 000 稀释作为二抗,进行ELISA检测。
2 结果
2.1 重组蛋白原核表达、优化与鉴定
将pET-28a(+)-CTA1DD-AVI4M2e质粒转化大肠埃希菌BL21(DE3)感受态细胞,诱导表达后破碎菌体,用10% SDS-PAGE检测诱导前、诱导后裂解上清液和全菌蛋白质。结果如图1所示,于 55 000~70 000 出现诱导条带。以1∶3 000 稀释的anti-His抗体为一抗、1∶10 000 稀释的HRP标记的山羊抗鼠IgG为二抗进行蛋白免疫印迹鉴定。结果如图2所示,出现目的蛋白,优化后的诱导条件为1 mmol/L IPTG,25 ℃诱导8 h。
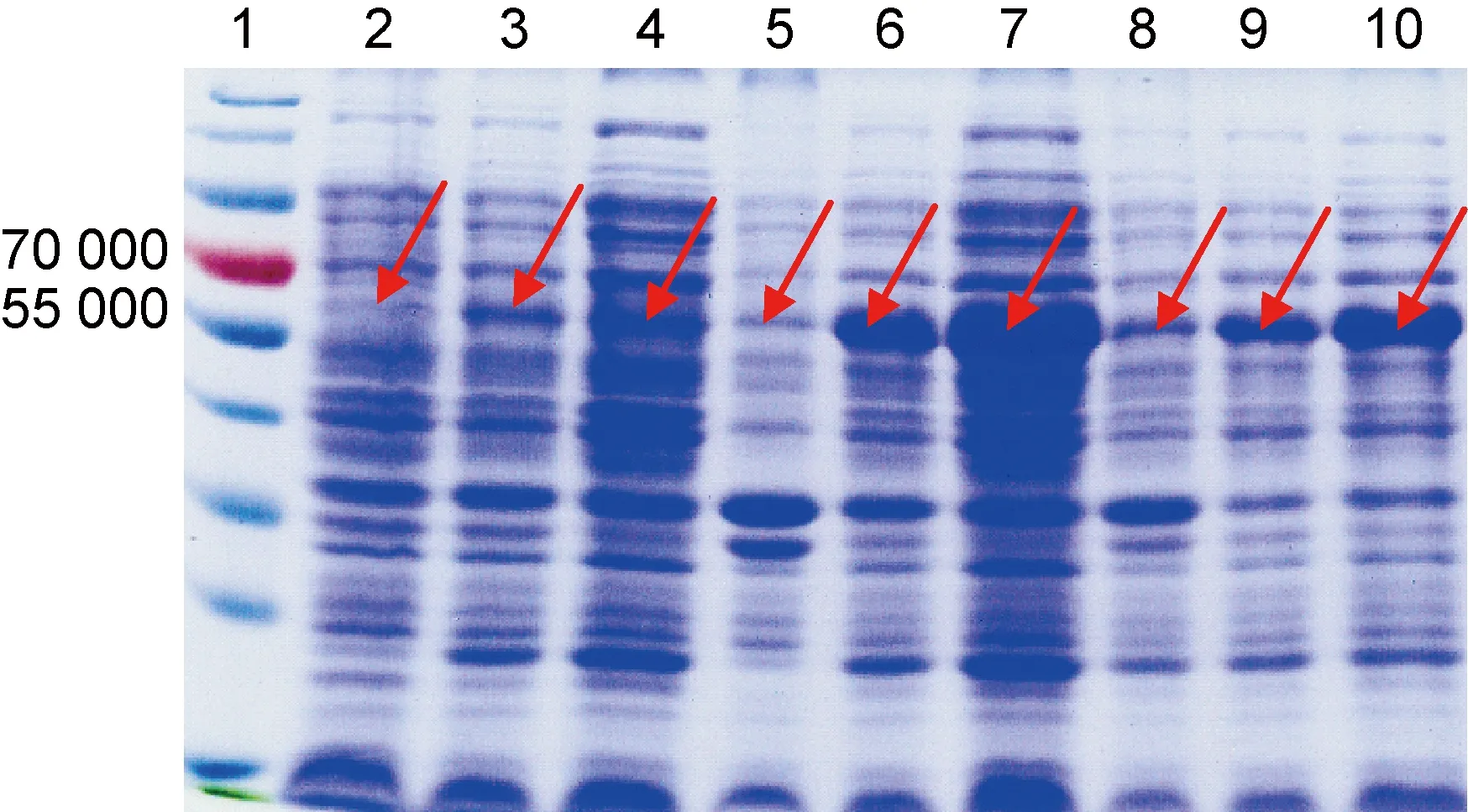
Lane 1: pre-stained protein marker; Lane 2: uninduced cell lysates at 16 ℃; Lane 3: induced cell lysates at 16 ℃ for 24 h; Lane 4: induced cell lysates supernatant at 16 ℃ for 24 h; Lane 5: uninduced cell lysates at 25 ℃; Lane 6: induced cell lysates at 25 ℃ for 8 h; Lane 7: induced cell lysates supernatant at 25 ℃ for 8 h; Lane 8: uninduced cell lysates at 37 ℃; Lane 9: induced cell lysates at 37 ℃ for 4 h; Lane 10: induced cell lysates supernatant at 37 ℃ for 4 h.
图1重组蛋白CTA1DD-AVI4M2e诱导表达及优化结果
Fig.1ExpressionandoptimizationofrecombinantproteinCTA1DD-AVI4M2e
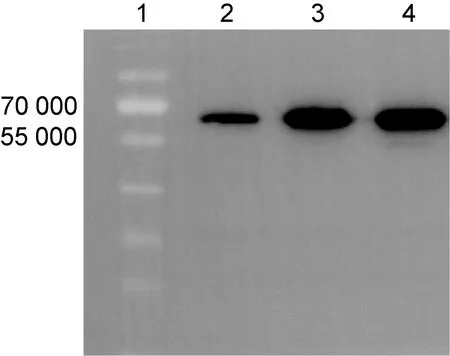
Lane 1: pre-stained protein marker; Lane 2: uninduced cell lysates at 25 ℃; Lane 3: induced cell lysates at 25 ℃ for 8 h; Lane 4: induced cell lysates supernatant at 25 ℃ for 8 h.
图2重组蛋白CTA1DD-AVI4M2e蛋白免疫印迹结果
Fig.2WesternblottingresultsofrecombinantproteinCTA1DD-AVI4M2e
2.2 重组蛋白纯化结果
大量表达目的蛋白后,以高压破菌仪重复破碎3次,高速离心后获得大量含重组蛋白的上清液,经过镍柱亲和层析,探索出合适的蛋白纯化条件为用14% Elution Buffer和86% Start Buffer洗除杂蛋白。设置15 mL梯度洗脱长度和100% Elution Buffer洗脱目标,收取目的蛋白后进行两次换液浓缩,获得重组目的蛋白(图3)。对SDS-PAGE图第2泳道进行灰度分析,目的蛋白纯度约为 89.81%。
Lane 1: pre-stained protein marker; Lane 2: purified protein after the second concentration; Lane 3: purified protein after the first concentration.
图3CTA1DD-AVI4M2e纯化和浓缩结果
Fig.3PurificationandconcentrationofrecombinantproteinCTA1DD-AVI4M2e
2.3 ELISA免疫原性分析结果
对小鼠免疫后的血清样品和肠样浸出液进行ELISA检测,以实验组OD值高于空白对照组2倍作为有效稀释效价(表1)。用GraphPad Prism 6软件对数据进行t-test双尾检验,P<0.01 为差异有显著意义。
表1样品效价
Tab.1Sampletiterresults

GroupsSampleTitersGroup 1Serum IgG360×First segmented intestinal fluid IgA360×Second segmented intestinal fluid IgA120×Third segmented intestinal fluid IgA9 720×Group 2Serum IgG360×First segmented intestinal fluid IgA120×Second segmented intestinal fluid IgA120×Third segmented intestinal fluid IgA3 240×
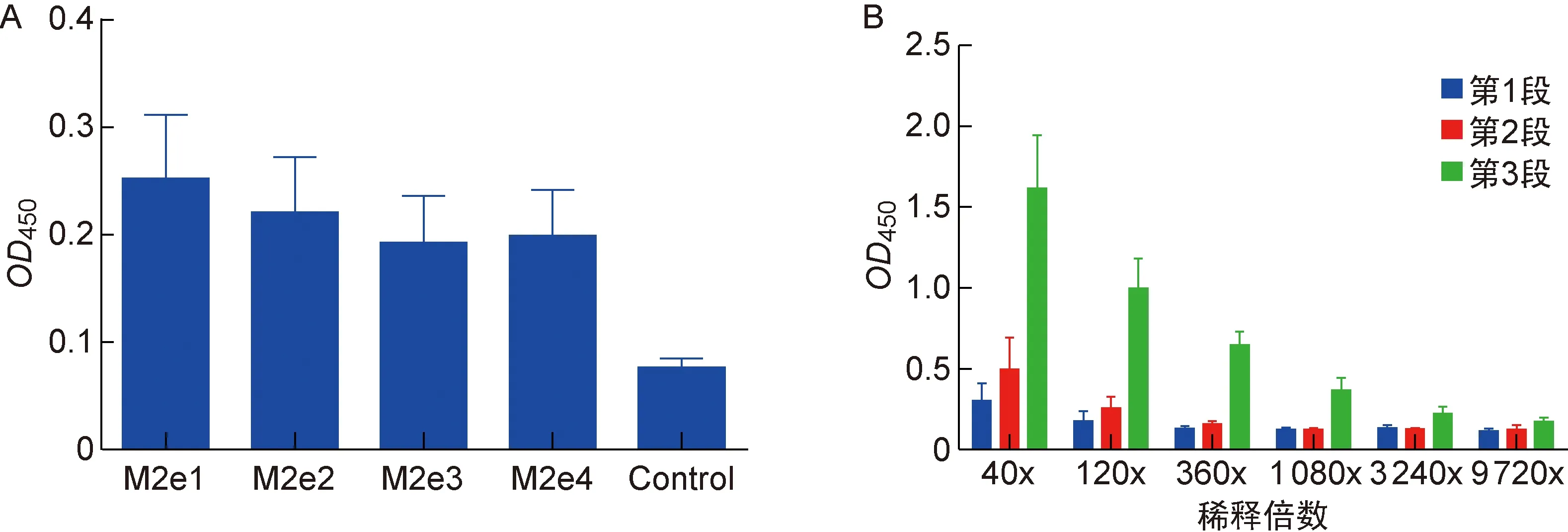
如表1所示,第1组中血清IgG效价达360倍,第1段肠液IgA效价达360倍,第2段肠液IgA效价达120倍,第3段肠液IgA效价达 9 720 倍;第2组中血清IgG效价达360倍,第1段肠液IgA效价达120倍,第2段肠液IgA效价达120倍,第3段肠液IgA效价达 3 240 倍。
本课题组前期用Sef4M2e蛋白对小鼠进行注射免疫获得了较理想的效果(未发表),本研究为探寻其与CTA1DD-AVI4M2e的协同免疫效果,检测肠道IgA抗体。结果显示,实验组小鼠体内均产生了特异性IgA抗体,但从OD值判断,第1组产生的抗体效价较高,可初步判断Sef4M2e不能与CTA1DD-AVI4M2e产生协同作用而诱导更多的特异性IgA抗体产生。同时,第1组中CTA1DD-AVI4M2e融合蛋白免疫剂量为200 μg,第2组为100 μg,结果显示第1组抗体效价高于第2组,表明此融合蛋白产生的抗体效价与免疫剂量呈正相关(图4)。
图5显示,小鼠各段肠液中IgA抗体效价不一样,但呈现共同的趋势,即小鼠肠黏膜产生的抗体效价在第3段最高,第1段次之,第2段最低,且第3段肠液中抗体效价随稀释倍数增加缓慢下降,而第1段和第2段中抗体效价随稀释倍数增加迅速下降。
2.4 M2e特异性鉴定结果
蛋白免疫印迹结果显示,由CTA1DD-AVI4M2e免疫产生的肠液IgA抗体能分别与4个M2e多肽发生抗原抗体反应,且能与Sef4M2e中的4M2e发生免疫反应,结果如图6~7所示。
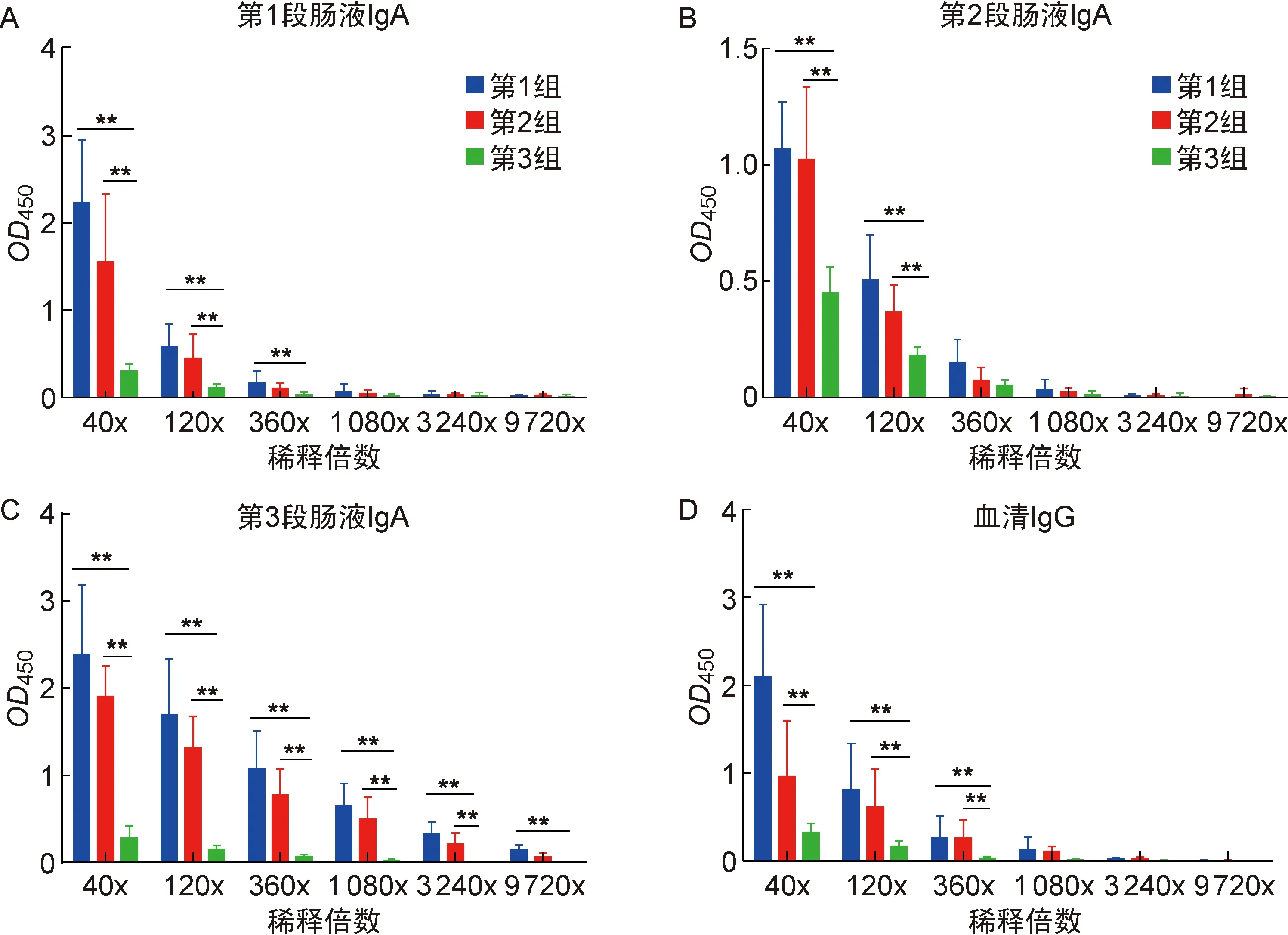
A-C: IgA titer of segmented intestine. D: IgG titer of serum.
Group 1: 200 μg (200 μL) of CTA1DD-AVI4M2e protein was given; Group 2: 100 μg (200 μL) of CTA1DD-AVI4M2e protein and 100 μg of Sef4M2e protein were given; Group 3: 200 μL of 1% gelatin in PBS was given.
图4肠液特异性IgA抗体和血清特异性IgG抗体ELISA结果
Fig.4ELISAresultsofintestinalfluid-specificIgAandserum-specificIgG

A: IgA titer of segmented intestine in group 1. B: IgA titer of segmented intestine in group 2.
Group 1: 200 μg (200 μL) of CTA1DD-AVI4M2e protein was given; Group 2: 100 μg (200 μL) of CTA1DD-AVI4M2e protein and 100 μg of Sef4M2e protein were given.
图5不同部位肠液特异性IgA抗体ELISA结果
Fig.5ELISAresultsofintestinalfluid-specificIgAindifferentsegmentedintestines
3 讨论
本研究设计的目的蛋白理论相对分子质量为 46 160,但其在SDS-PAGE图中显示的条带位于55 000~70 000。有研究表明,携带His-Tag的融合蛋白在电泳过程中由于空间位阻效应导致观察到的相对分子质量大于其理论值[12]。本研究所表达的融合蛋白两端均含有His-Tag,这可能是造成观察值与理论值偏差较大的原因。
图1结果显示,目的蛋白在未进行诱导时有少量表达,随着诱导剂IPTG的加入和诱导条件的优化,其表达量上升,表明构建的重组质粒中CTA1DD-AVI4M2e蛋白出现了泄漏表达。蛋白免疫印迹鉴定结果中,第2泳道未诱导样品出现免疫印迹,进一步证实CTA1DD-AVI4M2e出现了泄漏表达。
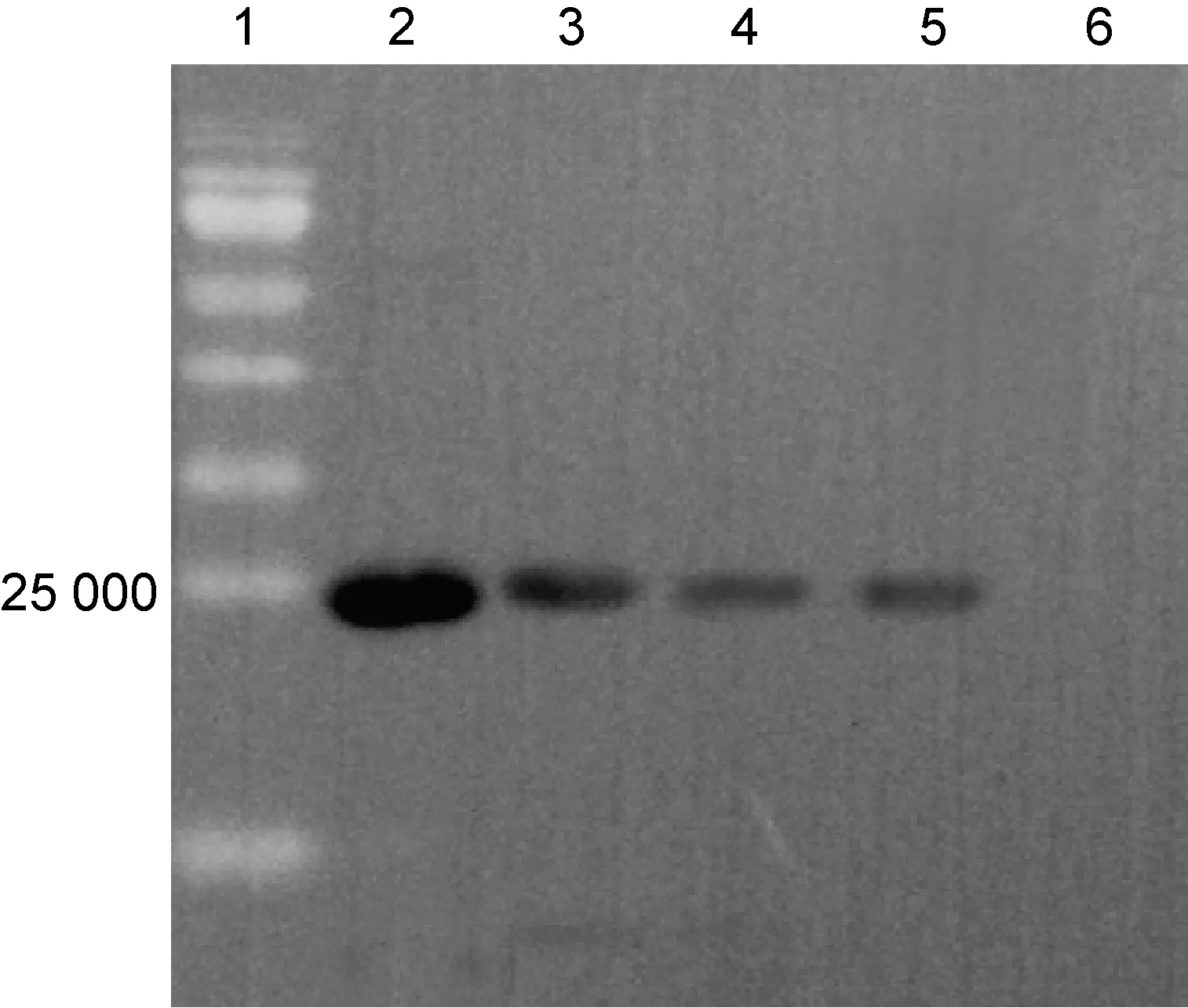
Lane 1: pre-stained protein marker; Lane 2: GST188-M2e1; Lane 3: GST188-M2e2; Lane 4: GST188-M2e3; Lane 5: GST188-M2e4; Lane 6: GST188.
图6M2e蛋白免疫印迹检测结果
Fig.6WesternblottingresultsofM2e
A: Specific test of M2e peptides; B: Specific test of Sef4M2e.
图7M2eELISA检测结果
Fig.7ELISAresultsofM2e
pXXGST-1与pXXGST-2为一组热诱导蛋白载体,pXXGST-2质粒在42 ℃诱导条件下表达截短的GST188多肽,pXXGST-1为截短的GST188融合表达载体,适合融合短肽的表达。将4个M2e构建在pXXGST-1质粒C端,可分别诱导表达GST188-M2e1、GST188-M2e2、GST188-M2e3和GST188-M2e4[13]。融合蛋白CTA1DD-AVI4M2e诱导产生的特异性IgA抗体能特异性识别4个单独的M2e,也能与串联的4M2e发生抗原抗体反应。初步判断CTA1DD-AVI4M2e引起了肠黏膜免疫反应,诱导产生了针对4M2e的特异性IgA抗体。
本研究通过灌服CTA1DD-AVI4M2e融合蛋白诱导肠黏膜产生特异性IgA抗体,发现抗体效价在肠道中呈现中间段最低、上段较高和下段最高的特点。吴斌等[14]使用口服微胶囊疫苗免疫罗非鱼,发现鱼肠道中IgA抗体效价自上而下逐渐升高。本研究结果与其有一定相似性,提示未来可尝试进行肛门给药方式进行免疫。在继续探索口服免疫方式上,如何避免或减少消化道蛋白酶的消化是应关注的重点。本研究虽然利用明胶对重组蛋白做了保护,但还可对保护剂进一步探索。例如,利用新型无毒材料如壳聚糖、海藻酸钠等将蛋白包裹起来制成微胶囊[15-16],口服之后能很大程度减少降解,到达受体部位后及时释放有效蛋白。乳酸菌是一种肠道益生菌,长期存在于肠道中,可利用其作为生物载体来运送疫苗。将表达重组疫苗的基因和特定启动子克隆至乳酸菌中,经口服到达肠道,在适宜条件下诱导表达重组蛋白疫苗,使其精确定位于肠黏膜表面诱导黏膜免疫反应[17]。
禽流感病毒疫苗通过口服免疫、舌下免疫和皮肤注射免疫等均可诱导机体产生黏膜免疫反应[18-19]。本研究最终构建的重组蛋白CTA1DD-AVI4M2e具有黏膜免疫和体液免疫效果,产生特异性IgA和IgG抗体,但是否能起到广谱性抗禽流感病毒作用还需进一步的病毒攻击动物实验来加以验证。
