石墨烯纳米复合物的制备及其可见光催化性能
2018-08-09朱建君陈宇洋朱威研田秀丽
朱建君,陈宇洋,朱威研,徐 帆,田秀丽,杨 宁
(信阳师范学院 化学化工学院,河南 信阳 464000)
0 引言
二氧化钛是一种n型半导体,具有成本低、无毒、高稳定性及优异的光催化性能等特点,近年来广泛应用于光催化降解有机污染物、光解水产氢、太阳能电池、传感器等领域[1,2].然而,由于TiO2禁带较宽(锐钛矿相的禁带宽度Eg为3.2 eV,金红石相的禁带宽度Eg为3.0 eV),只能吸收约占太阳光总能量5%的紫外线,导致太阳能利用率很低.减小TiO2禁带宽度使材料的吸收光谱向可见光区扩展,从而高效利用约占太阳光能总能量45%的可见光成为提高太阳能利用率的技术关键.针对这一系列问题,科学家们已尝试用多种方法实现了TiO2光响应向可见光区移动以提高太阳能转化效率,如负载贵金属Ag、Pt、Pd等[3-5],半导体NiO[6]、CdS[7]、Ag3PO4[8]等.此外,在光照条件下,光生电子和光生空穴的快速复合也是导致TiO2光催化效果降低的主要因素.
石墨烯(Graphene)是一种由碳原子以sp2杂化方式形成的蜂窝状的、一个原子层厚度的准二维材料[9],因具有良好的导电(室温下电荷迁移率为200 000 cm2/(V·s))、导热(热导率为5000 W/(m·K))、高的比表面积(约2630 m2/g)而备受关注.近几年,利用石墨烯取代价格昂贵的贵金属来制备TiO2复合光催化材料已被广泛研究 . 利用石墨烯强的吸附能力及电荷转移能力将光生电子迅速转移,从而有效阻止光生电子和光生空穴的复合.到目前为止,已报道TiO2/石墨烯或TiO2/氧化石墨烯复合光催化剂作为吸附剂或光催化剂用来吸收或降解甲基橙、亚甲基蓝、罗丹明B等[10-12].
本实验首先采用Hummers法制备氧化石墨烯,后以Ti(SO4)2为钛源,利用水热法制备出TiO2及TiO2/石墨烯纳米复合物.在此水热过程中,氧化石墨烯被还原成石墨烯,同时生成的TiO2纳米球负载在石墨烯片层上,实现TiO2纳米球的均匀分散.利用XRD、SEM、TEM、UV-vis等表征手段对材料的微观结构进行研究;以甲基橙为降解物对材料的光催化效果进行探索,并研究石墨烯的加入对TiO2光催化效果的影响机理.
1 实验部分
1.1 试剂与仪器
石墨粉,NaNO3,H2SO4,甲基橙,KMnO4,Ti(SO4)2,30% H2O2.以上试剂均为分析纯.三次蒸馏水,实验室自制.利用日本理学MiniFlex600型X射线衍射仪对样品晶体结构进行测试;通过日立S-4800I型冷场发射扫描电子显微镜系统和Tecnai G2 F20场发射透射电子显微镜表征样品微观结构;采用南京胥江XPA-7型光反应仪对有机染料进行光降解实验,并利用上海元析UV-8000S型紫外可见分光光度计测试光照后甲基橙溶液的吸光度.
1.2 氧化石墨烯的制备
氧化石墨烯(GO)根据文献[13]中改进Hummer法制备.在250 mL烧瓶中分别依次加入2.0 g石墨粉末、1.0 g NaNO3和46 mL H2SO4,在冰水浴中使其搅拌均匀;然后将6.0 g KMnO4分数次缓慢加入到上述溶液中,保持温度20 ℃以下,机械搅拌60 min;将反应温度升温至35 ℃,持续搅拌30 min;将92 mL H2O逐滴加入到体系中,保持98 ℃持续搅拌30 min,后移去热源,自然冷却至室温后机械搅拌10 min;将280 mL H2O和2 mL 30% H2O2的混合液缓慢加入到体系中,溶液颜色接近棕色.将上述溶液离心洗涤至溶液pH值至中性,冷冻干燥,待用.
1.3 TiO2/石墨烯纳米复合物的制备
将150 mg氧化石墨分散于360 mL 1 mol/L H2SO4溶液中,超声分散30 min;室温条件下,5.4 g Ti(SO4)2逐滴加入到上述氧化石墨烯分散液中;将上述混合液装入反应釜中,在一定温度下反应数h,离心洗涤数次,烘干过夜,待用.各复合物的制备条件见表1.

表1 TiO2/石墨烯纳米复合物的制备条件Tab. 1 Preparation condition of TiO2/graphene nanocomposite
1.4 可见光降解甲基橙溶液
将100 mL甲基橙溶液(浓度为12 mg/L)加入到石英光反应管中,加入0.10 g光催化剂,暗室搅拌30 min使其吸脱附达到平衡.采用400 W金卤灯作为光催化反应的光源,每隔一段时间取溶液8 mL,离心分离,取上层清液在紫外可见分光光度计上测定甲基橙溶液在462 nm处的吸光度,并用以下公式计算甲基橙溶液在光照下的降解率.
降解率(%)=(1-C/C0)×100=
(1-A/A0)×100,
其中:C0、C分别是甲基橙溶液的起始浓度和被测浓度;A0、A分别是甲基橙溶液的起始吸光度和被测吸光度.
2 结果与分析
2.1 XRD结构表征
图1是一系列TiO2/RGO的XRD谱图,表1是样品TiO2/RGO-1~18对应的实验条件.由图1(a)可知,TiO2/RGO-1在2θ≈11°处出现氧化石墨烯的特征衍射峰,根据布拉格公式:d=λ/(2sinθ) 计算此氧化石墨的晶面间距约0.80 nm,表明TiO2/RGO-1中存在大量未反应的氧化石墨烯;2θ≈25.28°处极弱的衍射峰表明体系中只有极少量的锐钛矿相TiO2生成.由图1可知,随着反应时间(或反应温度)的增加,氧化石墨烯的衍射峰逐渐消失,表明氧化石墨烯在水热过程中被还原,石墨烯的层间距被原位生成的TiO2颗粒撑开,且复合体系中石墨烯层间的TiO2随着反应时间(或反应温度)的增加而增多;与标准谱图对照,TiO2以锐钛矿相稳定存在于体系中.由图1各样品的XRD谱图,根据谢乐公式D=kλ/(βcosθ)计算可知,在水热反应温度为100 ℃时,所制得的TiO2/RGO-2~5中锐钛矿相TiO2的晶粒尺寸分别为8.81、9.71、10.77、12.02 nm;在水热反应温度为150 ℃时,所制得的TiO2/RGO-7~11中锐钛矿相TiO2的晶粒尺寸分别为12.37、14.44、16.32、16.60、17.28 nm;在水热反应温度为200 ℃时,所制得的TiO2/RGO-13~17中锐钛矿相TiO2的晶粒尺寸分别为17.27、21.50、23.00、26.34、29.95 nm.因此,水热反应温度的升高或反应时间的增加都有利于提高锐钛矿相TiO2的结晶度.
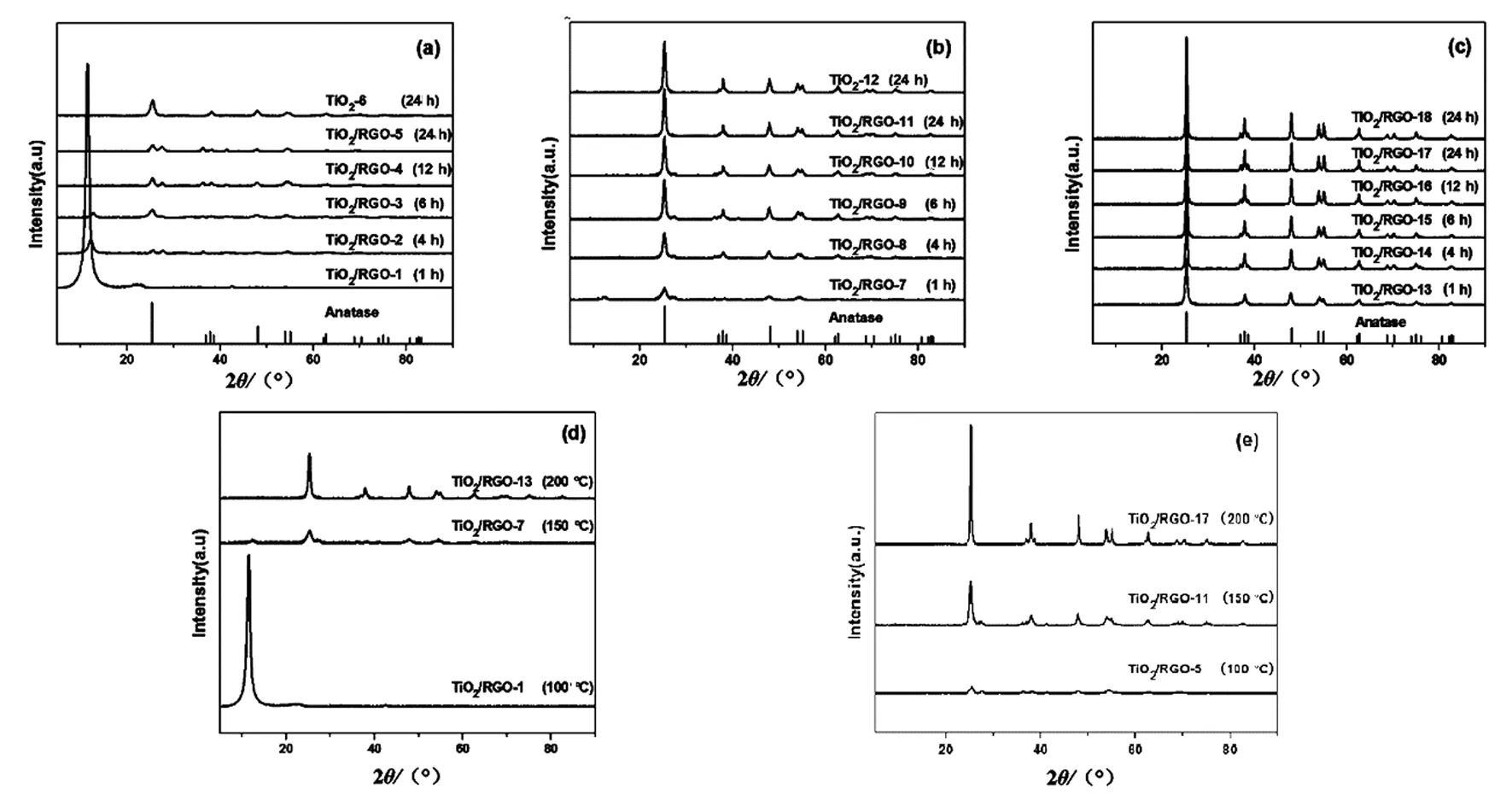
图1 不同反应温度和时间制备出的TiO2/RGO的XRD谱图(a)反应温度为100 ℃;(b)反应温度为150 ℃;(c)反应温度为200 ℃;(d)反应时间为1 h ;(e)反应时间为24 h Fig. 1 The XRD patterns of TiO2/RGO, prepared at (a) 100 ℃, (b) 150 ℃, (c) 200 ℃ in different reaction time; The XRD patterns of TiO2/RGO, prepared at the different reaction temperature in (d) 1 h, (e) 24 h
2.2 微观形貌表征
图2是所制备出的氧化石墨烯及TiO2/石墨烯纳米复合物的SEM图和TEM图.

图2 (a)氧化石墨烯、(b)TiO2/RGO-5、(c)TiO2/RGO-17的SEM图、(d)TiO2/RGO-5的TEM图Fig. 2 SEM images of (a) GO, (b) TiO2/RGO-5, (c) TiO2/RGO-17, (d) TEM image of TiO2/RGO-5
图2(a)中片状结构是氧化石墨烯纳米片,由图2(b)可知球形TiO2颗粒较均匀地分散于石墨烯片层中,并且随着反应温度的增加,石墨烯片上的TiO2纳米粒子逐渐增多而导致小部分的团聚(如图2(c)).图2(d)是TiO2/RGO-5的TEM图,进一步证明TiO2纳米粒子均匀分散在单层石墨烯纳米片上,TiO2纳米粒子直径大约400 nm.
2.3 紫外-可见漫反射分析
图3是一系列固体样品TiO2/RGO的紫外-可见漫反射谱图.由图3可知,TiO2负载于石墨烯片上而形成的TiO2/RGO复合光催化剂比纯TiO2有更强的可见光吸收,且吸收峰发生红移.当水热反应温度为100 ℃和150 ℃时,TiO2/RGO复合材料在可见光区的吸收强度随着水热反应时间的增加而降低(如图3(a)、(b)所示).当反应温度增加到200 ℃时(如图3(c)所示),石墨烯的加入依然可以提高TiO2/RGO复合材料在可见光区的响应,TiO2/RGO-13在可见光区的吸收强度最高、TiO2/RGO-14次之,而水热反应超过6 h之后,制备出的复合材料在可见光区的响应基本保持不变.结果表明,体系中加入石墨烯可以使生成的TiO2均匀分散在石墨烯片上,最大程度地使TiO2的催化活性中心暴露在表面以提高催化活性,并且具有良好导电性的石墨烯片可以将光生电子转移防止光生电子和光生空穴再次复合降低其催化活性.但随着反应时间的增加(或反应温度的增加),体系中生成的TiO2逐渐增加导致TiO2发生团聚而使材料的光催化活性有所降低.
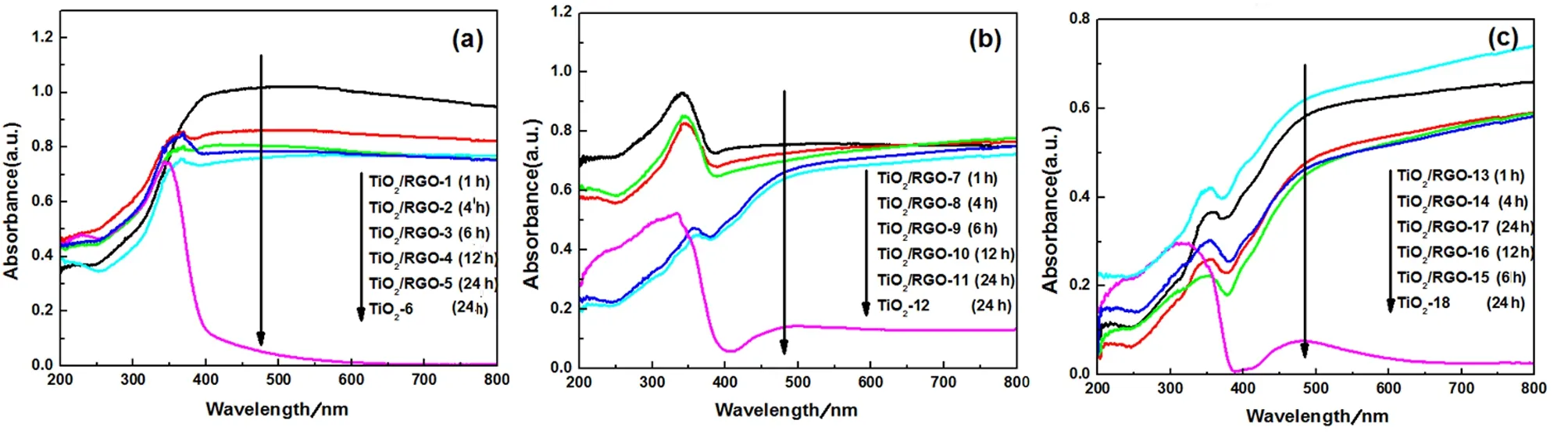
图3 反应温度为(a)100 ℃、(b)150 ℃、(c)200 ℃时,TiO2/RGO复合材料的紫外-可见漫反射谱图Fig. 3 UV-vis spectra of TiO2/RGO composites, prepared at (a) 100 ℃,(b) 150 ℃,(c)200 ℃
2.4 可见光催化性能研究
在可见光照射下,TiO2及TiO2/ RGO纳米复合物的光催化性能通过对甲基橙溶液的降解进行研究(如图4).图4(a)、(b)、(c)分别是水热反应温度为100 ℃、150 ℃、200 ℃时TiO2及TiO2/ RGO纳米复合物对浓度为12 mg/L甲基橙溶液的降解曲线.结合上述有关TiO2/ RGO纳米复合物的紫外-可见漫反射的讨论,在可见光区有较强吸收的材料对甲基橙溶液的降解效率也相应提高.

图4 TiO2及TiO2/石墨烯纳米复合物对甲基橙溶液的降解曲线 (a)100 ℃、(b)150 ℃、(c)200 ℃Fig. 4 Photocatalytic degradation of methyl orange by TiO2 and TiO2/RGO composites (a)100 ℃, (b)150 ℃, (c)200 ℃
由图4可知,加入纯TiO2光催化剂(如,TiO2-6、TiO2-12、TiO2-18)的甲基橙溶液经可见光照射10 min后降解率分别为:61.4%、72.5%、84.9%,但10 min的光照仍未能使其降解达到平衡,而相应的TiO2/RGO纳米复合物在更短时间内可使甲基橙溶液的降解率大大提高,说明TiO2颗粒负载于石墨烯纳米片上能有效提高甲基橙溶液在可见光照射下的降解率.原因可能是,较均匀分散在石墨烯纳米片上的TiO2颗粒能充分的与溶液中的染料分子接触,暴露于体系中更多的TiO2活性位点使甲基橙溶液的降解效率提高.同时,石墨烯良好的导电性能使TiO2的光生电子很快通过石墨烯纳米片转移,从而降低光生电子和光生空穴复合的几率,提高材料的光催化性能.
由图4(a)和(c)可知,在可见光照射下,较低温度(水热反应温度为100 ℃)制备出的TiO2/RGO纳米复合物可以使甲基橙溶液在8 min内降解率达到97.5%(TiO2/RGO-1);而较高温度(水热反应温度为200 ℃)制备出的TiO2/RGO纳米复合物可以使甲基橙溶液在3 min内降解率达97.6%(TiO2/RGO-13).结合以上XRD结果,说明水热反应温度越高,制得的锐钛矿相TiO2的结晶度越好,在保证高降解率的同时所需降解时间越短.另一方面,在相同水热反应温度下(如图4(a)所示),体系中TiO2含量及结晶度会随着反应时间的增加而升高.当水热反应时间为1 h时,样品TiO2/RGO-1中极少量TiO2的生成使得石墨烯在体系中的含量很高,大量未负载TiO2颗粒的石墨烯纳米片能够在黑暗处理过程中吸附溶液中大量的甲基橙分子,当吸脱附达到平衡之后,溶液中未被吸附的甲基橙分子在8 min光照后降解率为97.5%;而24 h水热反应使得TiO2/RGO-5纳米复合物中TiO2含量较高,TiO2颗粒较均匀的分散在石墨烯纳米片上,可见光照射8 min后甲基橙溶液的降解率为98.9%.若水热反应时间固定为24 h时,随着反应温度的升高,甲基橙溶液降解完全需要的时间由8 min (100 ℃)减少到3 min(200 ℃),甲基橙溶液的降解率由98.9%提高到99.9%.
因此,当水热反应温度为200 ℃,反应时间为24 h所制备出的TiO2/ RGO -17纳米复合物对甲基橙溶液的降解表现出最优的光催化效果,仅3 min的可见光照射可以实现甲基橙溶液高达99.9%的降解率.
3 结论
本实验以硫酸钛为钛源、石墨烯为载体,采用水热法制备出一系列TiO2及其TiO2/石墨烯纳米复合物,通过XRD、SEM、TEM等对材料晶型、TiO2纳米颗粒在体系中的微观结构及分散状态进行了表征,利用紫外-可见漫反射谱对材料在可见光区的响应进行了研究,并通过在可见光照射下降解甲基橙溶液评价了TiO2/石墨烯纳米复合物具有比纯TiO2更高的光催化活性.氧化石墨烯在水热过程中被还原且与锐钛矿相TiO2发生复合,均匀分散在石墨烯纳米片的两侧的TiO2纳米粒子最大程度的使其活性中心暴露在表面以提高催化活性,并且具有良好导电性的石墨烯纳米片可以将光生电子转移防止光生电子和光生空穴再次复合降低其催化活性.随着反应时间(或反应温度)的增加,分散在石墨烯片上的TiO2晶粒尺寸随之增加,当反应时间为24 h,水热反应温度为200 ℃时制备出的TiO2/石墨烯纳米复合物具有最高的可见光光催化活性,经过3 min的可见光照射可以实现甲基橙溶液完全降解,降解率高达99.9%.
