胆囊胆固醇结石患者肝脏诱导低密度脂蛋白受体降解物的表达水平
2018-08-08陈进宏
林 晶 陈进宏 鲁 明
(复旦大学附属华山医院普外科 上海 200040)
胆囊结石是消化系统的常见病,随着生活方式和饮食结构等的改变,其发病率呈较快的上升趋势,部分地区患病率已超过10%[1];同时以胆固醇(cholesterol,Ch)为主要成分的胆囊胆固醇结石已经成为我国胆囊结石患者的主要发病类型。胆囊胆固醇结石是由肝脏分泌胆汁成分异常、胆道系统功能异常、环境及基因等多因素共同参与而形成,其中胆汁胆固醇过饱和被认为是胆固醇结石形成的始发因素[2]。
肝脏分泌至胆汁中的胆固醇主要来源于肝脏摄取血循环中脂蛋白结合的胆固醇,仅少部分来源于自身合成的胆固醇及水解的胆固醇酯(cholesterol ester,ChE)[3]。位于肝细胞表面的清道夫受体B1(scavenger receptor class B1,SRB1)、低密度脂蛋白受体(low density lipoprotein receptor,LDLR)和LDLR相关蛋白(LDLR-related protein,LRP)可将脂蛋白所携带的Ch摄取入肝细胞[4-6]。许多研究表明LDLR在Ch代谢和Ch分泌中起重要作用,且与胆囊胆固醇结石的形成密切相关[7-8]。LDLR的表达水平受到转录和转录后两方面的调节。激活固醇调节元件结合蛋白2 (sterol regulatory element binding,protein 2,SREBP2)可以诱导LDLR基因的转录,使其mRNA水平增加;同时激活SREBP2也能诱导前蛋白转化酶枯草溶菌素9(proprotein convertase subtilisin/kexin type 9,PCSK9)的表达,PCSK9在转录后水平下调LDLR蛋白质水平[9-10]。
近年来还发现了另外一种在蛋白质降解水平调控LDLR的蛋白质——诱导LDLR降解物(inducible degrader of the LDLR,IDOL)[11]。IDOL具有E3泛素连接酶活性,可通过不同于PCSK9的途径降解LDLR,从而影响肝脏Ch代谢和Ch分泌。全基因组关联分析发现,IDOL基因上的一些单核苷酸多态性与Ch代谢相关[12-13]。IDOL在人类胆囊胆固醇结石中的作用未见报道,本文对胆囊胆固醇结石患者肝脏IDOL的表达进行研究。
资 料 和 方 法
一般资料收集复旦大学附属华山医院普外科2015年6月至12月住院行腹部手术的21例胆囊胆固醇结石患者(cholesterol gallstone patients,GS)及14例行其他腹腔手术的非胆囊胆固醇结石患者(gallstone-free patients,GSF)的血清、胆汁及肝脏组织标本。所有结石患者的结石均参照傅培彬法[14]和肉眼观察证实Ch含量>65%;非胆囊结石患者经B超证实胆囊无结石且偏光显微镜下胆汁无胆固醇结晶。所有入组患者排除糖尿病、高胆固醇血症、肥胖、酒精滥用史及肝脏恶性肿瘤等可能影响肝脏功能的情况,同时无服用脂质代谢药物史。本研究经复旦大学附属华山医院伦理委员会批准,所有患者签署知情同意书。比较两组患者性别、年龄、体重指数(body mass index,BMI)和空腹血糖等一般资料,差异均无统计学意义(表1)。
表1GS与GSF患者一般资料比较
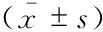
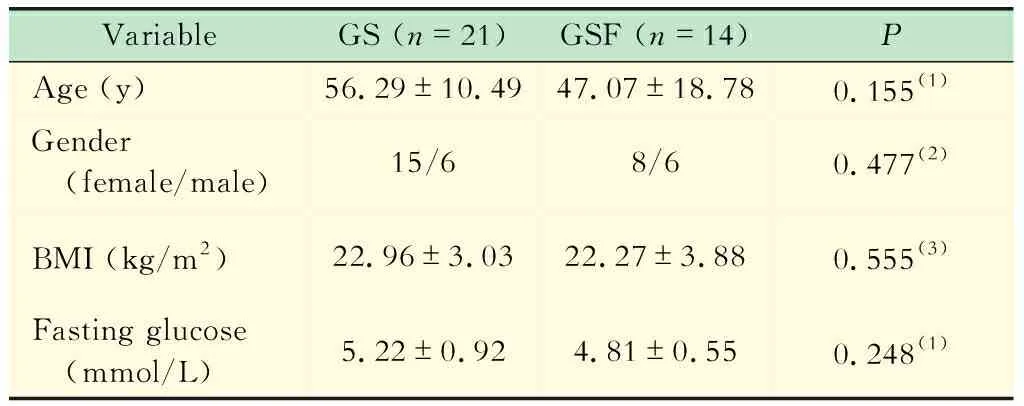
VariableGS (n=21)GSF (n=14)PAge (y)56.29±10.4947.07±18.780.155(1)Gender (female/male)15/68/60.477(2)BMI (kg/m2)22.96±3.0322.27±3.880.555(3)Fasting glucose (mmol/L)5.22±0.924.81±0.550.248(1)
(1)Mann Whitney U test;(2)Fisher exact test;(3)Student’sttest.
生化检测按照试剂盒说明书,采用酶法测定血清和胆汁的总Ch、总胆汁酸、三酰甘油(triglyceride,TG)及磷脂等指标。Ch饱和指数(cholesterol saturation index,CSI)按照Ch、磷脂、胆汁酸含量,根据Carey量表[15]计算得到。
实时定量PCR检测运用实时定量PCR(qRT-PCR)方法检测肝脏组织相关基因mRNA水平。按照试剂盒说明书从肝脏提取总RNA,逆转录(基因引物序列见表2)后行PCR反应,条件如下:95 ℃、15 min;95 ℃、15 s,60 ℃、20 s,72 ℃、30 s,共40个循环;95 ℃、15 s,60 ℃、15 s,95 ℃、15 s。采用相对表达量法(2-△△CT法)[16]进行数据分析,内参选用GAPDH基因。

表2 实时定量PCR检测人基因引物序列Tab 2 Primer sequences for quantitative real-time PCR in human
免疫组化检测运用免疫组化方法检测肝脏IDOL和LDLR蛋白质水平。甲醛固定的石蜡块切成3 mm切片,预处理和封闭后,抗IDOL抗体按1∶100稀释、抗LDLR抗体按1∶300稀释后4 ℃反应过夜,洗涤后HRP标记的二抗室温孵育60 min,DAB显色液显色8 min后苏木精复染,酒精脱水、透明、封片。切片于100倍显微镜下观察,并用CCD相机拍照,使用同样的显微镜工作条件与相机工作条件一次完成所有照片,并将照片保存为TIFF格式。IDOL和LDLR蛋白质存在于胞质[19],使用Image-pro plus 6.0 软件分析照片的区域光密度平均值(mean option density,MOD),代表蛋白质的相对水平。
结 果
两组患者血清和胆汁生化指标比较GS组血清总Ch、血清TG、高密度脂蛋白和低密度脂蛋白与GSF相比,差异均无统计学意义(表3)。GS组胆汁Ch含量和CSI明显高于GSF组,差异均有统计学意义(P均<0.01,表4)。而GS组胆汁中磷脂和总胆汁酸浓度与GSF组相比,差异无统计学意义(表4)。
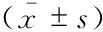
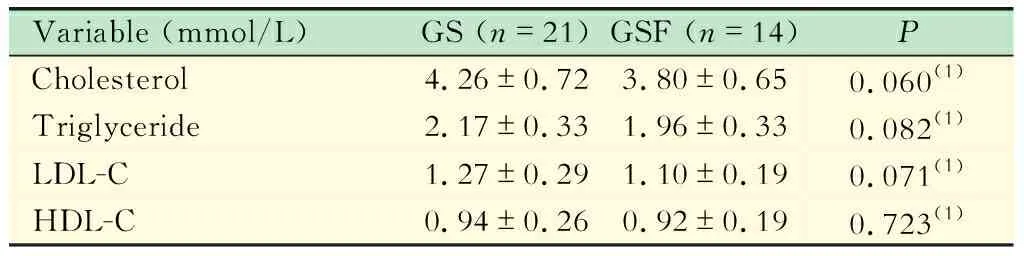
Variable (mmol/L)GS (n=21)GSF (n=14)PCholesterol4.26±0.723.80±0.650.060(1)Triglyceride 2.17±0.331.96±0.330.082(1)LDL-C 1.27±0.291.10±0.190.071(1)HDL-C 0.94±0.260.92±0.190.723(1)
(1)Student’sttest.
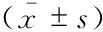
VariableGS (n=21)GSF (n=14)PCholesterol (mmol/L)13.12±1.358.88±0.83<0.001(1)Phospholipids (mmol/L)29.77±3.3231.75±2.660.070(1)Bile acid (mmol/L)161.48±31.34152.45±19.340.344(1)Cholesterol (mol%)6.57±1.314.63±0.49<0.001(2)Phospholipids (mol%)14.90±2.7316.58±1.930.144(2)Bile acid (mol%)78.53±3.7378.80±2.100.580(2)Total biliary lipids (g/dL)10.74±1.5410.29±1.040.342(1)CSI1.18±0.180.79±0.09<0.001(3)
(1)Student’sttest;(2)Mann Whitney U test;(3)Unpairedttest with Welch’s correction.
两组患者肝脏相关基因的mRNA和蛋白质水平采用荧光定量PCR检测肝脏Ch代谢相关基因表达情况发现,GS组肝脏IDOL mRNA水平显著低于GSF组(P<0.05,图1)。两组其他肝脏Ch代谢相关基因的mRNA水平差异无统计学意义(图1)。定量免疫组化分析发现,GS组肝脏IDOL蛋白质水平同样低于GSF组(P<0.05,图2A、2B),这与两组患者IDOL mRNA水平结果相一致。而GS组肝脏LDLR蛋白质水平则高于GSF组(P<0.05,图2C、2D)。
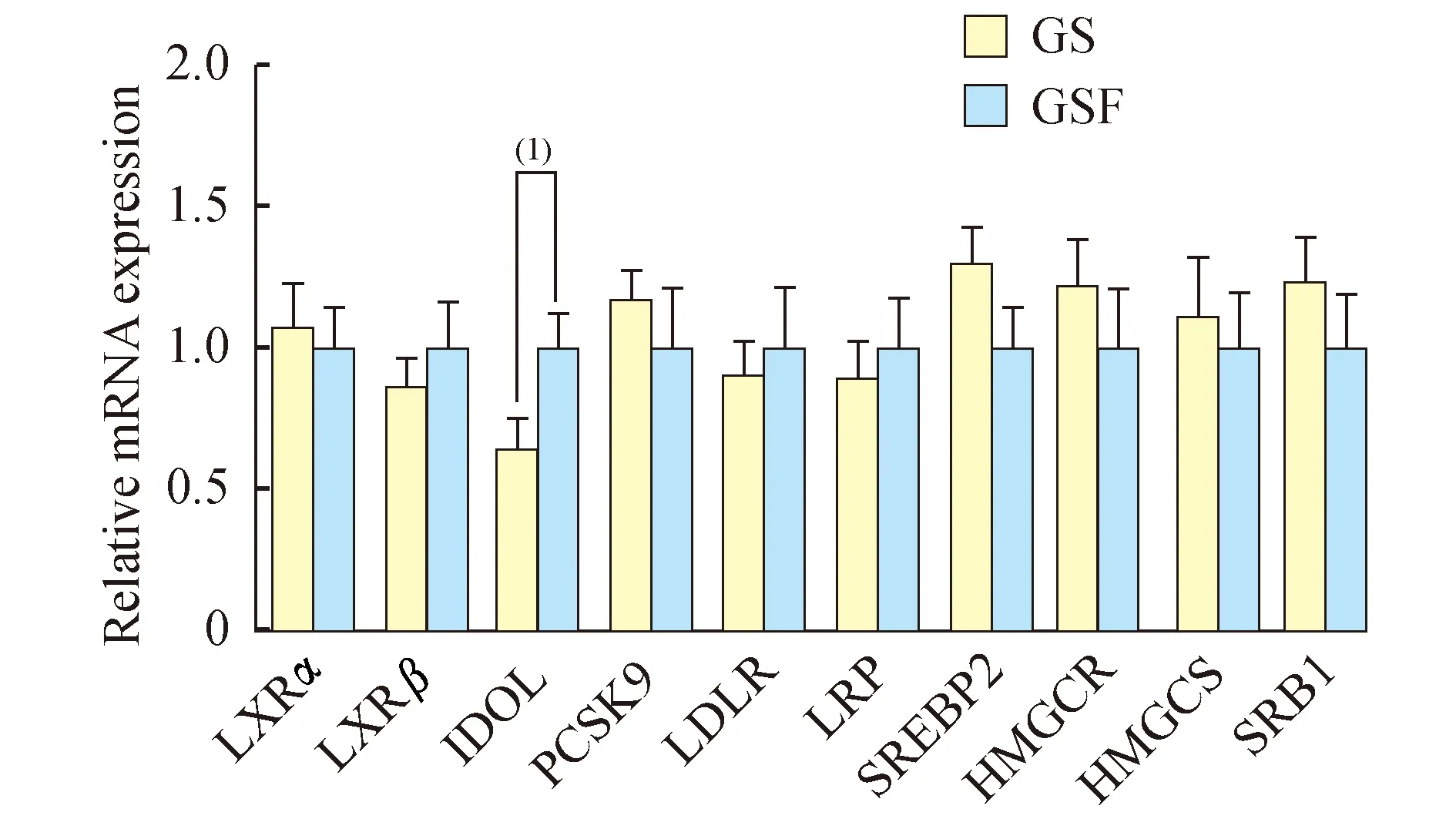
Hepatic related genes mRNA levels in GS (n=21) and GSF (n=14) were analyzed by qRT-PCR.(1)P<0.05.
图1两组患者肝脏相关基因表达
Fig1ExpressionofhepaticrelatedgenesinGSandGSF
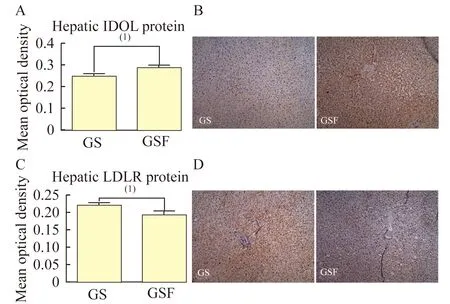
A:Semi-quantitative immunohistochemical analysis of hepatic IDOL protein in GS (n=21) and GSF (n=14);B:Hepatic specimens were immunohistochemically stained for IDOL (×100);C:Quantitative immunohistochemical analysis of hepatic LDLR protein in GS and GSF;D:Hepatic specimens were immunohistochemically stained for LDLR (×100).(1)P<0.05.
图2两组患者肝脏IDOL和LDLR蛋白质水平
Fig2ProteinlevelsofhepaticIDOLandLDLRinGSandGSF
GS肝脏基因蛋白质水平与胆汁生化指标相关性分析GS肝脏IDOL蛋白质水平与肝脏LDLR蛋白质水平呈明显负相关(图3A)。GS肝脏LXRα mRNA水平与肝脏IDOL蛋白质水平呈明显正相关性(图3B)。GS肝脏IDOL蛋白质水平与胆汁Ch摩尔百分比及CSI的水平呈明显负相关性(图3C、3D)。
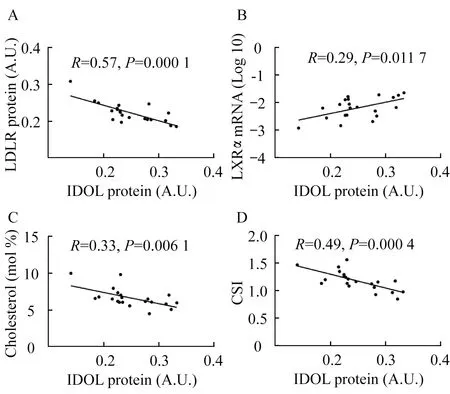
图3 GS肝脏基因/蛋白质与胆汁生化指标相关性分析Fig 3 Correlation analysis of hepatic related genes/protein and biliary lipid composition in GS
讨 论
胆囊胆固醇结石病因复杂,胆汁中Ch过饱和进而析出Ch结晶是形成胆固醇结石的先决条件[20]。我们研究发现GS胆汁Ch含量和CSI明显高于GSF,这与以往许多报道一致[21-23]。由肝脏分泌至胆汁中的Ch主要来源于肝脏摄取血循环中脂蛋白结合的Ch[3]。Zanlungo等[8]报道小鼠喂养致石饲料后,肝脏分泌至胆汁中的Ch主要来源于由LDLR介导而摄取的Ch。LDLR是肝脏摄取血浆脂蛋白中Ch的重要介质。Uppal等[7]发现33%野生型小鼠在喂养致石饲料3周后形成胆囊Ch结晶,而LDLR基因敲除小鼠在同样条件下不形成胆囊Ch结晶;这提示在缺失LDLR情况下血浆Ch不能正常转运进入肝细胞,肝脏分泌的胆汁中Ch含量下降,导致不易形成胆囊胆固醇结石。这些研究结果说明LDLR在Ch代谢和胆汁Ch分泌中起重要作用。
近年来研究发现一种具有E3泛素连接酶活性的IDOL可在蛋白质水平降解LDLR。IDOL基因启动子区存在LXRα结合位点,激活LXRα能上调IDOL表达[11]。我们研究发现IDOL mRNA和蛋白质水平在GS肝脏中均下降;相关性分析表明IDOL蛋白质水平与胆汁Ch含量及CSI均呈明显的负相关。这提示肝脏IDOL表达水平的下降提高了患者胆汁Ch含量及CSI。而且GS组肝脏LDLR蛋白质水平高于GSF,同时GS组IDOL蛋白质水平与LDLR蛋白质水平也呈明显负相关,这提示IDOL可能通过LDLR来影响胆汁Ch浓度,进而在胆囊胆固醇结石的形成中发挥作用。虽然GS组肝脏IDOL的表达量低于GSF组,但是两组LXRα mRNA的水平未见明显差异。这提示除LXRα外,可能还存在其他影响IDOL表达的途径。
LDLR的表达除了受IDOL转录后水平调节外,还受SREBP2途径调节。当细胞内Ch水平下降时,可激活SREBP2,在转录水平增加LDLR基因的表达;但同时也增加PCSK9的表达,PCSK9可在转录后水平降解LDLR[9-10]。我们的研究结果显示,两组患者肝脏SREBP2和PCSK9的表达量差异无统计学意义。这可能是因为本研究样本量较少,不能完全除外抽样误差。因此,SREBP2和PCSK9与LDLR的关系还需要进一步研究。
综上所述,胆囊胆固醇结石的始发原因为患者胆汁中Ch含量过饱和。肝脏IDOL表达水平的下降与胆囊胆固醇结石的形成有关,其作用机制可能是通过提高肝脏LDLR蛋白质水平,增加肝脏Ch水平,进而影响胆汁中的Ch含量。IDOL影响胆囊胆固醇结石形成的具体机制还有待深入研究。
