极端嗜热菌Thermosipho melanesiensis 普鲁兰酶基因的异源表达与酶学性质分析
2018-08-08王明道王红阳孙利鹏邱立友
王明道,邢 岩,邱 爽,王红阳,孙利鹏,邱立友*
(1. 河南农业大学 农业部农业微生物酶工程重点实验室,河南 郑州 450002;2. 河南仰韶生化工程有限公司,河南 渑池472400)
0 引言
普鲁兰酶(pullulanase)是一种重要淀粉脱支酶[1],可以水解支链淀粉中的α-1,6-糖苷键,提高支链淀粉的水解效率.根据作用位点的不同将普鲁兰酶分为两类[2]:专一性水解普鲁兰糖和支链淀粉中的α-1,6-糖苷键生成麦芽三糖和直链淀粉的Ⅰ型普鲁兰酶(type I pullulanase, EC.3.2.1.41),属于糖苷水解酶GH13家族(glycoside hydrolase 13,GH13);不仅能水解普鲁兰糖和支链淀粉中的α-1,6-糖苷键而且能水解淀粉中α-1,4-糖苷键的Ⅱ型普鲁兰酶(type Ⅱ pullulanase, EC.3.2.1.1/41),属于糖苷水解酶GH13和GH57家族[3].
普鲁兰酶在工业上被较多的用于淀粉的加工中的糖化反应[4].糖化反应是在温度60 ℃、pH 5.0 的条件下利用糖化酶将糊精和低聚糖进一步水解为葡萄糖和麦芽糖的过程.其中糖化酶对 α-1,6-糖苷键的水解效率特别低[5].而在糖化反应时加入普鲁兰酶(也称极限糊精酶)可以最大限度地减少糊精生成量,使麦芽糖的含量提高到 924 g/kg[6].
在糖化反应中的作用条件要求普鲁兰酶具有较高的热稳定性.嗜热酶是指最适反应温度在60 ℃ 以上的一类水解酶.目前,已有许多嗜热性普鲁兰酶被开发出来.1966年,德国学者WALLENFELS 和 BENDER[7]对来自于产气杆菌 (Aerobacteraerogenes) 中的普鲁兰酶进行了纯化和酶学性质研究,结果表明在100 ℃ 条件下温育3 min,其酶活可保持原始酶活的 80%.1984年,丹麦Novo公司[8]获得一株能够分解普鲁兰糖的嗜酸性芽孢杆菌 (Bacillusacido-pullulyticus),此菌产生的普鲁兰酶最适温度为60 ℃ .2000年,KRIEGSHUSER和 LIEBL等[9]测定了来源于Thermotogamaritima的普鲁兰酶的性质,该酶在90 ℃ 条件下的半衰期为3.5 h.2002年MESSAOUD等[10]报道了来源于Bacillusthermoleovorans的普鲁兰酶,其最适温度为75 ℃. 2009年,徐金利等[11]分离到一株编码热稳定性普鲁兰酶的嗜热球菌Thermococcussp. HJ21,该普鲁兰酶在 80~100 ℃ 条件下仍保持较高的酶活性,在100 ℃保温2 h仍有 50% 以上的酶活.2014年,吴华伟等[12]分析了来自于ThermusthermophilusHB27的热稳定性普鲁兰酶的性质,结果显示该普鲁兰酶在 60~70 ℃ 下温育2 h 后其活性仍保持 90%,并且在 80 ℃ 下半衰期为2 h.2016年,KAHAR等[13]分析了来自于Anoxybacillussp. SK3-4的普鲁兰酶,该酶在最适温度为60 ℃.2017年,高涛等[14]分离出来自于解淀粉芽孢杆菌的普鲁兰酶,该酶的最适温度是60 ℃,在70 ℃保温4 h后酶活力残留在60%以上.
极端嗜热菌Thermosiphomelanesiensis是ANTOINE等[15]从西南太平洋深海火山口分离出来的一株严格厌氧的超嗜热菌,其最佳生长温度为70 ℃,基因组全长为1 915 kb,含有多个注释的酶基因,如铁氧还原蛋白(登录号:WP_012056246.1)、糖苷水解酶(登录:WP_012056988.1)和本文中要研究的普鲁兰酶(登录号:WP_012056687.1),但目前为止已经被验证功能的蛋白寥寥无几.
因此本研究从德国菌种保藏中心购买的基因组Thermosiphomelanesiensis(DSM 12029),将该普鲁兰酶基因进行异源表达后进行了酶学性质分析.
1 材料与方法
1.1 实验材料
大肠杆菌Rosetta(DE3)和DH5α为实验室保藏菌株.Thermosiphomelanesiensis的基因组购自德国菌种保藏中心.
1.2 试剂与药品
普鲁兰糖,东京化成工业株式会社;Co2+螯合琼脂糖凝胶TALON Metal Affinity Resin,TaKaRa公司产品;限制性内切酶NheⅠ和XhoⅠ、T4 DNA Ligase、Q5 超保真DNA聚合酶,NEB公司;琼脂糖凝胶DNA回收试剂盒、DNA产物纯化试剂盒、质粒小量提取试剂盒,北京索莱宝科技有限公司.
1.3 重组质粒的构建
根据NCBI上公布的嗜热菌株Thermosiphomelanesiensis的普鲁兰酶基因序列设计并合成引物,序列如下:
FTM:5′CTAGCTAGCATGAAAAGATTGTTAGTGTTTTTCTTTGTTTTGTTATC3′
RTM:5′TCCGCTCGAGTTTGTTCTTGTAAAAAACATATGCAGAAATTCCTTC3′
PCR扩增嗜热菌Thermosiphomelanesiensis中的普鲁兰酶基因TP-pulA,反应体系(50 μL):ddH2O,34 μL;5×Q5 反应缓冲液,10.0 μL;10 mmol/L dNTPs,1.0 μL;上游特异引物F(10 μmol/L),2 μL;下游特异引物R(10 μmol/L),2 μL;DNA 模板(TP基因组) 0.5 μL,Q5酶(2 U/ μL),0.5 μL.反应条件:98 ℃预变性3 min,98 ℃变性40 s,66 ℃退火15 s,72 ℃延伸80 s,共35个循环,72 ℃延伸4 min.切胶纯化后4 ℃保存备用.
TM-pulA双酶切反应体系(50 μL):ddH2O,10.0 μL;10×Cursmart缓冲液,5.0 μL;NheI, 1.0 μL; XhoI , 1.0 μL; 纯化后的TM-pulA(29 mg/L),33.0 μL.反应条件:37 ℃保温3 h,65 ℃灭活30 min.切胶纯化后4 ℃保存待用.
设置pET21a双酶切反应体系(50 μL):ddH2O,28.0 μL;10×Cursmart缓冲液,5.0 μL;NheI, 1.0 μL; XhoI , 1.0 μL; 纯化后的pET21a(79 mg/L),15.0 μL.反应条件:37 ℃保温3 h,65 ℃灭活30 min.切胶纯化后4 ℃ 保存待用.
用T4 DNA ligase连接纯化后的酶切产物,连接体系如下:ddH2O,8.0 μL;纯化后的pET21a-TP-pulA(59.8 ng/μL),2.0 μL;线性的pET21a(12.1 mg/L),7 μL;T4 DNA 连接酶,1.0 μL;10×T4 DNA连接酶缓冲液,2 μL.反应条件如下:16 ℃,16 h,65 ℃灭活30 min.转化大肠杆菌DH5α感受态细胞,涂板,挑取阳性克隆,提取质粒.将位置正确的质粒送金唯智公司测序.
1.4 目的基因的诱导表达与纯化
将测序正确的质粒转入大肠杆菌Rosetta(DE3)中,挑取转化子到含抗生素(氯霉素终浓度0.036 g/L ,氨苄西林0.1 g/L)的5 mL LB培养液中,37 ℃培养12~16 h,取 2 mL 菌液接种到200 mL 含抗生素(同上)液体 LB 培养基中,37 ℃、220 r/min 培养 2~3 h(OD600值0.6~0.8),加入终浓度0.2 mmol/L的IPTG,220 r/min、30 ℃ 培养 6~8 h.于4 ℃、6000 r/min下,离心10 min收集菌体,加入0.1倍发酵液体积的蒸馏水使菌体充分混匀,放置冰上进行超声波破碎(3 s× 4 s× 99次),4 ℃、12 000 r/min,离心30 min,取出上清作为粗酶液.经Co2+螯合琼脂糖凝胶进行纯化后4 ℃保存待用.
1.5 酶水解产物分析
分别配制浓度为1%的葡萄糖、麦芽二糖、麦芽三糖和普鲁兰糖标准溶液;将100 μL粗酶液与100 μL 1%的普鲁兰糖混合均匀,在70 ℃条件下保温30 min.
分取10 μL上述样品进行薄层色谱分析.上行展开两次.将展开后的硅胶板用10%的硫酸乙醇显色,显色条件为高温烘箱100 ℃加热10 min.
1.6 酶学性质分析
1.6.1 最适pH值
配制pH值为5.8、6.0、6.2、6.4、6.6、6.8、7.0、7.2、7.4、7.6、7.8、8.0的磷酸缓冲液.在冰浴条件下,每100 μL酶液,加入100 μL 1%普鲁兰糖和100 μL不同 pH 的磷酸缓冲液,在70 ℃条件下反应15 min,加入600 μL DNS溶液终止反应,煮沸10 min显色,冷却后用蒸馏水定容至5 mL,混合均匀,在540 nm波长下测吸光值.以灭活的酶液作为对照,每个反应设置 3 个重复,取平均值.绘制曲线,从而确定酶最适反应 pH值.
1.6.2 最适温度
设置温度梯度为55 ℃、60 ℃、65 ℃、70 ℃、75 ℃、80 ℃、85 ℃、90 ℃、95 ℃.在冰浴条件下,每100 μL酶液,加入100 μL 1%普鲁兰糖和100 μL最适pH值下的磷酸缓冲液,在不同的温度条件下反应15 min,加入600 μL DNS溶液终止反应,煮沸10 min显色,冷却后用蒸馏水定容至5 mL,混合均匀,在540 nm波长下测吸光值.以灭活的酶液作为对照,每个反应设置 3 个重复,取平均值.绘制曲线,从而确定酶的最适反应温度.
1.6.3 半衰期
将酶液在70 ℃下保温,分别在0、3、6、9、12 h取出450 μL样品置于冰水混合物中,待全部取出后进行反应.在冰浴条件下,取100 μL不同保温时间的酶液,加入100 μL 1%普鲁兰糖和100 μL最适 pH 下的磷酸缓冲液,在最适温度下反应15 min,加入600 μL DNS溶液终止反应,煮沸10 min显色,冷却后用蒸馏水定容至5 mL,混合均匀,在540 nm波长下测吸光值.每个反应设置 3 个重复,取平均值.绘制半衰期曲线,从而确定酶的半失活时间.
1.6.4 不同化学试剂对酶活的影响
用与最适pH的磷酸缓冲液酸碱度一样的蒸馏水分别配制浓度为10 mmol/L NaCl、KCl、CaCl2、MgCl2、ZnCl2、MnCl2、CoCl2、AlCl3、FeCl3、SDS、EDTA 的溶液.在冰浴条件下,分别取100 μL上述溶液加入到100 μL酶液中,使其终浓度为5 mmol/L,在50 ℃水浴锅中保温30 min.然后向上述保温的体系中分别加入100 μL 1%普鲁兰糖,在最适温度下反应15 min,加入600 μL DNS溶液终止反应,煮沸10 min显色,冷却后用蒸馏水定容至5 mL,混合均匀,在540 nm波长下测吸光值.以灭活的酶液做对照,以未加入化学试剂测得的酶活为100%,每个反应设置3个重复,取平均值.绘制柱状图,分析不同化学试剂对TM-pulA酶活的影响.
1.6.5 酶促动力学参数
分别配制浓度为2、4、6、8、10、12、14、16 g/L的普鲁兰糖溶液作为底物.在冰浴条件下,取100 μL 稀释后的纯酶液,100 μL最适pH的磷酸缓冲液和 100 μL不同浓度的普鲁兰糖底物混合,最适温度下反应10 min;加入600 μL DNS 溶液,煮沸10 min,冷却后用蒸馏水定容至5 mL,混合均匀,在540 nm波长下测吸光值.以灭活的酶液做对照,每个反应设置 3 个重复,取平均值.将测得的 OD 值代入葡糖糖标准曲线,计算酶水解不同浓度底物得到的还原糖质量,从而算出不同底物浓度[S]下酶的反应速度V,根据 Hanes-Woolf 法作图以 [S]/V-[S] 作散点图,并进行线性拟合得一直线,斜率为 1/Vmax,与坐标轴横轴的截距为-Km.计算得到Km、Vmax、Kcat及Kcat/Km的值.
2 结果与分析
2.1 重组质粒的构建
以 FTM、RTM为引物,以Thermosiphomelanesiensis的基因组为模板扩增得到的普鲁兰酶基因TM-pulA,大小为2529 bp;重组质粒如图1所示.将该质粒送金唯智测序,测序结果与理论序列完全一致.

图1 重组质粒pET21a-TM-pulA的电泳图Fig. 1 Electrophoresis of plasmids of pET21a-TM-pulA
2.2 酶的纯化及结果分析
TM-pulA经Co2+螯合琼脂糖凝胶纯化后,用聚丙烯酰胺凝胶电泳检测,如图2所示,TM-pulA纯化后仍有一条杂带,但杂带的蛋白量特别低,后续实验将忽略该杂带产生的影响.
2.3 酶水解产物分析
用TLC板检测TM-pulA的水解普鲁兰糖的产物,如图3所示,TM-pulA可以水解普鲁兰糖,而且水解产物是麦芽三糖,可以推断TM-pulA作用于普鲁兰糖时主要水解α-1,6-糖苷键,说明TM-pulA是Ⅰ型普鲁兰酶.
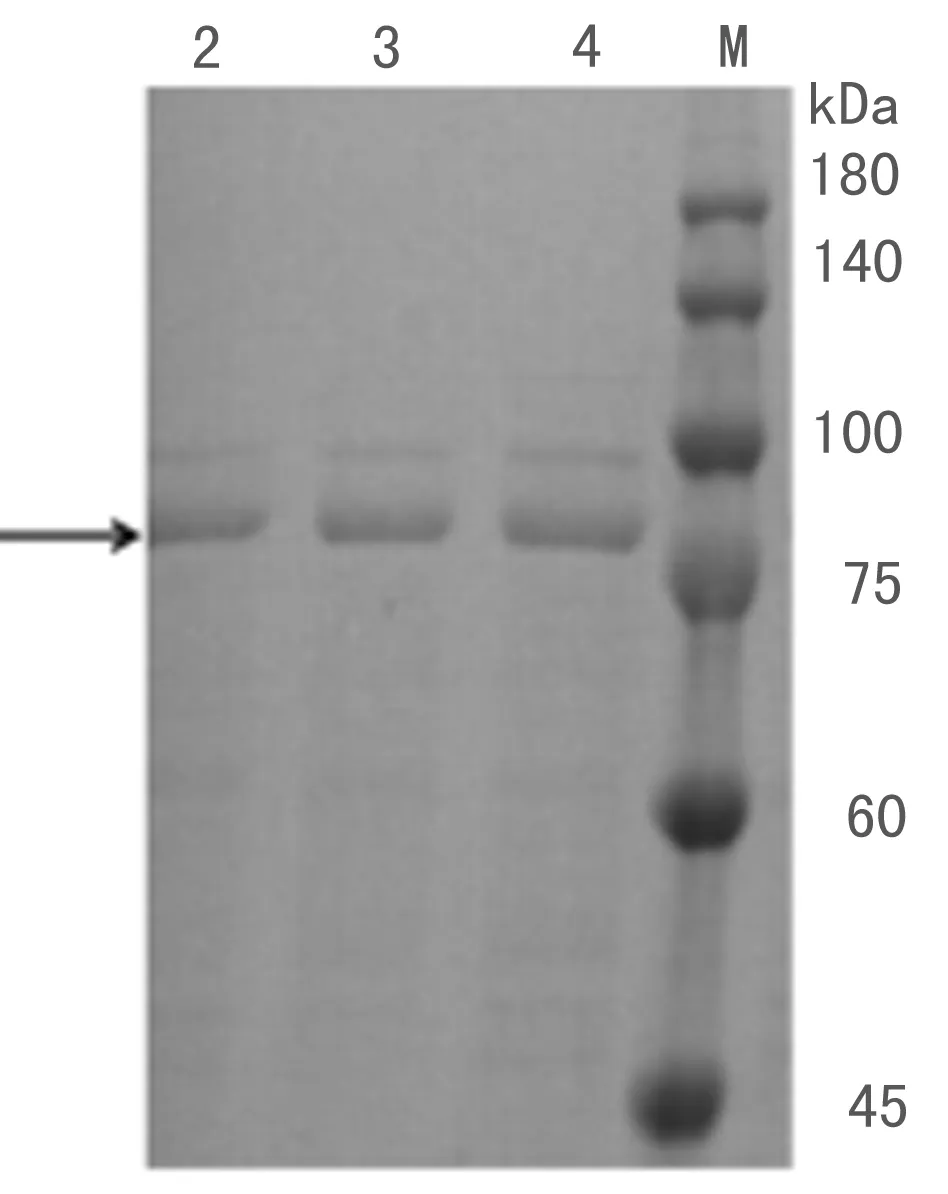
图2 TM-pulA纯酶的 SDS-PAGE检测Fig. 2 SDS-PAGE analysis of pure enzyme
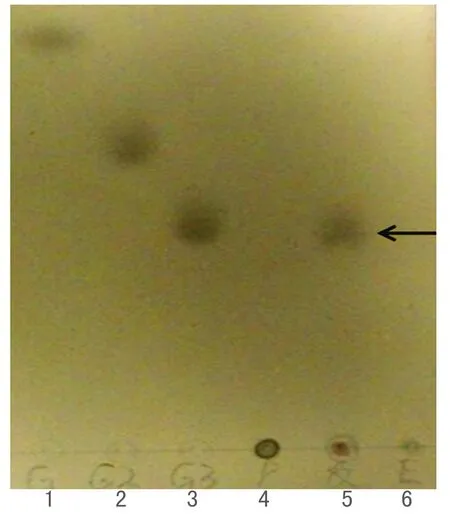
图3 TM-pulA的水解产物的 TLC 检测Fig. 3 Analysis hydrolyzate of TM-pulA
2.4 纯酶的酶学性质分析
2.4.1 最适pH
TM-pulA 的最适 pH 是 5.8,见图4.作用范围比较宽,在 pH 5.0~6.4 范围内保持最适酶活的 80% 以上.
2.4.2 最适温度
用纯化后的 TM-pulA 进行最适温度的测定.如图5所示,TM-pulA最适温度是 80 ℃.因此,TM-pulA是嗜热酶.
2.4.3 半衰期
TM-pulA半衰期的结果如图6所示.根据酶残余酶活与保温时间的指数函数计算出 TM-pulA在 70 ℃下的半失活时间为 4.75 h,说明TM-pulA具有较高的热稳定性.
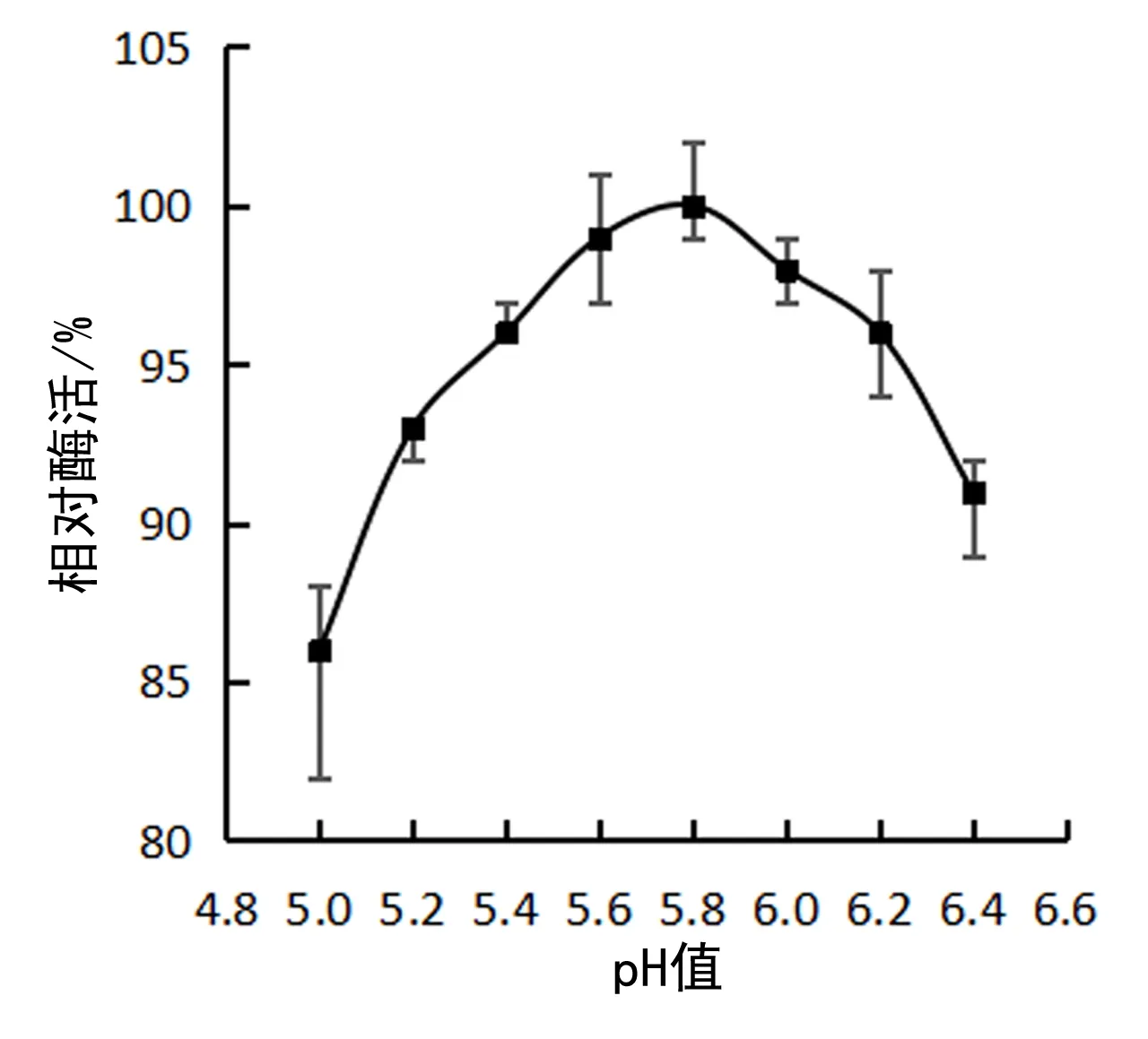
图4 TM-pulA 纯酶的最适pHFig. 4 The optimum pH of pure enzyme

图5 TM-pulA 纯酶的最适温度Fig. 5 The optimum temperture of pure enzyme
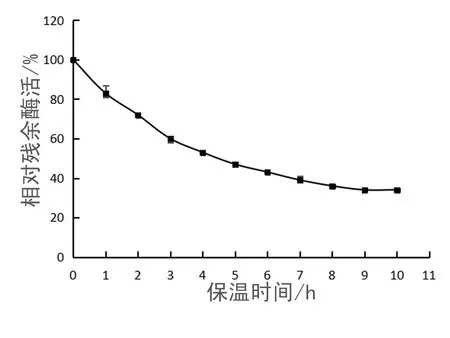
图6 TM-pulA纯酶的半衰期Fig. 6 The half-life of pure enzyme
2.4.4 不同化学试剂对酶活的影响
不同化学试剂对酶活的分析结果如7所示.终浓度为5 mmol·L-1的Na+、K+、Ca2+、Mg2+对TM-pulA的酶活没有明显的促进作用; 终浓度为5 mmol·L-1的Mn2+、Co2+、AL3+、Fe3+、SDS及EDTA对TM-pulA的酶活有不同程度的抑制作用,其中在终浓度为5 mmol·L-1的SDS的作用下TM-pulA的活性基本丧失.

图7 部分化学试剂对 TM-pulA酶活的影响Fig. 7 Effects of Different chemical reagenton enzyme activity of TM-pulA
1. CK; 2. NaCl; 3. KCl; 4. CaCl2; 5. MgCl2; 6. ZnCl2; 7. MnCl2; 8.CoCl2; 9. AlCl3; 10. FeCl3; 11. SDS; 12.EDTA
2.4.5 酶促动力学参数
对酶的动力学参数进行分析,根据Hanes-Woolf作图法得到如图8所示的曲线.通过计算得到Km、Vmax、Kcat及Kcat/Km分别为4.68 g·L-1, 0.0085 mmol·L-1·s-1, 71.18 s-1和15.21 L·g-1·s-1.
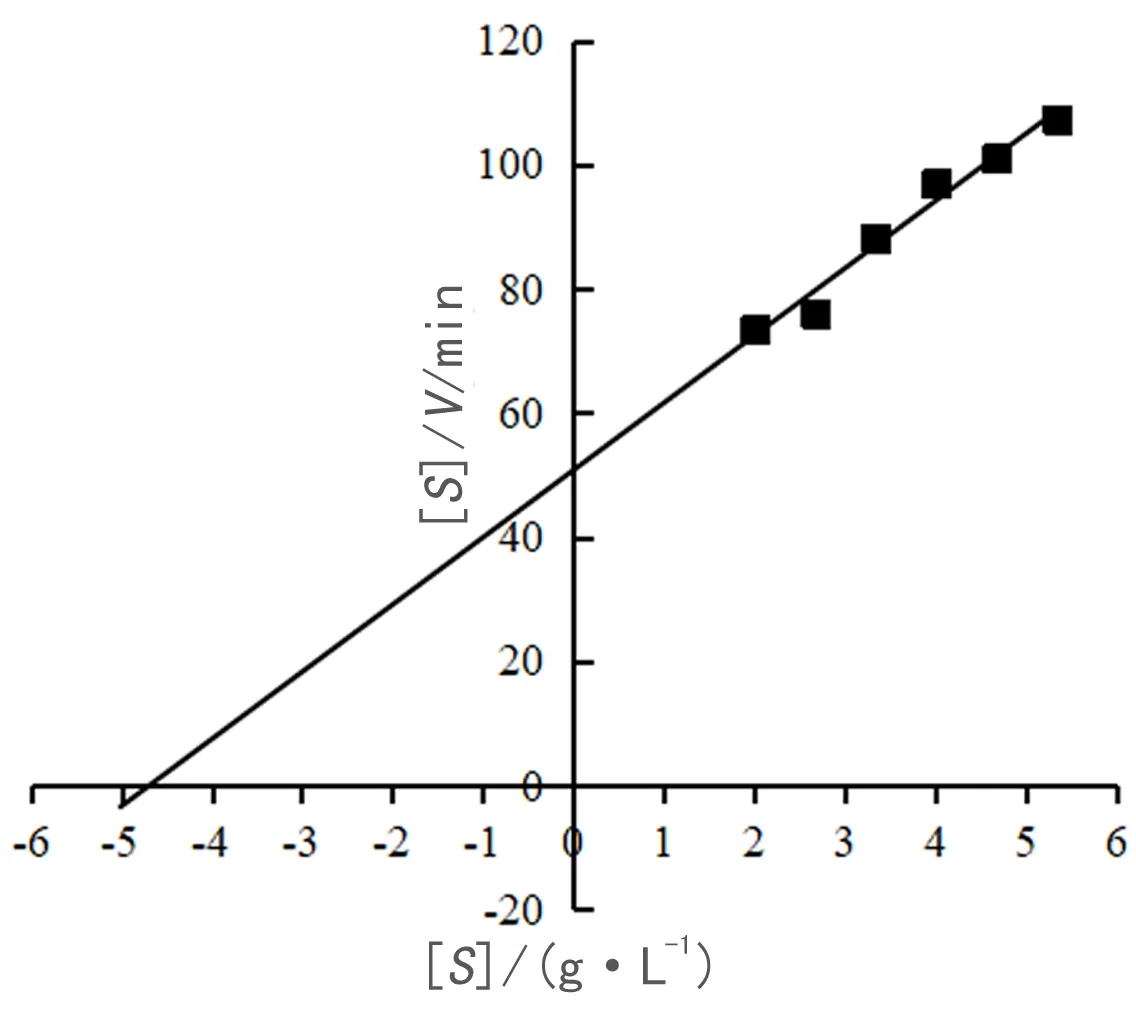
图8 TM-pulA的酶促动力学参数Fig. 8 Kinetic parameters of TM-pulA of pullulan
3 结论
将来源于Thermosiphomelanesiensis的普鲁兰酶与数据库中已经验证功能的普鲁兰酶进行同源性比对,结果发现来源于嗜热微生物Thermosiphomelanesiensis的TM-pulA与FervidobacteriumpennivoransVen5[16,17]来源的普鲁兰酶基因(登录号:WP_041263510.1)的相似度最高,碱基序列同源性为74%;来源于FervidobacteriumpennivoransVen5的普鲁兰酶的最适温度和最适pH分别为85 ℃和6.0,在80 ℃下的半衰期为2 h.二者相似度最高却在酶学性质上有很大的差异,说明TM-pulA是新的普鲁兰酶.
该普鲁兰酶最适温度为85 ℃,pH值是5.8,并在pH值5.0~6.4范围内仍能保持最适活性的80%左右.基本满足了糖化反应所要求的温度60 ℃、pH值5.0的要求.然而,该酶在还存在表达量不够高的问题.后期本课题组将通过定点突变、酶分子改造等手段继续研究,以真正实现该酶的工业化.
