氯气的制备与金属反应的性质实验一体化改进
2018-08-08赵桂周东
赵桂周东
(重庆市第八中学校,重庆)
在苏教版化学教材《化学1》和人教版(旧版)化学教材中,讲氯气的化学性质时,有安排钠、铁、铜等金属与氯气反应,钠与氯气的实验操作是将装有氯气的集气瓶倒扣在放有钠的石棉网上,而铁、铜与氯气反应的操作步骤是将一束烧红的铁丝或铜丝迅速地放入装有氯气的集气瓶中,这样的操作是十分的简便,但是实验过程中铁丝和铜丝的温度降得比较快,往往不能得到理想的实验结果。此外实验时会有氯气漏到空气中,而氯气具有较强的腐蚀性和毒性,会影响教师和学生的身体健康,会污染环境。因此,我们结合绿色化学的理念,对该实验进行了如下改进,并且取得了良好的实验效果。
实验装置图如图1所示
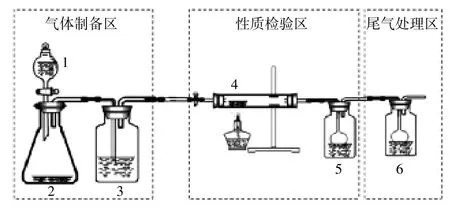
图一 氯气的制备和与金属反应的实验装置
装置中仪器和药品说明:
1为分液漏斗,内装有浓盐酸
2为锥形瓶,内装有高锰酸钾(或氯酸钾)
3为洗气瓶,内装有饱和氯化钠溶液
4为硬质玻璃管,内装有待反应金属
5为洗气瓶,内装有蒸馏水
6为洗气瓶,内装有浓氢氧化钠溶液
在选择制备氯气的反应物时,我选择的是高锰酸钾(或氯酸钾)和浓盐酸,与课本上的使用的二氧化锰和浓盐酸比较,前者在制备氯气时不需要加热,操作起来更加方便简单。
操作步骤及实验现象:实验时,先打开装置1中分液漏斗的活塞,将浓盐酸逐滴滴入装置2中,与高锰酸钾反应制备氯气,经过装置3中的饱和食盐水的洗涤得到纯净的氯气,当黄绿色的氯气充满整个实验装置后,用酒精灯对硬质玻璃管4中的适量金属(如铁丝)加热,然后观察装置4和5中的实验现象。当装置4中的铁丝红热、反应剧烈时撤去酒精灯,停止加热,可以观察到4中有红棕色的烟,5中的水逐渐变成棕黄色,用注射器向装置5中加入硫氰酸钾,溶液变红。最后利用装置6中的浓氢氧化钠溶液吸收剩余的氯气。如果装置4中的金属是铜,则在装置5中可以看到溶液颜色逐渐变为蓝色,用注射器向其加入氢氧化钠溶液可观察到蓝色絮状沉淀,如果是钠,在室温高于27℃时则不用加热。
课堂上我们也可以这样简化装置,去掉装置3和5,这样能达到同样的效果。比如铁在氯气中燃烧时,我们可以观察到的现象是装置6中的溶液中出现红棕色絮状沉淀;而铜在氯气中燃烧时则可以看到装置6中出现蓝色絮状沉淀,此时的装置6不仅起到了除掉尾气的作用,也同样承担起了验证金属在氯气中燃烧得到的产物的作用。
在中学化学实验教学的过程中除本文中提到的氯气与金属反应外,也可以用于氯气与非金属反应。在做氯气与非金属反应时,我们需要将装置3中的饱和食盐水换成干燥剂氯化钙,将装置4中的金属换成相应的非金属(比如干花、湿花、有色布条、蓝色石蕊试纸、淀粉碘化钾试纸等),可以单独做某一个实验,也可以将多个实验同时放入装4中进行,对比更加明显。
此外本实验装置还可以应用于其他类似的气体与固体反应的实验,比如二氧化硫的性质实验、氧气的性质实验等。
本实验装置的优点是既能观察到理想的实验现象又能有效地避免氯气溢出到空气中,且操作简单、安全、环保,在教室这样相对封闭、空气流动性差的空间内,我们的改进装置能避免师生在实验过程中过多地接触到有毒有害气体,保护师生的健康与安全。
