表面等离子共振测定CD45-FITC抗体与蛋白A特异性结合常数*
2018-08-08张晖薛洪宝陈飞剑王杰王充李柏青
张晖,薛洪宝,陈飞剑,王杰,王充,李柏青
(1.蚌埠医学院化学教研室,安徽 蚌埠 233030;2.感染与免疫安徽省重点实验室∥蚌埠医学院,安徽 蚌埠 233030)
为了实时监测和分析蛋白质、多肽、核酸等生物分子间的相互作用,经常选择不需任何标记、灵敏、快速的表面等离子共振(Surface plasmon resonance,SPR)技术[1-2]。它是实时测定预先固定在传感芯片上的配体与流过其表面的分析物反应的动力学参数、热力学参数等特异性结合参数的非常重要的有力手段[3-5]。
蛋白A能够强烈地与多种哺乳动物的IgG免疫球蛋白发生特异性结合[6],而且文献[7]表明:蛋白A与抗体的Fc端结合时使Fab端朝外,在一定程度上方便了抗体进一步结合抗原。蛋白A与不同免疫球蛋白IgG特异性结合程度不同[8],由此,可以利用蛋白A分离和提纯免疫球蛋白IgG。然而文献里有关能够直接反映蛋白A和免疫球蛋白特异性结合速度(如结合速率常数ka等)和程度(结合平衡常数Ka即亲和力等)的参数十分匮乏。为了更有效地分离和提纯免疫球蛋白IgG,避免盲目性,提高蛋白A分离和提纯免疫球蛋白IgG的效率,在工作前很有必要了解蛋白A与免疫球蛋白IgG特异性结合的有关参数。
本实验首先将免疫球蛋白 CD45-FITC抗体与固定在生物传感芯片表面上的蛋白A进行特异性结合,依据SPR仪实时监测的CD45-FITC抗体和蛋白A结合所获得的数据,获得该特异性结合的动力学信息:ka、解离速率常数kd,并对CD45-FITC抗体和蛋白A的亲和力作出评价。为蛋白A分离和提纯免疫球蛋白IgG工作提供参考和必要的实验数据。该方法具有快速、灵敏度高、消耗样品少等优点,是研究分析蛋白A和免疫球蛋白IgG抗体等生物分子相互作用比较理想的方法之一[9-10]。
1 实验部分
1.1 仪器与试剂
SR 7500DC型双通道SPR仪,蛋白A检测芯片(Planar protein A sensor chip),购于美国Reichert公司。pHS-3C酸度计(上海科学仪器有限公司);0.22 μm水相混合纤维素酯膜(海宁市正兴特种过滤设备制造有限公司)。
FITC偶联小鼠抗人CD45单克隆抗体(CD45-FITC抗体),天津协科生物科技有限公司产品;PBST-叠氮钠(0.1%,V/V)溶液(pH 7.36);氢氧化钠、盐酸、NaCl、SDS、甘氨酸等试剂均为分析纯。超纯水(电阻率≥18.2 MΩ)由杭州永洁达净化科技有限公司建造的实验室纯水和超纯水系统提供。
1.2 运行缓冲溶液和分析物CD45-FITC抗体溶液的制备
1.2.1 不同pH运行缓冲溶液和分析物CD45-FITC抗体溶液的制备 不同pH值(7.10、7.33、7.62、7.90和8.48)的PBST-叠氮钠(0.1%,V/V)溶液用NaOH或HCl溶液调节,分别用作运行缓冲溶液;然后使用上述缓冲溶液分别配制对应的某一浓度CD45-FITC抗体溶液,备用。
1.2.2 不同离子强度运行缓冲溶液和分析物CD45-FITC抗体溶液的制备 配制不同离子强度(含NaCl分别为0、25、50、75、100 mmol·L-1)、pH 7.90的PBST-叠氮钠(0.1%,V/V)溶液,分别作为运行缓冲溶液;然后使用上述缓冲溶液再分别配制对应的某一浓度CD45-FITC抗体溶液,备用。
1.2.3 不同浓度分析物CD45-FITC抗体溶液的制备 分析物CD45-FITC抗体用含75 mmol·L-1NaCl、pH 7.90的PBST-叠氮钠(0.1%,V/V)按1.00×10-7,5.00×10-8,… ,3.91×10-10mol·L-1浓度梯度稀释,备用。使用前,所有流过传感芯片的溶液都要用0.22 μm滤膜过滤并脱气。
1.3 SPR平台实时监测蛋白A与CD45-FITC抗体特异性反应的方法
SR 7500DC型双通道SPR仪平台用于实时监测蛋白A与CD45-FITC抗体的特异性反应。将洁净表面偶联蛋白A的蛋白A传感芯片插入SPR仪指定位置上,在芯片上放置用Triton X-100清洗后干燥的流通池,固定。选择“1.2”某一PBST-叠氮钠(0.1%,V/V)溶液作为运行缓冲溶液,在一定温度下设置流速为25 μL·min-1,等待基线稳定后,以右通道为参比通道,左通道流过“1.2”对应的CD45-FITC抗体溶液,并设置反应时间。反应完毕,注入w=0.5% SDS-50 mmol/L甘氨酸(pH 2.00)缓冲溶液使蛋白A传感芯片再生(即洗去芯片上和蛋白A特异性结合的CD45-FITC抗体),接着蛋白A传感芯片继续流过上述运行缓冲溶液。待基线稳定后进行下一次循环操作。
通过上述方法,CD45-FITC抗体与蛋白A特异性结合进程被实时监测,测定数据由Integrated SPR Autolink记录下来,并以响应折射率(Refractive index unit,RU)表示,该数据与蛋白A结合的CD45-FITC抗体的数量呈正相关。再用SPR仪制造商提供的Clamp XP软件进行数据处理,分析和拟合各参数值,得到CD45-FITC抗体与蛋白A特异性结合的ka、kd,再进一步计算出Ka。
2 结果和讨论
2.1 CD45-FITC抗体与蛋白 A 特异性结合条件的选择
2.1.1 酸度(pH)对CD45-FITC抗体与蛋白A特异性结合的影响 用“1.2.1”的PBST-叠氮钠(0.1%,V/V)溶液作为运行缓冲溶液和对应的分析物CD45-FITC溶液进行试验。由传感图可知,在所试验的分析物溶液pH范围内,CD45-FITC抗体与蛋白 A 特异性结合能力随pH值升高而增强,但pH>7.90时,两者的结合能力增加不明显。故选用pH 7.90 作为CD45-FITC抗体与蛋白A特异性结合的酸度条件。
2.1.2 离子强度对CD45-FITC抗体和蛋白A 特异性结合的影响 选用“1.2.2”的PBST-叠氮钠(0.1%,V/V)溶液(pH 7.90)作为运行缓冲溶液,注入对应的分析物CD45-FITC抗体溶液进样分析,得到传感图1。由图1可知,NaCl浓度越高,响应值越高。运行缓冲溶液里含有高浓度的盐增强了CD45-FITC抗体和蛋白A的结合程度,同时,也增加了分析物溶液中其它非分离提纯蛋白质和蛋白A的结合能力[11],即竞争反应也加强。所以,综合考虑,本实验选择含NaCl浓度为75 mmol·L-1、pH 7.90的PBST-叠氮钠(0.1%,V/V)溶液作为CD45-FITC抗体和蛋白A 特异性结合的反应介质,且该溶液作为运行缓冲溶液。
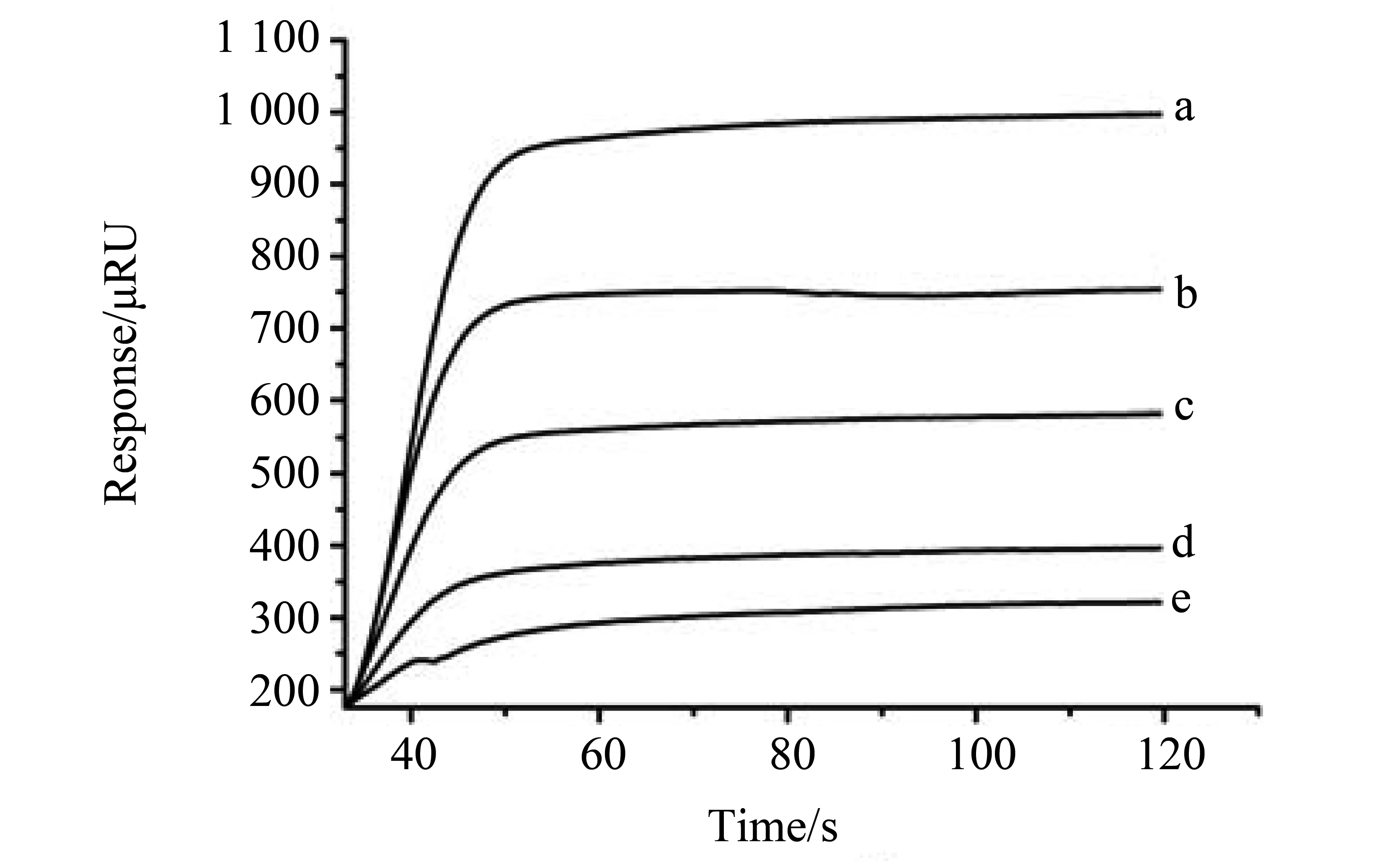
图1 c(NaCl)对CD45-FITC抗体和蛋白A特异性结合影响的传感图Fig.1 SPR sensorgrams of effect of concentrations of NaCl on CD45-FITC interaction with protein A c(NaCl)/(mmol·L-1):100(a);75(b);50(c);25(d);0(e)
2.2 方法重现性实验
以含75 mmol·L-1NaCl的PBST-叠氮钠(0.1%,V/V)溶液(pH 7.90)为运行缓冲溶液,“1.2.3”某一CD45-FITC抗体溶液为分析物,连续分析五次。结果表明,特异性结合响应最大值的相对标准偏差RSD为5.14%,表明这种实验方法能够测定CD45-FITC抗体与蛋白 A 特异性结合的ka和kd。
2.3 CD45-FITC抗体与蛋白A 特异性结合ka和kd的测定
分别设置仪器的温度为20 ℃和35 ℃,将“1.2.3”浓度不同的CD45-FITC抗体溶液进样后的传感图,见图2和图3。由图2和图3可知:20 ℃或35 ℃时,CD45-FITC抗体与传感芯片上的蛋白A发生特异性结合并趋于平衡。依据从低到高的浓度梯度,特异性结合响应曲线由低到高排列,并且增加的幅度和斜率依次递增。20 ℃时,在3.91×10-10~ 1.56×10-9mol·L-1CD45-FITC抗体浓度范围内,浓度升高时响应却基本上不发生变化,说明浓度较低时,与蛋白A发生特异性结合的CD45-FITC的量基本上不随CD45-FITC抗体浓度变化而改变,这是因为响应的变化与结合在传感芯片金属表面的生物大分子质量的变化成正比[12]。

图2 20 ℃时,不同c(CD45-FITC)抗体与蛋白A特异性结合传感图Fig.2 SPR sensorgrams of effect of concentrations of CD45-FITC on CD45-FITC interaction with protein A at 20 ℃c(CD45-FITC)/(mol·L-1):1.00×10-7(a);5.00×10-8(b);2.50×10-8(c);1.25×10-8(d);3.13×10-9(e);1.56×10-9(f);7.81×10-10(g);3.91×10-10(h)
在1.56×10-9~ 1.00×10-7mol·L-1浓度范围时,响应随时间增加,并且响应峰随浓度升高而相应增大,表明CD45-FITC浓度越高,与蛋白A特异性结合的量就越大。

图3 35 ℃时,不同c(CD45-FITC)与蛋白A特异性结合传感图Fig.3 SPR sensorgrams of effect of concentrations of CD45-FITC on CD45-FITC interaction with protein A at 35 ℃c(CD45-FITC)/(mol·L-1):1.00×10-7(a);2.50×10-8(b);1.25×10-8(c);6.25×10-9(d);3.13×10-9(e)
将图2和图3中的数据通过Clamp XP软件处理,得到20 ℃和35 ℃时CD45-FITC与蛋白A 特异性结合的动力学常数:ka和kd,由此计算出对应的Ka,见表1。

表1 20 ℃和35 ℃时蛋白A与CD45-FITC特异性结合常数1)Table 1 Specificity binding constants of the binding of CD45-FITC to protein A at 20 ℃ and 35 ℃
1)ka: association rate constant;kd: dissociation rate constant;Ka: association equilibrium constant;Ka=ka/kd
Ka用来定量描述蛋白A与CD45-FITC分子间的亲和力。通常,Ka越大表示配体和分析物结合的愈牢固。本实验的Ka值表明蛋白A与CD45-FITC分子为中等强度结合。
20 ℃时,CD45-FITC与蛋白A 结合的动力学常数:ka、kd与Ka值和文献[13]中的ka、kd与Ka值接近,存在差别可能是因为试验时溶液的pH值、离子强度等反应条件不同产生的。
2.4 CD45-FITC抗体与蛋白 A特异性结合的活化能(Ea)和焓变(△H)的测定
将“1.2.3”不同浓度的CD45-FITC抗体溶液分别在15、20、25、30和35 ℃下进样分析,获得上述各温度下的ka、kd和Ka,应用作图法能够得到CD45-FITC抗体与蛋白 A反应的Ea和△H。
2.4.1 CD45-FITC抗体与蛋白A特异性结合Ea的测定 分别以上述温度下的lgka对1/T作图,见图4。该回归直线的方程为:
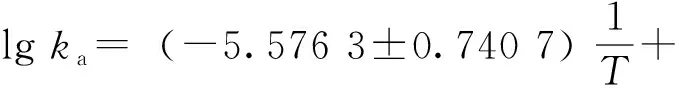
相关系数r=0.965 9。说明CD45-FITC抗体与蛋白 A的特异性结合遵循Arrhenius 方程[14]742-754。根据Arrhenius 方程,直线的斜率-Ea/2.303R=(-5.576 3±0.740 7),其中R表示气体常数,其值为8.314 5 J·K-1·mol-1,所以,Ea=(106.60±14.18)kJ·mol-1。

图4 CD45-FITC抗体与蛋白A特异性结合的速率常数和温度关系Fig.4 The relationship between temperature and association rate constants of the interaction of CD45-FITC antibody with protein A
2.4.2 CD45-FITC抗体与蛋白 A特异性结合ΔH的测定 分别再以上述温度的lgKa对1/T作图,如图5。回归直线的方程如下:

相关系数r=0.972 7。表明该反应较好地遵循Van′t Hoff 方程[14]417-420,根据Van′t Hoff 方程,直线的斜率-ΔH/2.303R=(-0.651 3±0.077 16),可计算出ΔH=(12.47±1.48)kJ·mol-1。
由ΔH的数值可知,该特异性结合是吸热反应,即升高温度,Ka值增大,也就是平衡转化率随温度的升高而增加。根据图4,温度升高,ka也增加。由上述实验结果可得出CD45-FITC抗体与蛋白 A在中性或微碱性、较高离子强度和较高温度的条件下比较容易发生特异性结合。

图5 CD45-FITC抗体与蛋白A特异性结合的平衡常数和温度关系Fig.5 The relationship between temperature and association equilibrium constants of the interaction of CD45-FITC antibody with protein A
3 结 论
本实验运用SPR平台实时监测CD45-FITC抗体与蛋白A特异性结合的过程,获得了该反应不同温度下的ka、kd和Ka,再经过作图法得到该反应的Ea和△H。由此推出该特异性结合的比较适宜的条件:中性或微碱性、较高的离子强度和较高的温度。期望能够为蛋白A分离和提纯免疫球蛋白IgG工作提供参考和必要的实验数据。该方法具有操作步骤简单、快速、灵敏度高、消耗样品少等优点,是研究分析蛋白A和免疫球蛋白IgG抗体等生物分子相互作用比较理想的方法之一。
