CAR-T疗法技术发展综述
2018-08-08王思佳
王思佳
(国家知识产权局专利局专利审查协作北京中心,北京 100039)
1 技术概述
CAR-T疗法,全称是Chimeric Antigen Receptor T-Cell Immunotherapy,嵌合抗原受体T细胞免疫疗法。其主要原理是,从癌症病人身上分离免疫T细胞,利用基因工程技术为T细胞引入一个能够识别肿瘤细胞并同时激活T细胞的嵌合抗体,也就是制备CAR-T细胞,再将扩增好的CAR-T细胞回输到病人体内,通过免疫疗法对抗癌细胞。最近使用这种方法治疗顽固性B细胞恶性肿瘤的患者已经表现出卓越的临床疗效[1]。截至目前,全球共有2种CAR-T产品获批上市,分别是来自诺华的Kymriah(tisagenlecleucel)和Kite制药的Yescarta(KTE-C19),它们分别用于治疗儿童和年轻成人(2~25岁)的急性淋巴细胞白血病和特定类型大B细胞淋巴瘤。2017-12-08,金斯瑞生物科技公司旗下的南京传奇生物科技有限公司率先在国内申报了CAR-T细胞临床试验。2018-03-08,日本山口大学免疫学系统的玉田耕治(Koji Tamada)教授宣布开发出可以表达IL7和CCL19两种趋化因子的全新一代CAR-T,这使得CAR-T可以模仿淋巴组织中的网状成纤维细胞,召集其他部位的免疫细胞进入肿瘤组织,共同对抗实体瘤[2]。这一突破为CAR-T疗法在实体瘤领域带来了新的希望。当CAR-T疗法奏效时,它会引进一种定制的“生物学刺客”让身体的免疫系统对抗癌症。这种方法的出现大大拓展了T细胞疗法的应用范围。
CAR-T疗法的概念最早是由德国洪堡大学Zelig Eshhar教授提出。Zelig Eshhar将抗体的轻重链连接到T细胞表面TCR的恒定区上,随后又将scFv替换轻重链,避免了多次重复的转基因。此为第一代CAR-T疗法,随后陆续应用到临床上。然而这些早期的临床研究没有获得理想的效果,响应率不佳,而且在靶向CAIΧ(碳酸酐酶IΧ)的CAR-T疗法中,出现了胆源性毒性的副作用,意味着CAR-T在作用于正常组织中靶标时存在可能引起毒性的风险。CAR-T疗法的第一个积极临床结果于2008年公布,位于休斯敦的Baylor医学院的Malcolm Brenner研究组——靶向GD2的CAR-T疗法,尽管24 h后血液中CAR-T细胞含量不足0.1%,仍使得11名儿科成神经细胞瘤患者中的3人完全缓解。随之而来的一个主要问题是如何保证CAR-T细胞的长期存活。二代CAR-T引入了共刺激信号4-1BB或CD28,前者通过上调Bcl-xL延长T细胞的存活期,后者可以增强T细胞响应的效价。
三代CAR-T引入2个以上的共刺激信号。第一个三代CAR-T的临床研究为靶向HER2的CAR-T疗法,适应症为转移性黑色素瘤。HER2靶点在单抗领域已经成功应用多年,抗肿瘤基因治疗药物赫赛汀成功治疗超过40万名女性乳腺癌患者,表现出很小的毒性。基于这些经验,NCI(美国国家癌症研究院)选择将靶向HER2的scFv应用到CAR-T疗法上,用于治疗HER2+黑色素瘤。首例患者接受了高浓度的CAR-T细胞——1×1011个细胞。患者接受治疗后,几分钟后就表现得极为痛苦,很快陷入昏迷,Χ光显示严重的肺浸润。医生给予高剂量激素干预,患者仍在5 d后死亡。随后发现患者全身遍布CAR-T细胞,肺部最为严重,进一步分析肺部上皮细胞表达HER2,发现其可能是导致肺部T细胞浸润引发死亡的主要原因。
2 专利申请情况
笔 者 以 [B/“CAR-T”and B/therapy] 这 一 检 索 式 在Patentics的全部数据库中进行检索。检索的截止时间为2017-05-26,共获得1 515篇专利申请文献。
图1是CAR-T疗法全球专利申请时间趋势图。CAR-T疗法全球专利申请主要集中在A61K35/17、C07K16/44和C12N这三个分类号,如图1所述,CAR-T疗法相关专利最早出现在1998年,此后申请量一直在个位数徘徊,直至2013年开始,申请量大幅上升,2015年共申请267件。申请人主要集中在宾夕法尼亚大学、诺华公司、Baylor医学院和美国卫生部,涉及到的发明点主要集中在一些特异性CAR分子、治疗方法及表达CAR的效应T细胞的制备方法等方面。
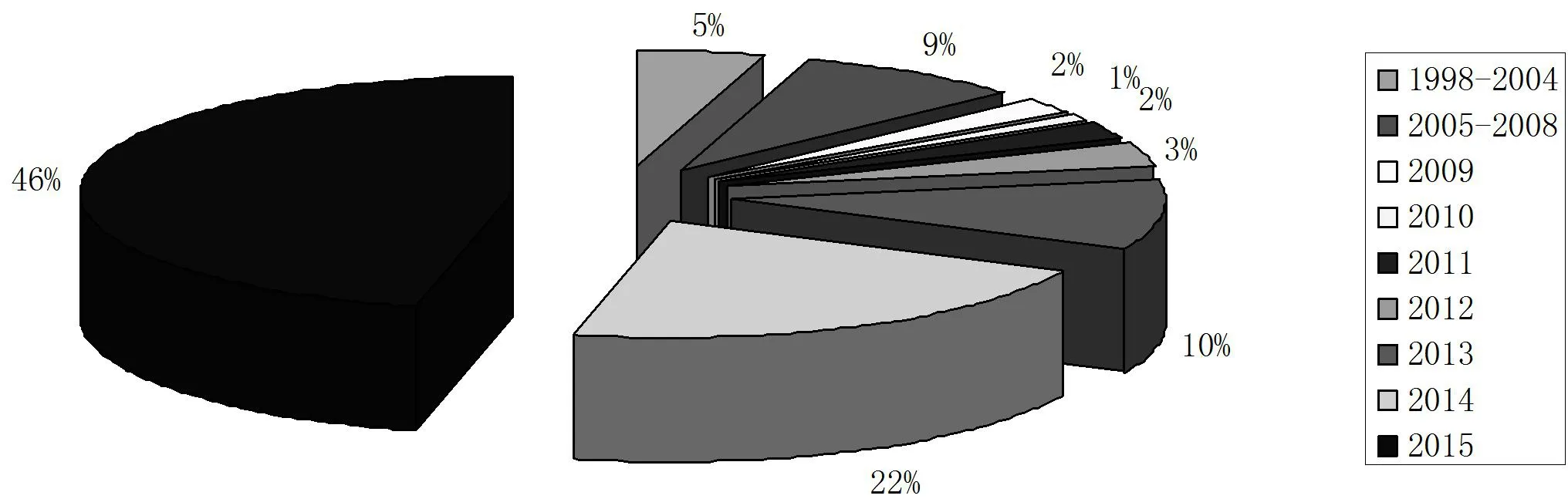
图1 CAR-T疗法全球专利申请时间趋势图
笔者以[B/“CAR-T”and B/治疗 or 疗法]这一检索式在Patentics的中国申请中进行检索。检索的截止时间为2017-05-26,获得306篇专利申请文献。
图2是CAR-T疗法中国专利申请时间趋势图。从图中可以看出,我国的CAR-T技术还处于起步阶段,直至2015年,申请量开始呈上升趋势,至2016年达到顶峰,至2016-09,申请量达到59件。

图2 CAR-T疗法中国专利申请时间趋势图

图3 CAR-T疗法中国专利的申请人分布图
图3是CAR-T疗法中国专利的申请人分布图。从图中可以看出,国内主要开展CAR-T技术研发的企业集中在以苏州普罗达生物科技有限公司(涉及低质申请,多数视撤)和上海优卡迪生物医药科技有限公司为首的长江三角以及江浙一带,涉及到的发明点主要集中在一些应用于CAR-T疗法的多肽和一些CAR转基因载体及其构建方法等方面。
3 技术发展方向
3.1 CAR-T免疫疗法毒性的减轻
CAR-T免疫疗法具有明显的毒性,大致可分为4类,即肿瘤溶解综合症、细胞因子释放综合症、神经毒性和靶标毒性。以下依次介绍这几种毒性的反应及减轻它们的方法。
3.1.1 肿瘤溶解综合症
肿瘤溶解综合症,是指代谢干扰的组合,其主要表现为升高的血清尿酸、钾和磷酸盐以及低血钙症,甚至有时会发展为肾衰竭,可能会使大量肿瘤细胞迅速消除。在血液恶性瘤的情况下,这些现象在递送CAR-T细胞的晚期患者中表现得尤其突出[3-4],推测是CAR-T细胞的体内扩张导致肿瘤被破坏。减少肿瘤溶解综合症这类免疫副反应通常会依赖于改造的CAR多肽,比如WO2017024318A1公开了一种包含1个CAR多肽的免疫效应细胞。该CAR多肽包括1个胞外配体结合域、1个跨膜域、1个包含至少1种胞内信号域的胞质域和1个能够与一种双杂合化合物结合的异化合物靶蛋白(dTAG)。该双杂合化合物能够通过dTAG结合上述CAR多肽和泛素连接酶。与通过自杀基因快速诱导CAR-T细胞死亡的模式相比,通过1个CAR-T细胞内靶向CAR泛素化和降解的双杂合化合物,实现了CAR表达的可逆性控制和接下来的T细胞反应,同时,还节省了CAR-T细胞自身。dTAG就像1个CAR表达的电阻器,当CAR-T细胞受到刺激时,就能够通过注射双杂合化合物来调节CAR的表达和CAR-T细胞免疫反应的程度,并通过清除该化合物再生CAR受体。更进一步地说,在CAR构建体中嵌入一个双杂合化合物靶蛋白,肿瘤溶解综合症的副反应就可以通过注射一种与靶蛋白匹配的双杂合化合物,在控制CAR表达的同时维持CAR-T细胞在化合物被清除且CAR受体重新表达时重新激活的功能。
3.1.2 细胞因子释放综合症
细胞因子释放综合症(CRS)是由CAR-T细胞免疫疗法诱导的最常见的危及生命的毒性反应。它是指释放来自几个白细胞群的一系列细胞因子,最显著的是T细胞和单核吞噬细胞的细胞系,从中可能会检测出高循环水平的多种促炎细胞因子,包括肿瘤坏死因子-α(TNF-α)、干扰素-g和IL-6。在一些病例中,巨噬细胞激活综合症会伴随着CRS,这是应当引起注意的。因为CAR-T细胞的临床前模型诱导的CRS表明,巨噬细胞激活综合症是疾病发病机理的一个关键组成部分。新的证据表明,细胞因子释放综合症的严重程度依赖于疾病负担。由于CRS的快速发展,有必要密切监视患者的状况,尤其是在CAR转化细胞后的24~48 h之间。然而,延迟的CRS也会发生,特别是当细胞由小的起始数目进行大规模体内扩张时。因此,CRS的管理成为具有挑战性的难题,因为在一定程度上讲,细胞因子的释放会伴随T细胞激活和效应器活动,同时,治疗封锁该过程可能需要使用一种或多种免疫抑制剂。WO2017025638A1公开了这样一种免疫抑制剂,主要针对于激活了的T细胞的细胞核因子。另一方面,严重的CRS可能很快就会致命,在一例涉及到HER2的 CAR-T细胞治疗的患者中不幸发生了此悲剧[5]。最近,除了这种症状的治疗方法外,还提出了诊断和分级系统。血清C反应蛋白(CRP)已被确定为潜在的CRS生物标定物,补充临床参数便于对需要更多治疗的患者进行分级。根据患者的严重程度,治疗可能涉及到症状治疗、液体置换、输氧和血管加压药以及施加免疫抑制剂,比如IL-6受体α-阻断抗体、托珠单抗和/或皮质类固醇。
3.1.3 神经毒性
神经毒性是CAR-T细胞疗法引起的另一种严重的潜在毒性,并已在用CD19靶向治疗的几例患者中观察到。神经毒性的症状包括视觉幻觉、谵妄、功能障碍和癫痫发作,这种毒性的起因尚不清楚。尽管在大多数用CD19 CAR-T疗法治疗的患者的脑脊髓液(CSF)中已经发现了CD19 CAR-T细胞(忽略脑病的严重程度),所有6/21有神经毒性反应的患者都有更高浓度的脑脊髓液CAR-T细胞,但并非所有表现出神经毒性的患者在其CSF中都有CAR-T细胞,尽管在CSF收集时出现了临床性精神障碍。由于在用blinatumomab(一种T细胞活化的双特异性抗体与肿瘤细胞上的CD19和T细胞上的CD3接合)治疗的患者中也观察到了神经毒性[6],因此,推测毒性是来自于广义T细胞介导的炎症而不是靶性CAR-T细胞对CNS组织(中枢神经系统)的攻击。迄今为止的两大临床试验同时证明,神经毒性是完全可逆和自限的,它仍是CAR-T细胞疗法的一个明显难题,尤其是其与CRS的严重程度无关,因此就更加难以预测。理解神经毒性背后的机制对于开发更安全的CAR-T细胞疗法以及更加有效地管理这些副反应至关重要。
3.1.4 靶标毒性
靶标毒性即脱靶是指CAR-T细胞免疫反应介导的表达靶抗原的正常组织排斥反应。该毒性反应从CD19倾向性的靶向CAR-T细胞引起的B细胞发育不全得到了最好的诠释,结果是低丙种球蛋白血症。在其他不可治愈的B细胞肿瘤存在的情况下,这种毒性被认为是可以接受的,因为它能够通过实施静脉内或皮下免疫球蛋白置换治疗来得到缓解。另一个例子是由CAIΧ(碳酸酐酶IΧ)重新靶向CAR-T细胞诱导的肝毒性[7]。靶标毒性是CAR-T细胞免疫疗法的一个特殊难题,因为大多数靶点是在正常组织中表达的自身抗原。
3.2 CRISPR让CAR-T继续“开车”
基因组编辑工具CRISPR-Cas系统的飞速发展引发了生物学领域的一场革命。基于CRISPR-Cas的技术实现了几乎无限制的基因操作,包括在人类细胞中操作。目前,大部分的CAR-T细胞是利用患者自身的T细胞来产生的,这是一个昂贵、耗时的过程。这一过程还受限于当前的生产制造能力。如果科学家们能够想办法生成通用型的CAR-T细胞,这类疗法将有望变得更便捷、更便宜。因为这些现成的(off-the-shelf)细胞将增加能够接受单一CAR-T细胞产品治疗的患者数量。移植物抗宿主病(graft-versus-host disease,GVHD)和宿主排斥依然是这种“off-the-shelf”途径的主要障碍,包括ZFNs和TALENs在内的基因编辑技术已经在一些研究中被用于克服这些障碍。WO2017040786A1公开了借助CRISPR基因编辑工具,以便利用更少的基因材料重组合成基因回路,并干扰一些细胞的疗法,比如CAR-T疗法。除了用于产生“off-the-shelf”版本的CAR-T细胞,基因组编辑技术还可以通过敲除编码T细胞抑制性受体或信号分子的基因(比如CTLA4、PD1)提高CAR-T细胞的功效。一个典型的例子是,美国NIH(美国国立卫生研究院)下属Recombinant DNAAdvisory Committee批准的,将由CAR-T领军人物 Carl June教授领导的一项CRISPR临床试验。在该试验中,研究人员将利用Cas9在黑色素瘤靶向的CAR-T细胞中敲除编码PD1基因以及内源性T细胞受体的基因。Carl June教授于2016-11在Clinical Cancer Research杂志上发表的一篇论文“Multiplex genome editing to generate universal CAR T cells resistant to PD1 inhibition”中证实,在体外和动物模型研究中,CRISPR基因编辑CAR-T细胞表现出了强有力的抗肿瘤活性,其TCR和I类HLA双重缺陷的T细胞同种异体反应性(alloreactivity)降低,且没有导致GVHD。此外,同时三重基因组编辑(增加了对PD1基因的编辑)增强了CAR-T细胞的体内抗肿瘤活性。该综述也提到了由我国四川大学华西医院肿瘤学家卢铀教授研究小组率先开展的全球首个CRISPR–Cas临床试验。虽然这一试验没有引入CAR,但利用Cas9敲除了来自肺癌患者T细胞的PD1。一些类似的用PD1敲除T细胞(PD1-knockout T cells)治疗前列腺癌、膀胱癌和肾细胞癌的试验也在启动中。与ZFNs和TALENs等其他基因编辑技术相比,CRISPR–Cas能够极快地测试任何新提出的基因改造。目前,CAR-T疗法开发者与专门从事基因编辑的公司之间已经建立了大量的合作,其中包括Novartis与Intellia Therapeutics和Caribou Biosciences、Juno Therapeutics与 Editas Medicine。
此外,南京凯迪生物科技有限公司近期申请的CN106399375A公开了利用CRISPR/Cas9技术通过使用携带人PD1基因sgRNA和Cas9-HF核酸酶的病毒液同步感染CAR-T细胞来敲除人PD1基因,得到可靶向CD19的新型CAR-T细胞;其另一篇公开号为CN104894068A的专利申请利用CRISPR/Cas9技术将CAR分子整合到人第19号染色体上AAVS1位点的第一个内含子内。利用该技术,可以将CAR分子精确地整合到人T细胞基因组特定的“安全港”位点,不影响任何人体正常基因的功能,避免了使用病毒载体存在的安全隐患以及外源基因转入基因组的遗传毒性和免疫原性等一系列临床风险问题。
3.3 CAR-T技术治疗癌症新思路——作为药物输送系统
作为一种“活的药物”,CAR-T疗法的应用依然面临着很多挑战,包括缺乏足够的持久性、抗原逃逸会导致复发、安全性低以及生产制备方面的问题等。不过,科学家们一直在尝试改进这类疗法。一篇题为“Loss of the HVEM Tumor Suppressor in Lymphoma and Restoration by Modified CAR-T Cells”的研究于2016-09-29发表在《细胞》杂志上。该研究提出,CAR-T细胞具有作为靶向递送工具的潜能。科学家们将这种新型CAR-T比作“微型药房”(micro-pharmacies),可用于精准的药物输送。这项研究不仅定义了导致淋巴瘤发展的关键病变,还鉴定出了一种潜在的新治疗模式。
该研究小组首次发现,一个关键的通路在约75%的人类滤泡性淋巴瘤中被阻断了。其中,在约50%的病例中,HVEM受体基因发生了突变。这些突变干扰了与抑制性受体BTLA间的相互作用,从而导致淋巴瘤生长,形成了支持性的微环境。随后,研究人员注意到,这一通路中的关键分子能够用于淋巴瘤的治疗。他们研究了一种恢复HVEM功能的方法,即利用工程CD19导向CAR-T细胞(engineered CD19-directed CAR-T cell)将HVEM蛋白直接运输到淋巴瘤中。这类细胞经过特殊的设计,能够连续不断地产生可溶性的HVEM蛋白。这些CAR-T细胞通过寻找表达CD19的B细胞,将抗癌蛋白直接传递至肿瘤部位,并且留在肿瘤处,提供肿瘤抑制蛋白。这些“微型药房”在动物模型试验中产生了显著的治疗反应,并且比对照组(CAR-T细胞和CD19 CAR-T细胞)更有效。这一研究描述了一种修复肿瘤抑制性HVEM-BTLA互作的新方法,证实了CAR-T细胞除了用于直接攻击肿瘤外,还可以通过其他途径发挥抗癌作用。这种作为“微型药房”的新用法有望提高精准治疗的活性,降低对正常组织的影响和不必要的副作用。科学家们表示,还需要开展更多的研究来探索工程免疫细胞作为一个平台输送抗肿瘤药物的这种新治疗模式。
4 总结
目前,CAR-T疗法是治疗血液恶性肿瘤的一个不错选择,其安全性,特别是确认安全的抗原靶点仍然是我们关注的重点。然而,随着临床经验的增多,这一领域已经取得了重大发展,现在由于CRS的分级系统,其毒性管控变得越来越先进。另外,有可能将CAR-T细胞疗法与常规化学治疗或其他新型免疫治疗,比如免疫检查点抑制剂相结合。相关技术的发展,为发展“off-the-shelf”的CAR-T细胞的CRISPR技术,以及CAR-T细胞作为药物输送系统的应用,提供了新机遇;再加上CAR-T疗法商业关注度的增加,也会加快CAR-T细胞疗法作为一线治疗投入临床使用的速度。
