乳腺X线检查与MRI在致密型乳腺中乳腺癌的诊断价值
2018-08-07王永杰黄汉琴
邹 明 王永杰 邱 健 黄汉琴 金 彪
乳腺癌是女性最常见的恶性肿瘤之一,其发病率正在逐年上升,年轻化趋势越来越明显[1]。美国肿瘤协会统计发现,乳腺癌在女性新发现肿瘤中居首位,占30%,死亡率也仅次于肺癌,居第二[2]。乳腺X线摄影(mammography,MG)作为目前最有效的筛查乳腺癌手段之一,可有效检测出大部分乳腺肿瘤,但在致密型乳腺中的检出率仅为30%[3-4]。美国放射学院(american college of radiology,ACR)2003年第4版乳腺X线影像报告系统(breast imaging and reporting data system,BI-RADS)根据乳腺纤维腺体成分多少将正常乳腺的X线表现分为4种类型:Ⅰ型,纤维腺体组织<25%;Ⅱ型,纤维腺体组织为25%~50%;Ⅲ型,纤维腺体组织为51%~75%;Ⅳ型,纤维腺体组织>75%[5]。本文将Ⅲ型、Ⅳ型归类为致密型。本文通过分析MG与MRI多序列检查诊断致密型乳腺中乳腺恶性肿瘤的确诊率及钙化显示率。
方 法
1.临床资料
收集我院2017年1月至2017年9月间30例MG归类为致密型乳腺且经手术、穿刺活检病理证实为乳腺癌的患者,所有乳腺癌患者术前均做MRI常规序列、动态增强及扩散加权成像检查。所有患者均为女性,年龄32~56岁,平均年龄47.6岁,年龄分布无统计学意义。
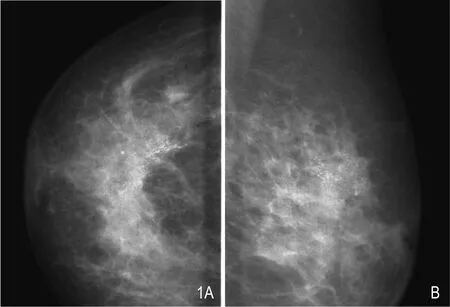
图1 左乳浸润性导管癌。A.CC位;B.MLO位,左乳外上象限区域分布细小钙化灶聚集。
2.检查方法
乳腺X线检查方法:使用GE SENOGRAPHE DS全数字化乳腺机,采集常规双侧头尾位(CC)及内外侧斜位(MLO)图像,如遇特殊要求可行侧位及局部加压放大摄影。
MRI扫描方法:采用1.5T GE双梯度MRI和乳腺相控阵表面线圈。被检者取俯卧位,头、肩及腹部垫高,使双乳自然下垂。常规序列扫描:单侧乳房矢状位T1WI、T2WI-FS,激励次数2次,FOV 11cm,层厚3mm,间隔1mm。双侧乳房横断位T1WI、T2WI,层厚3mm,间隔1mm,FOV 32cm。动态增强经静脉团注马根维显0.2mmol/kg后连续无间隔采集9个时相,激励次数2次,层厚3mm,FOV 11cm,均采用3DFSPGR+脂肪抑制。DWI扫描采用SE-EPI成像加脂肪抑制,序列B=1000s/mm2横断位扫描,层厚3mm,间隔1mm,FOV 32cm。
3.图像分析
MG及MRI图像分别由两位高年资主治以上医生进行双盲法读片,得出相应乳腺疾病的影像学诊断;如遇意见不统一,则由两位医生共同讨论确定。动态信号强度比较:选用MRI自带工作站(ADW4.2)Functool2软件,选定远离坏死组织及钙化的病灶实质中心层面,绘制相同面积感兴趣(ROI),并绘制时间-信号强度曲线图。扩散加权成像ADC值的比较:选用MRI自带工作站(ADW4.2)Functool2软件,选定远离坏死组织及钙化的病灶实质中心层面,绘制相同面积感兴趣(ROI),同时计算出B=1000s/mm2时的ADC值。
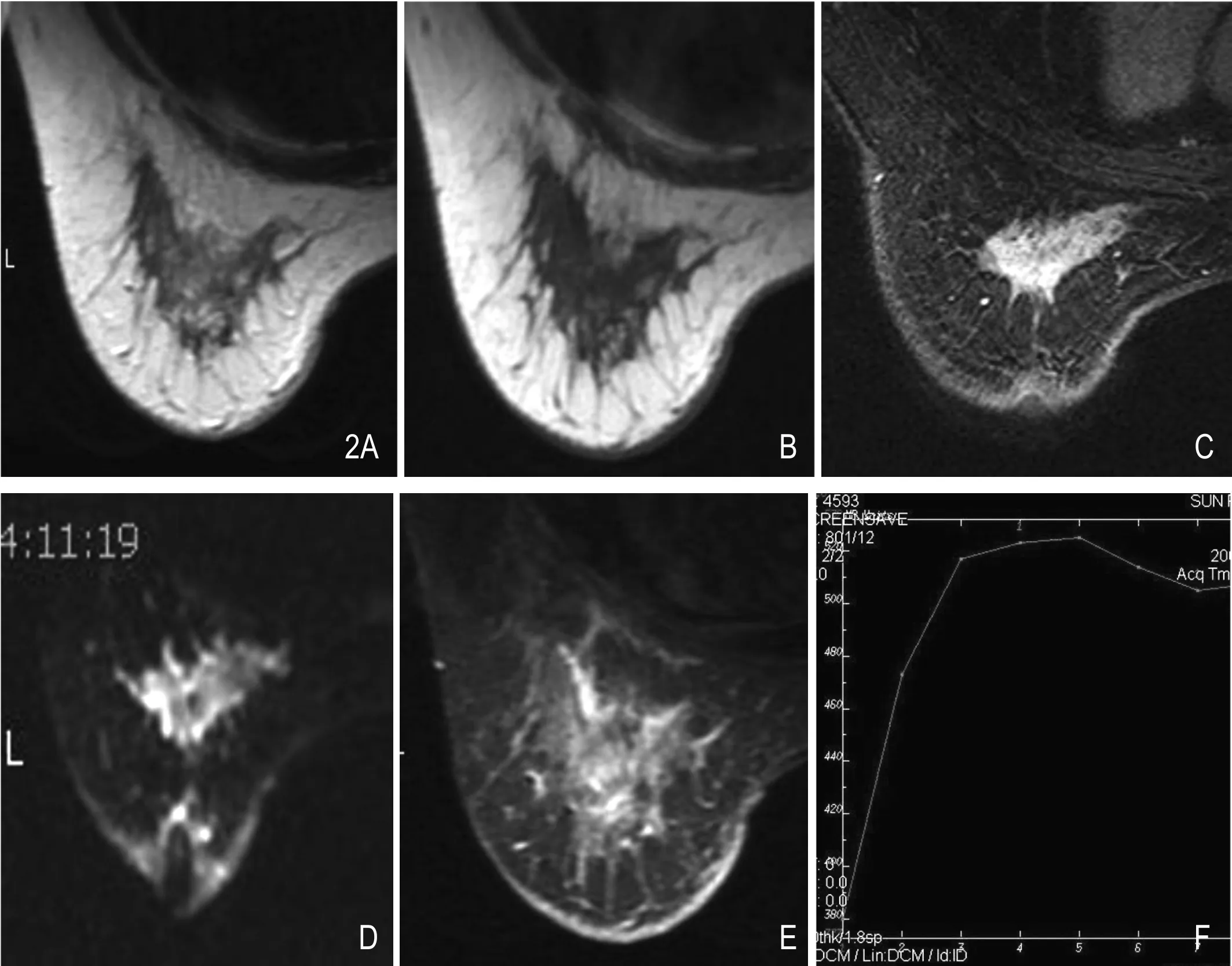
图2 左乳浸润性导管癌。A.T1WI等、稍高信号;B.T2WI略低信号;C.T2WI-FS不规则高信号;D.DWI高信号;E.大片不规则异常强化;F.A型曲线(廓清型)。

表1 30例致密型乳腺中MG与MRI确诊率与钙化显示率
采用SPSS16.0软件作统计分析。计数资料建立四格表计算χ2检验,说明有无统计学意义。
结 果
30例致密型乳腺中乳腺癌MG诊断正确病例数、显示钙化病例数(图1 A、B)、MRI确诊病例数、显示钙化率见表1 (图2 A~F)。表1数据表明,在致密型乳腺中MRI乳腺癌确诊率远远高于MG,差异有统计学意义(P<0.01);钙化的敏感性则明显低于MG,差异有统计学意义(P<0.05)。
讨 论
致密型乳腺是指乳房内腺体组织、腺泡及导管较多,约占乳房内组织的50%以上,肿瘤细胞因此也就拥有了更多生长空间和隐藏空间,这些也对乳腺病灶的诊断产生重要影响。所以很多学者都认为致密型乳腺已经成为乳腺癌的高危因素之一[8],与脂肪型乳腺相比,致密型乳腺患恶性肿瘤的风险增加了2.2 ~ 5 倍[9-10]。van Gils 等[11]认为在西方女性中致密型乳腺占女性的占22%,非致密型占78%; 而Ting-Kai 等[12]在对中国台湾地区女性的研究中发现,亚洲女性以致密型为主,致密型乳腺占78.2%,非致密型乳腺占21.8%。在我国,致密型腺体人数也常占女性受检者人数的1/3,其中尤以年轻女性更为常见。所以目前大家一致公认致密型腺体是乳腺癌发生的危险因素之一[3,6],而早发现、早诊断、早治疗是降低乳腺癌死亡率的关键所在。目前乳腺癌的筛查还是依靠临床体检、MG与超声(ultrasonography,US)。临床体检是指医生的视诊和触诊, 主要以触诊为主,医生通过手指来判断肿块大小、硬度、活动度及肿块性质;其准确程度除了与个人经验手感有关外, 还和肿块深度、大小有着密切联系。MG作为目前最为常用的乳腺癌筛查方法,可有效地检出乳腺癌病灶,但在致密型乳腺中其检出率明显低于非致密型乳腺,仅为30%~40%[3-4]。本研究发现MG对致密型乳腺中乳腺癌的检出率也仅为46.67%,远远低于非致密型乳腺的83.54%。US自从采用高分辨率的高频探头以来, 能很好地显示乳腺中病灶的回声、形状、边界、纵横比及血流情况,并以此来判断病灶的性质。US特别在致密型乳腺中乳腺疾病诊断准确率方面明显高于X线和体检。但是US的全面性相对于MG稍差, 尤其受个人经验的影响对于微小肿块容易造成漏诊,包括近腺体边缘、乳头下方等易遗漏之处[7]。
目前,有许多仅表现为腺体内有成簇细小钙化灶聚集,局部腺体不均质增厚,两侧腺体结构不对称等无肿块型乳腺癌。MG不仅价格低廉,操作简单,特别是在恶性钙化检出率方面明显优于MRI,而浸润性导管癌又以无肿块型细小钙化聚集为主较常见。MG也同样存在不足,如密度分辨率低,较小病灶容易被腺体组织掩盖;近胸壁处病灶易漏诊;不能了解病灶血流情况。而MRI具有良好软组织分辨率,特别是微小病灶、不典型病变、近胸壁处病变检出率方面远远高于MG及US,并能明确病灶的多灶性和多中心性,客观评价肿瘤的范围,对临床术前评估、疗效分析取到明显的作用。这些都是MG和B超检查无法替代的。
MRI检查对于致密型乳腺中乳腺癌的诊断主要包括形态学及功能学两方面,形态学包括常规MRI序列(横断位 T1WI、T2WI、T2WI-FS;矢状位T2WI-FS),主要反映病灶的形态、大小、信号及与周围组织的关系。功能学包括弥散加权成像(b=1000s/mm2)及动态增强检查。弥散加权成像(diffusion weighted imaging,DWI)是基于水分子布朗运动,根据不同病灶在不同b值情况下,其扩散能力差异转化成图像的灰度信号或其他参数值,从而能够反映组织的结构特点。人体中不同组织测得的DWI值常用表观扩散系数(ADC)来表示,ADC值主要反映病灶内分子的微观运动。本文主要采用b=1000s/mm2时,乳腺内不同肿瘤的ADC值的95%可信区间来判断肿瘤的良恶性改变,恶性病灶常为高信号,良性病灶常为高或稍高信号。本文研究中,30例患者所有病灶均为高信号,28例ADC值在恶性肿瘤95%可信区间内,两例在良性肿瘤95%可信区间内。恶性病变中ADC值的降低往往与肿瘤细胞密度呈负相关性,肿瘤细胞密度越高,ADC 值越低;反之,肿瘤细胞密度越低,ADC 值越大[13,16]。MRI动态增强技术,是经静脉快速团注马根维显后对远离坏死组织及钙化的病灶实质中心层面绘制相同感兴趣区(ROI) 进行无间断扫描7次,通过观察病灶强化方式,计算出早期强化率并绘制时间-信号强度曲线来评估肿瘤的良恶性。增强后恶性肿瘤倾向于快速强化,而良性病变前后较缓慢,根据不同病灶的强化方式绘制出相应的时间-信号强度曲线,这样就直观化地反映出不同病灶的不同强化方式。根据乳腺内不同病灶一般分4型:A型:廓清型,强化峰值在120秒内,其后快速下降;B型:平台型,相对快速上升,强化峰值在120~240秒内,其后呈平台状;C型:单相型,缓慢上升,无高峰;D型:无明显强化。A型曲线以恶性肿瘤为主;B型曲线部分为良性病灶,部分为恶性病灶,具有较强的重叠性,所以必须依靠形态学及ADC值来鉴别诊断[14-15];C型曲线大多为良性病灶,极少数为恶性病灶,本文误诊的1例属于此类型,为导管内乳头状癌;正常组织则为D 型,无明显强化。本文30例乳腺癌中,A型曲线19例,占63.33%, B型曲线11例,占36.67%。所以MRI是系统的检查技术,只有通过不同病灶的不同形态学特征、ADC值及时间-信号强度曲线来判断病灶的良恶性。单纯运用常规序列、DWI、增强扫描对于乳腺癌的诊断与鉴别诊断也存在比较大的困难,特别是B型曲线或良性肿瘤95%可信区间内出现的恶性肿瘤。而联合运用常规序列、DWI及动态增强扫描正好弥补了上述存在的问题,从而大大提供乳腺癌的诊断与鉴别诊断,对于乳腺癌术前、术后分期评估及放化疗疗效评估具有重要的临床价值。
MG不仅操作简单,价格低廉,尤其对恶性钙化较高的敏感性还使其成为乳腺癌筛查的首选检查项目,但是其还是存在对致密型乳腺中对较小病灶检出率较低、对近胸壁处肿块易漏诊等不足。MRI良好的软组织分辨率,较高的肿块检出率,并能准确提供乳腺癌术前、术后分期及放化疗疗效评估等影像学依据。所以说,MRI对致密型乳腺中乳腺疾病的诊断是MG的重要补充手段,尤其对致密型乳腺中乳腺癌的诊断与鉴别诊断具有极高的临床应用价值。
