人循环T细胞免疫指数模型评估结直肠癌患者手术预后的价值
2018-08-07秦靓傅超俞艳艳丁菁武文静姚江颖何俊张建锋张亮亮
秦靓 傅超 俞艳艳 丁菁 武文静 姚江颖 何俊 张建锋 张亮亮
结直肠癌是消化道常见的高度恶性肿瘤,近年来发病率呈上升趋势[1]。尽管恶性肿瘤手术、放化疗等治疗取得了较大进展,但针对结直肠癌手术预后(生存及远处转移)的结果欠佳[1]。因此,寻找适宜的结直肠癌患者手术预后指标或标志物,以尽早发现预后不良的高危患者是目前研究热点及难点[2]。研究表明,浸润性细胞免疫反应的改变与机体肿瘤的发生、发展及预后的关系密切[3]。相关文献报道许多外周循环血细胞指标(如淋巴细胞、中性粒细胞、单核细胞等)可预测恶性肿瘤患者的预后,但对结直肠癌的预测报道很少[4]。本研究以CD4+调节性T细胞、CD8+调节性T细胞、CD28+细胞毒性T细胞为研究基础,建立循环淋巴细胞免疫指数(circulating T-cell immune index,CTII)模型,探讨其与结直肠癌患者临床特征的关系以及评估手术预后的价值。
1 对象和方法
1.1 对象 选择2010年1月至2013年1月行手术切除且经病理证实为结直肠癌的138例患者(杭州市第三人民医院124例,成都中医药大学附属医院14例)为研究对象,其中男 83例,女 55例;年龄 30~72(44.37±12.7)岁。入选标准:(1)所有患者接受相应的标准化结直肠癌治疗策略;(2)采集血标本前均未接受过其他任何抗肿瘤、输血、放化疗等治疗。排除标准:(1)合并感染性疾病导致淋巴细胞异常者;(2)患有血液系统、骨髓系统、淋巴系统的疾病;(3)合并其他肿瘤患者。本研究经医院伦理委员会审核通过,患者或其家属均签署知情同意书。
1.2 方法
1.2.1 CTII模型的建立 收集所有患者术前的循环CD4+调节性 T细胞、CD8+调节性 T细胞、CD28+细胞毒性T细胞的检查资料,并计算CTII,CTII=CD28+细胞毒性T细胞/(CD4+调节性T细胞×CD8+调节性T细胞)。患者的年龄、性别、肿瘤TNM分期、肿瘤直径、肿瘤位置、分化程度、淋巴细胞计数、中性粒细胞计数等资料均依据病程记录和检查报告进行归纳。
1.2.2 随访计划的制定 通过患者复诊、电话、信件等方式进行随访,术后2年内每3个月随访1次,2年后每6个月随访1次。术后随访5年,截止至2018年1月,失访10例(包括非肿瘤相关死亡患者)。研究的主要终点事件为无病生存期(RFS)和总生存期(OS)。RFS:手术之日至第1次出现局部或区域复发转移、随访终止或死亡的时间。OS:手术之日至出现任何原因引起的死亡或随访终止的时间。
1.3 统计学处理 应用SPSS 17.0统计软件。根据ROC曲线计算CTII预测结直肠癌患者5年生存期的最佳截点值;采用χ2检验或Fisher精确概率法分析CTII与结直肠癌患者临床特征的关系。采用Kaplan-Meier曲线、log-rank检验进行生存分析,并运用Cox比例风险回归模型分析影响结直肠癌患者RFS和OS的因素。P<0.05为差异有统计学意义。
2 结果
2.1 CTII临界值的确定及分组 CTII模型预测本研究结直肠癌患者5年RFS和OS的AUC分别为0.702和0.679,见图1。根据AUC面积的比较以及相应约登指数的计算,确定以RFS为研究基础,获得CTII最佳截点值为0.08。根据最佳截点值将结直肠癌患者分为高CTII组(≥0.08)76例和低CTII组(<0.08)62例。

图1 CTII模型预测结直肠癌患者5年RFS和OS的ROC曲线(a:RFS分析;b:OS分析)
2.2 CTII与结直肠癌患者临床特征的关系 不同CTII组患者的TNM分期、分化程度以及循环CD4+调节性T细胞、CD8+调节性T细胞、CD28+细胞毒性T细胞比较,差异均有统计学意义(均P<0.05);而年龄、性别、肿瘤直径、肿瘤位置、中性粒细胞计数、淋巴细胞计数比较,差异均无统计学意义(均P>0.05),见表1。
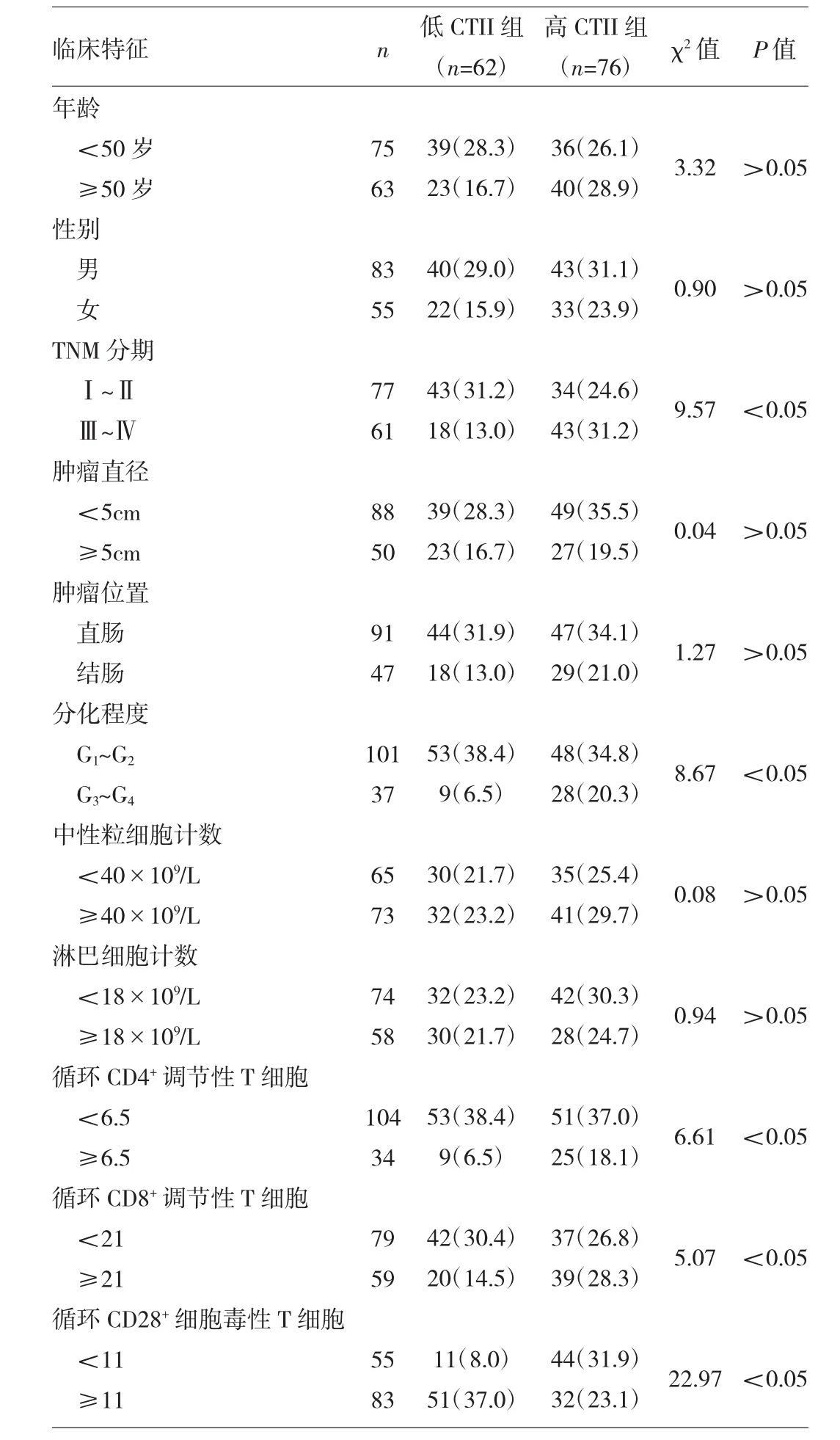
表1 CTII与结直肠癌患者临床特征的关系
2.3 CTII与结直肠癌患者的预后生存分析 高CTII组患者RFS、OS均明显低于低CTII组(均P<0.01),见图2。
2.4 影响结直肠癌患者RFS和OS的Cox比例风险回归模型分析 单因素分析结果显示,TNM分期、分化程度、CTII指数与结直肠癌患者术后RFS和OS密切相关(均P<0.05);而肿瘤直径、循环CD28+细胞毒性T细胞仅与RFS有关(均P<0.05),CD8+调节性T细胞仅与OS有关(P<0.05)。将上述P<0.05的因素纳入多因素分析,结果显示TNM分期、分化程度、CTII是影响结直肠癌患者术后RFS和OS的独立危险因素(均P<0.05),见表2。

图2 CTII与结直肠癌患者预后的生存曲线(a:RFS分析;b:OS分析)
3 讨论
近年来研究证实,炎症免疫细胞浸润会改变肿瘤微环境,参与或抑制恶性肿瘤细胞的增殖和迁移[5]。相关研究表明,免疫细胞指数模型可作用于肿瘤免疫机制,从而发挥作用[6]。因此,免疫细胞指数模型可能成为恶性肿瘤的新生物标志以及判断预后的细胞靶点。CTII模型是以CD4+调节性T细胞、CD8+调节性T细胞、CD28+细胞毒性T细胞为研究基础,通过拮抗-促进的相互作用来调控肿瘤发生、发展,从而实现复杂的免疫防御功能,在临床上具有准确的预测价值和广阔的应用前景。
结直肠癌是消化系统常见的恶性肿瘤,其致死率较高[1]。因此,亟需寻找一种新的肿瘤标志物来判断预后,以提高结直肠癌的个体化治疗效果。Hagland等[7]报道在循环淋巴细胞于Ⅰ~Ⅲ期结直肠癌患者分布中,CD4+及CD8+T细胞参与恶性肿瘤侵袭,进而影响预后。进一步研究表明,CTII与多种恶性肿瘤远期预后密切相关,如肺癌、肝癌、胰腺癌[8-10]。目前关于CTII对结直肠癌的预测价值尚不清楚。因此,本研究从结直肠癌患者外周血细胞入手,利用ROC曲线评价结直肠癌患者预后,发现CTII模型在RFS所对应的AUC大于OS所对应的AUC,但差异无统计学意义;在一定程度上提示RFS的最佳截点在评价结直肠癌患者预后的准确性方面具有优势。进一步分析CTII与临床特征及预后生存的关系,结果表明CTII与TNM分期、分化程度有关,推测CTII变化可能打破肿瘤微环境免疫平衡,从而参与肿瘤的发生、发展。亦有研究表明TNM分期、分化程度是影响结直肠癌治疗及预后的指标[11]。此外,本研究发现CTII与结直肠癌患者术后的RFS和OS密切相关,高CTII提示预后较差。同时进一步作Cox比例风险回归模型分析,证实TNM分期、分化程度、CTII是影响结直肠癌患者预后不良的独立危险因素。可见,CTII可作为评价结直肠癌术后复发风险和OS的预测指标。

表2 影响结直肠癌患者RFS和OS的Cox比例风险回归模型分析
目前关于上述规律的发生机制尚未证实,主要认为恶性肿瘤的发生起点在于感染或炎症反应,此类感染或炎症可引起CTII升高。本实验结果为CD28+细胞毒性T细胞增多,或CD4+调节性T细胞、CD8+调节性T细胞减少。CD28+细胞毒性T细胞是调节细胞凋亡的重要炎性细胞,与肿瘤-免疫平衡的发生、发展存在相互效应。一方面,肿瘤细胞可释放粒细胞集落刺激因子、IL-2、TNF等细胞因子,从而促进CD28+细胞毒性T细胞大量增殖[12];另一方面,CD28+细胞毒性 T细胞通过 PD-1、GSK-3等途径与肿瘤细胞对抗[13]。这意味着CD28+细胞毒性T细胞可间接反映肿瘤恶性程度。此外,有研究表明,CD4+/CD8+淋巴细胞介导的细胞毒性反应以及释放的细胞因子,均能抑制肿瘤的增殖与转移行为[14]。随着肿瘤的生长,机体炎症与抗肿瘤之间失去平衡,体内循环淋巴细胞比例发生变化。因此,外周血CTII高则反映患者全身炎性反应较严重,抗肿瘤免疫功能较差,提示预后不良。
综上所述,CTII模型对结直肠癌患者预后的评估具有指导价值,是一项易检测、重复性好、价格低廉的肿瘤相关性炎症指标;其中高CTII提示预后不良。联合中性粒细胞/淋巴细胞、血小板/淋巴细胞等因素建立模型,对结直肠癌远处转移的诊断具有参考价值[15-16];建议进一步联合多指标进行研究,以提高预测的准确性。
