FTY720对蛛网膜下腔出血大鼠海马神经元凋亡的抑制作用
2018-08-07张杰董晓巧俞文华杜权王昊杨定博沈永锋江力朱强车志豪
张杰 董晓巧 俞文华 杜权 王昊 杨定博 沈永锋 江力 朱强 车志豪
免疫反应是造成蛛网膜下腔出血性脑损伤的重要原因之一[1-2]。FTY720是一种来源于冬虫夏草且具有双向调节作用的新型免疫抑制剂,在体内抑制免疫反应发生的同时不破坏机体对病毒的免疫应答及免疫记忆能力,不良反应小,生物利用度高[3]。FTY720可用于器官移植、自体免疫疾病、肿瘤、炎症等疾病的治疗;目前,在肾移植排斥反应中的应用进入Ⅲ期临床试验,在多发性硬化症中的应用进入Ⅱ期临床试验[4-7]。本研究采用FTY720腹腔注射治疗大鼠蛛网膜下腔出血,观察其对大鼠海马神经元凋亡的抑制作用,从而揭示其脑保护作用。
1 材料和方法
1.1 材料 健康Wistar大鼠(雄性,清洁级,南京大学模式动物研究所提供);FTY720(批号:SML0700,规格:25mg,美国Sigma公司);二喹啉甲酸(BCA)蛋白定量试剂盒(批号:23229,美国Thermo Scientific公司);原位末端标记(TUNEL)试剂盒(批号:MK1024,中国武汉博士德生物工程有限公司);Caspase-3和Caspase-9底物(批号:T9281、T9275,美国 Livemore公司);转印槽(型号:Trans-Blot,美国 Bio-Rad公司);电泳仪(型号:EPS-200,上海天能科技有限公司);小型垂直电泳槽(型号:164-8001,美国 Bio-Rad公司);脱色摇床(型号:TY-80B,常州澳华仪器有限公司);生物倒置显微镜(型号:IX-71,中国奥林巴斯有限公司);低温高速离心机(型号:BECKMAN,北京普瑞麦迪实验室技术有限公司);荧光分光光度计(型号:UV-1202,日本岛津公司)。
1.2 方法
1.2.1 动物分组 将48只大鼠随机分成正常组、假手术组、模型组和治疗组,每组12只。4组大鼠均予50mg/kg戊巴比妥钠腹腔麻醉,采用枕大池二次注血法制作蛛网膜下腔出血大鼠模型,假手术组大鼠两次注入等量0.9%氯化钠注射液。治疗组大鼠模型形成前0.5h按1mg/kg腹腔注射FTY720,另外3组大鼠腹腔注射0.9%氯化钠注射液1ml。24h后,大鼠以80mg/kg戊巴比妥钠腹腔注射深度麻醉,断头处死,分离海马组织。正常组大鼠24h内均未死亡,假手术组大鼠24h内死亡1只,模型组大鼠24h内死亡3只,治疗组大鼠24h内死亡2只;4组大鼠死亡率比较,差异无统计学意义(P>0.05)。大鼠死亡后补充成活大鼠,保证每组12只。
1.2.2 细胞凋亡检测 取部分海马组织,固定、脱水,常规石蜡包埋,切取厚约4μm的超薄切片,行TUNEL检测:(1)组织切片 60℃烤 2h;(2)二甲苯洗 5min×2 次;(3)分别使用无水乙醇、95%乙醇、90%乙醇、80%乙醇和70%乙醇洗 1 次,3min/次;(4)PBS 洗涤 5min×3 次,3%H2O2甲醇溶液处理 10min;(5)PBS 洗涤 5min×3 次,加入细胞通透液孵育 8min;(6)PBS 洗涤 5min×3 次,加入50μl TUNEL反应混合液,湿盒和暗室中37℃孵育1h;(7)PBS洗涤 5min×3次,加入 50μl转化-POD,湿盒中37℃孵育 30min;(8)PBS 洗涤 5min×3 次,二氨基联苯胺法显色,苏木精复染 2~5min;(9)PBS 洗涤 5min×3 次;(10)分别使用70%乙醇、80%乙醇、90%乙醇、95%乙醇和无水乙醇洗 1 次,3min/次;(11)二甲苯洗 5min×2 次;(12)封片、干燥后,在光学显微镜下观察并记录实验结果。细胞核染色呈棕黄色或棕红色定义为细胞染色阳性;在光学显微镜下计算10个高倍镜视野,每个视野计数100个细胞,总计1 000个细胞,计算平均阳性率(%)。
1.2.3 蛋白表达的检测 Western blot法检测大鼠海马组织原癌基因(c-fos)、pro-Caspase-3和 pro-Caspase-9蛋白表达。取部分组织按1∶10(密度:体积)加入细胞裂解液,冰上匀浆,13 000g离心20min,收集上清液;BCA法测定蛋白浓度,等量蛋白(50μg)经12%十二烷基硫酸钠聚丙烯酰胺凝胶电泳后,电转移至聚偏二氟乙烯膜上,5%脱脂奶粉(TBST)室温封闭1h;加入相应兔抗大鼠c-fos、pro-Caspase-3和 pro-Caspase-9单克隆抗体(1∶1 000)4℃孵育过夜,TBST 洗膜 3次;加入辣根过氧化物酶标记的羊抗兔IgG二抗(1∶10 000)室温摇床孵育1h,TBST洗膜3次;ECL试剂作用5min,X线胶片曝光。冲洗并扫描后,结果用Quality One软件分析杂交条带灰度值,以磷酸甘油醛脱氢酶水平为内参对照计算相对灰度值,即c-fos、pro-Caspase-3和pro-Caspase-9蛋白表达水平。
1.2.4 蛋白活性的检测 四肽荧光底物法检测Caspase-3和Caspase-9蛋白活性。取脑组织匀浆100μl和Caspase-3 底物(AC-DEVD-AMC)10μl,加入 4-羟乙基哌嗪乙磺酸(HEPES)缓冲液至 1ml,37℃孵育 1h;用荧光分光光度计在激发波长380nm、释放波长460nm处测定荧光强度。取脑组织匀浆100μl和Caspase-9底物(AC-LEHD-AFC)10μl,加入 HEPES 缓冲液至 1ml,37℃孵育1h;用荧光分光光度计在激发波长400nm、释放波长505nm处测定荧光强度。以未加脑组织时的荧光强度为参照计算相对荧光强度,即Caspase-3和Caspase-9蛋白活性。
1.3 统计学处理 应用SPSS 19.0统计软件,计量资料用表示,多组间比较采用单因素方差分析,两两比较采用LSD-t法。P<0.05为差异有统计学意义。
2 结果
2.1 FTY720对海马神经元凋亡的影响 正常组和假手术组大鼠凋亡的海马神经元比例分别为(7.5±0.40)%、(7.7±0.41)%,组间比较差异无统计学意义(P>0.05);模型组大鼠凋亡的海马神经元比例为(27.1±0.90)%,较正常组、假手术组均明显升高(均P<0.05);治疗组大鼠凋亡的海马神经元比例为(15.5±0.51)%,较模型组明显下降(P<0.05),见图 1。
2.2 FTY720对 c-fos、pro-Caspase-3和 pro-Caspase-9蛋白表达水平的影响 正常组与假手术组大鼠海马组织c-fos、pro-Caspase-3和pro-Caspase-9蛋白表达水平比较,差异均无统计学意义(均P>0.05);模型组较正常组、假手术组均明显增加(均P<0.05);治疗组较模型组均明显下降(均P<0.05),见表1和图2。
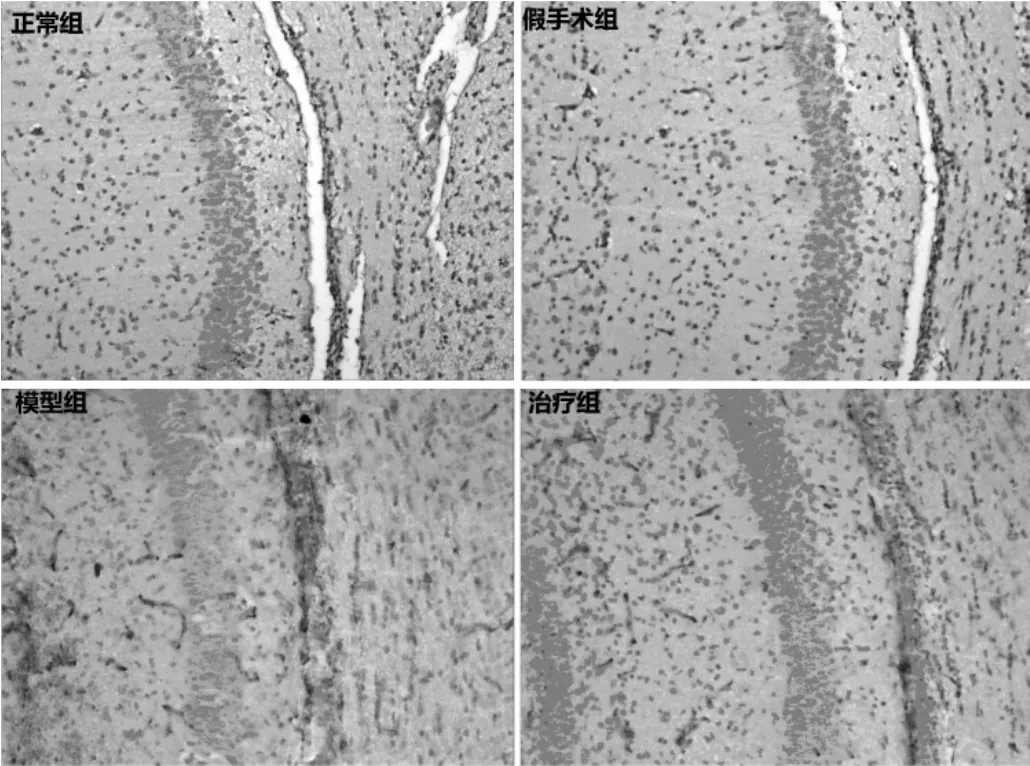
图1 FTY720对蛛网膜下腔出血大鼠海马神经元凋亡的影响(×20)
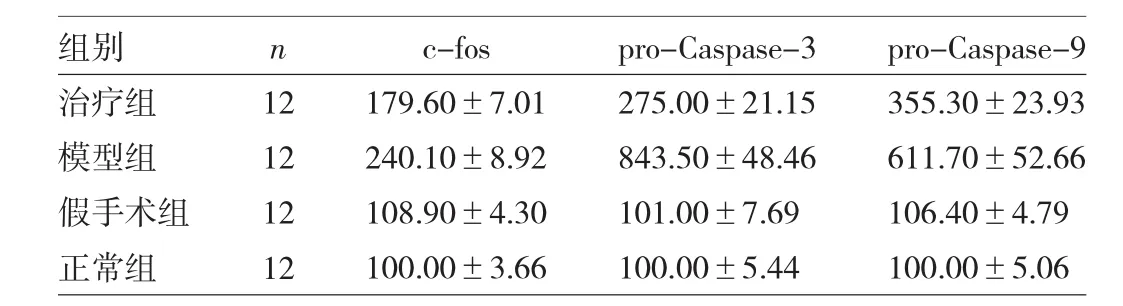
表1 4组大鼠c-fos、pro-Caspase-3和pro-Caspase-9蛋白表达水平比较(%)
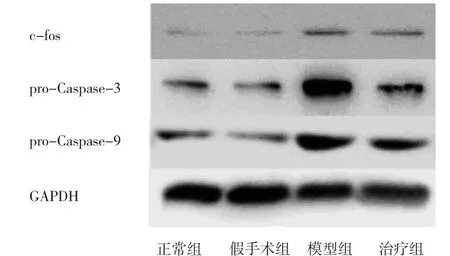
图2 4组大鼠c-fos、pro-Caspase-3和pro-Caspase-9蛋白表达的电泳图
2.3 FTY720对Caspase-3、Caspase-9蛋白活性的影响 正常组与假手术组大鼠海马组织Caspase-3、Caspase-9蛋白活性比较,差异均无统计学意义(均P>0.05);模型组较正常组、假手术组均明显增加(均P<0.05);治疗组较模型组均明显下降(均P<0.05),见表2。
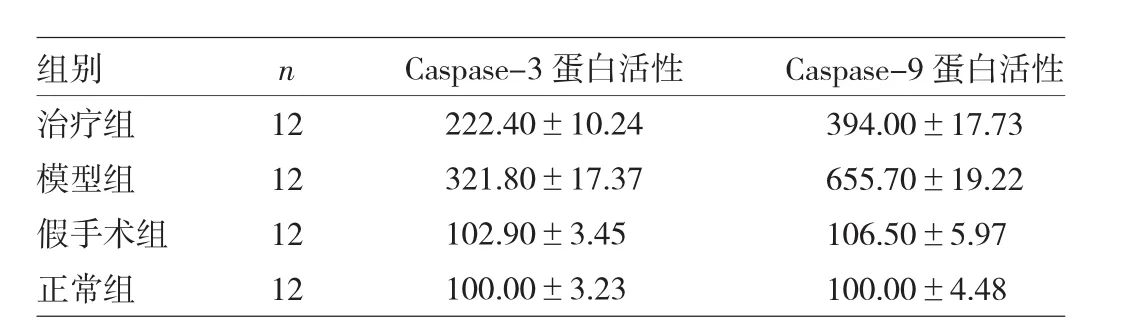
表2 4组大鼠Caspase-3、Caspase-9蛋白活性比较(%)
3 讨论
蛛网膜下腔出血是脑动脉瘤破裂的常见表现,出血导致的早期脑损伤会影响患者的预后[8-9]。免疫反应是继发性脑损伤病理、生理机制的重要组成部分,也参与蛛网膜下腔出血继发的早期脑损伤过程。脑组织局部免疫反应增强会加重脑组织的继发性脑损伤[1-2],为临床应用免疫抑制剂治疗蛛网膜下腔出血早期脑损伤提供一定的实验依据。但临床常规免疫抑制剂可导致全身免疫功能降低,继发感染。因此,寻找一种安全、有效的免疫抑制剂对降低蛛网膜下腔出血早期脑损伤具有重要意义。FTY720是一种新型的免疫抑制剂,是将冬虫夏草提取物中具有免疫抑制作用的成分ISP-I进行结构改造而成,属于鞘氨醇-1-磷酸盐受体阻滞剂[5]。FTY720在体外以无活性的形式存在,在体内经鞘氨醇激酶2磷酸化为具有生物活性的(S)-FTY720-P异构体而发挥作用。FTY720主要用于抑制器官移植所引起的排斥反应,还可用于治疗皮炎、重症肌无力等免疫紊乱/障碍疾病及某些转移性癌症[3-7]。神经细胞凋亡是较为复杂的病理、生理过程,涉及诸多信号通路和信号蛋白。c-fos蛋白是神经细胞中常见的快速反应蛋白,参与细胞的生长、发育、分化、记忆和信息传递等过程。在出血、缺血、缺氧和创伤等刺激下,c-fos基因早期表达增加,与神经细胞凋亡相关[10-11]。pro-Caspase-3、pro-Caspase-9 是凋亡蛋白Caspase-3、Caspase-9的无活性前体形式,当受到凋亡信号刺激后,会酶解成Caspase-3、Caspase-9活性二聚体形式。其中Caspase-3蛋白为凋亡执行者,可直接降解胞内结构蛋白和功能蛋白,引起凋亡。而Caspase-9是凋亡启动者,受到凋亡信号刺激后,Caspase-9自剪接激活,引起Caspase级联反应[12-14]。本研究发现正常组、假手术组大鼠海马神经元凋亡不明显,c-fos、pro-Caspase-3和pro-Caspase-9蛋白表达亦不明显,Caspase-3、Caspase-9活性不高;模型组大鼠神经元凋亡比例明显增加,c-fos、pro-Caspase-3和pro-Caspase-9蛋白表达明显升高,Caspase-3、Caspase-9活性亦明显增高。这提示以上生化指标可在一定程度上反映神经元凋亡程度。
目前FTY720用于动物实验中脑损伤治疗的剂量均选用1mg/kg,一般在脑损伤动物模型形成前短时间内腹腔或静脉注射[15-17]。既往动物实验证实,神经元凋亡一般在脑损伤后24~72h达到高峰[12-14],且有关FTY720用于脑损伤治疗的研究也一般选择在脑损伤后24h进行神经功能评估和脑组织取样[15-17]。基于以上因素,本研究在蛛网膜下腔出血模型形成前短时间(0.5h)内按1mg/kg腹腔注射FTY720治疗脑损伤大鼠,且神经元凋亡检测的时间选择在外伤后24h。另外,本实验期间有少量大鼠死亡,但4组大鼠死亡率比较差异无统计学意义,这保证了实验的均衡性。本实验结果发现,腹腔注射FTY720后,大鼠海马组织神经元凋亡比例,c-fos、pro-Caspase-3和 pro-Caspase-9蛋白表达水平以及Caspase-3、Caspase-9蛋白活性均表现出不同程度的下降,提示FTY720可抑制蛛网膜下腔出血大鼠海马神经元的凋亡。最近研究表明FTY720可抑制体外培养胶质细胞分泌炎性因子[18],阻止脑外伤大鼠皮层炎性细胞聚集[19],抑制动物脑出血后脑内淋巴细胞浸润[15]。FTY720也能明显抑制短暂性脑缺血大鼠神经元凋亡[16],减轻脑出血大鼠脑水肿[17]。以上研究结果提示,FTY720对蛛网膜下腔出血大鼠神经元凋亡的抑制作用可能与其抑制中枢神经系统炎症反应有关。已有研究发现,FTY720可用于治疗大鼠脑缺血,且不会增加机体的细菌感染率[20]。这说明FTY720用于治疗蛛网膜下腔出血早期脑损伤是安全、可靠的。然而,药效与用药时间和剂量密切相关,这方面有待进一步研究。
