MRI对宫颈癌子宫动脉化疗栓塞治疗疗效的评价
2018-08-07广东省妇幼保健院放射科广东广州511400
广东省妇幼保健院放射科(广东 广州 511400)
张 嫣 陈园园 江魁明王 霞 叶志球 郭庆禄梅世伟
宫颈癌是严重威胁女性健康的最常见的恶性肿瘤之一,其恶性程度高,预后差。近年来其治疗模式在发生不断的变化,术前新辅助化疗应用越来越广泛,已成为缩小局部晚期宫颈癌病灶或盆腔局限性晚期宫颈癌术前降期的一种有效方法。子宫动脉栓塞化疗是一种疗效快且副作用少的化疗方式,近年已成熟应用于宫颈癌新辅助化疗。MRI是诊断宫颈癌最优的影像检查手段,能提供准确的分期信息[1],且结合弥散加权成像能早期无创性评价新辅助化疗后病灶的变化[2]。本研究中,笔者通过分析宫颈癌患者子宫动脉化疗栓塞治疗前后的MRI影像资料,探讨MRI对动脉化疗栓塞术疗效的评估价值。
1 资料与方法
1.1 临床资料收集自2013年1月至2016年8月期间广东省妇幼保健院44例患者临床、MRI影像及病理资料,所有患者均接受子宫动脉化疗栓塞术,且术前、术后均行MR检查,所有病例化疗后2~3周均进行宫颈癌根治手术。患者年龄介于28~63岁,平均年龄(48.1±8.3)岁,均经手术病理证实为宫颈癌,ⅠB2期11例,ⅡA1期4例,ⅡA2期20例,ⅡB期4例,ⅢA期5例,鳞状细胞癌36例,腺癌3例,4例腺鳞癌、1例神经内分泌癌(小细胞癌)。
1.2 仪器与方法
1.2.1 MRI检查方法:采用GE Brivo MR355 1.5T MR扫描仪,8通道体部线控相圈。扫描序列包括快速自旋回波(FSE)序列横断位T1WI,TR680ms,TE8.4ms, FOV 360mm×360mm,矩阵288×192;快速自旋回波(FSE)横断位T2WI横轴位、冠状位、矢状位扫描,TR3000ms,TE120ms,FOV 330mm×330mm,矩阵288×256,层厚3mm,层间距1mm,采集次数2次;增强扫描应用LAVA(liver acquisition with volume acceleration,LAVA)技术,高压注射器经肘静脉注射GD-DTPA,剂量0.1mmoL/kg,流速为2-3mL/s,TR3.5ms,TE1.6ms,层厚4mm,层间距1mm,FOV 360mm×360mm,矩阵256×256,横轴位、冠状位、及矢状位扫描。DWI扫描采用单次激发自旋回波-平面回波(SEEPI)序列,TR3700ms,TE75ms,层厚3mm,间距1mm,FOV:360mm×360mm,矩阵128×128,NEX 6,b值取0、1000s/mm2。图像数据传输至AW4.0工作站,由两名经验丰富的放射科医师共同评估MRI图像,感兴趣区避开出血坏死区,测量表观弥散系数(apparent diffusion coefficient,ADC)。
1.2.2 DSA手术方法:治疗方法:患者卡式(FPS)评分均在60分以上,无化疗禁忌症,患者及家属对治疗方法知情同意。采用Seldinger方法,穿刺右侧或左侧股动脉成功后,置入5F导管鞘建立通道,引入5F Yashiro导管或子宫导管,先行双侧髂内动脉造影,明确子宫动脉开口,导管超选择插入子宫动脉,手推对比剂造影证实后,经导管内缓慢注入化疗药物卡铂,5-氟尿嘧啶,根据血供情况分配化疗药物,然后用明胶海绵悬浮颗粒栓塞子宫动脉。每次动脉化疗栓塞治疗后2-3周行盆腔MR检查对比。
1.2.3 疗效评价:化疗栓塞术后2-3周行MR检查进行疗效评价。①比较化疗前后肿瘤最大径的变化,采用实体瘤疗效评价RECIST(response evaluation criteria in solid tumors)标准[3]:完全缓解(CR):肿瘤完全消失;部分缓解(PR):肿瘤最大径之和缩小大于等于30%以上并至少持续4周;稳定(SD):肿瘤最大径之和缩小未达PR,或增大未达PD;进展(PD):肿瘤最大径增大大于等于20%,或出现新病灶,但原病灶分类不计在内。CR和PR为有效治疗组,SD和PD为无效治疗组。②比较化疗前后病灶ADC值的变化。
1.3 统计学方法采用SPSS 18.0统计软件进行资料分析,对治疗前后子宫颈肿瘤最大径、ADC值比较采用配对t检验,计量资料采用(±s)表示,以P<0.05为差异有统计学意义;计数资料采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 治疗前后宫颈癌病灶MRI测量MRI测量病灶治疗前最大直径介于2.5-9.9cm,均值为(4.7±1.4)cm,治疗后病灶最大直径介于0-8.9cm,均值为(2.9±1.5)cm,治疗前后病灶最大径的差异有统计学意义,P<0.05。见表1。
2.2 治疗前后宫颈癌病灶的MRI表现与ADC值变化治疗前MRI表现:所有44例病灶T1WI呈等信号,T2WI呈稍高信号,32例病灶突破基质环进入宫颈肌层,增强扫描后病灶强化程度低于子宫肌层,呈轻度均匀或不均匀强化;术前DWI为均匀高信号,ADC值平均为(0.904±0.223)×10-3mm2/s;治疗后MRI表现:病灶44例T1WI呈等信号,T2WI呈稍高信号,26例宫颈基质恢复低信号,原肌层稍高信号消失,增强扫描后病灶强化程度低于子宫肌层,呈轻度强化,DWI病灶呈均匀或不均匀高信号,术后ADC值平均为(1.041±0.231)×10-3mm2/s。对比治疗前、后病灶ADC值的变化,二者差异有统计学意义,P<0.05。宫颈鳞状细胞癌组术前、术后ADC值差异有统计学意义,其他病理类型组术前、术后ADC值差异无统计学意义,见表2图1-12。
2.3 疗效评价依据RECIST标准,CR组:3例;PR组:32例,术前、术后病灶缩小比率介于30.0%-70.8%;SD组:9例,病灶术前、术后病灶均缩小,缩小比率介于10.1%-28.9%;PD组:0例。总有效率79.5%(35/44);鳞状细胞癌组总有效率高于其他病理类型组(P<0.05),见表3。
3 讨 论
3.1 宫颈癌术前子宫动脉化疗栓塞近年来新辅助化疗越来越受到临床重视,对于那些局部晚期及盆腔局限性晚期的患者,通过新辅助化疗不仅能缩小局部病灶,降低临床分期,同时能杀灭亚临床病灶的肿瘤细胞,减少转移及局部复发风险。传统全身性静脉化疗副作用大,患者耐受性低,子宫动脉化疗栓塞术作为一种能超选到病灶部位的靶向化疗技术,全身副反应少,其解剖基础是宫颈癌的主要供血动脉起源于髂内动脉的分支子宫动脉,且宫颈癌组织学上属于细胞繁殖旺盛和高度血管依赖性肿瘤[4],子宫动脉化疗栓塞术就是基于宫颈癌组织学特点及盆腔血管解剖结构而发展起来并逐渐为临床认可并应用。该术通过选择性阻断宫颈癌的供血动脉,减少血流对化疗药物的冲刷作用,使癌细胞缺血缺氧、变性坏死,使细胞膜通透性增加,使抗癌药物更容易进入癌细胞内起到杀伤作用。吕卫国等[5]报道对宫颈癌先期子宫动脉化疗栓塞前、后标本进行了组织学观察,发现化疗后癌周间质细胞反应增加,癌周间质纤维增生明显,与化疗前相比有显著性差异。有报道认为子宫动脉介入化疗较传统的静脉化疗其癌组织内抗癌药物的峰值浓度高出约2倍[6]。但选择性子宫动脉化疗栓塞术也存在着作用维持时间短,不能完全杀灭癌细胞的缺点,因此应争取在最有利时机切除残留的癌细胞,降低局部复发率,本研究子宫动脉化疗栓塞术后2-3周即行宫颈癌根治手术。

表1 MRI显示宫颈癌病灶术前、术后病灶最大径比较

表2 宫颈癌病灶术前、术后病灶ADC值的变化比较
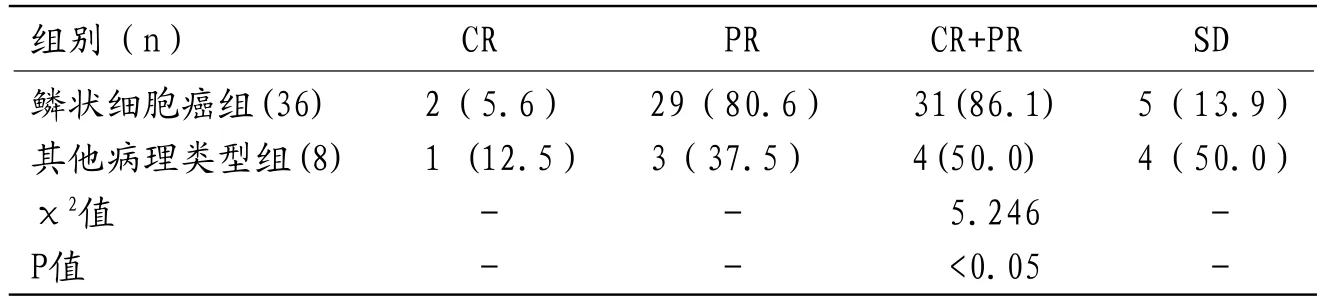
表3 鳞状细胞癌与其他病理类型组治疗有效率比较[n(%)]
3.2 宫颈癌MRI显像优势及子宫动脉化疗栓塞治疗前后的MRI影像变化MR扫描可以准确的显示宫颈癌病灶大小、血供特点、强化特征,浸润深度及范围、宫旁结构侵犯以及淋巴结转移等,能对宫颈癌的分期进行准确的判断。在MRI 图像上肿瘤与宫颈基质、子宫内膜及宫旁脂肪有良好的对比,T2WI呈稍高信号,宫颈基质环呈低信号,矢状位可以观察病灶向宫体及阴道侵犯的范围,轴位可观察宫颈低信号基质环是否完整,可作为肿瘤浸润肌层及突破浆膜层的标志,阴性预测值达90%以上[7]。本研究中子宫动脉化疗栓塞术前宫颈癌病灶T1WI呈等信号,T2WI呈稍高信号,强化程度明显低于子宫肌层,术后宫颈癌病灶较术前均缩小,T1WI仍表现为等信号,T2WI仍为稍高信号,部分内部可见高信号的坏死区,原部分子宫黏膜下层及宫颈基质消失的信号现全部或部分可见,因此我们认为有效的化疗可明显缩小癌灶,减轻肿瘤向周围基质的浸润,但是部分子宫肌层的信号出现异常,呈现出缺血改变,可能为化疗后的不良反应。本研究中动态增强后病灶呈平台型强化达70.5%(31/44),即癌灶早期明显强化,中后期持续强化,这与张婷等[8]的报道基本相符,呈快进缓退的特点。一般认为宫颈癌的强化形式基于不同肿瘤类型的血管发生,动态增强可更好的评价肿瘤血管的活性,如果肿瘤表现为乏血供,说明肿瘤对治疗可能存在抵抗。术前MRI显示3例髂血管行程淋巴结肿大,化疗栓塞术后MRI示2例淋巴结明显减小。手术盆腔淋巴结清扫经病理证实淋巴结转移1例,也一定程度说明了盆腔淋巴结转移灶对动脉化疗的良好反应性[5]。
癌肿病灶形态学的变化通常落后于分子水平的功能代谢改变,为了解决这一困扰,MR弥散加权成像越来越多的应用到宫颈癌的诊断和治疗中,以求从分子学水平给予更早期的无创性评价。宫颈癌病灶治疗前在DWI图像上表现为明显高信号,较低的ADC值,经过有效的化疗后,癌细胞出现凋亡和坏死,细胞密度减低,细胞外间隙增加,对应弥散加权图信号减低,ADC值升高[9]。ADC值的这种变化能及时反应肿瘤对治疗的反应,能作为早期评价宫颈癌化疗疗效的指标[10]。本组宫颈癌治疗前后均行弥散加权成像,结果显示经子宫动脉化疗栓塞术治疗后癌灶ADC值可见不同程度的升高。这种ADC值的变化要早于肿瘤形态学的改变[11]。
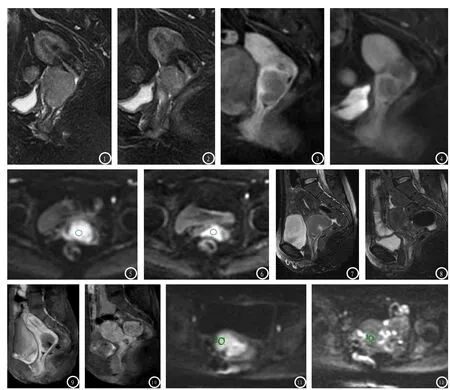
图1-6 女,60岁,绝经后阴道流血2个月。图1-2为T2WI脂肪抑制序列矢状位宫颈癌肿块子宫动脉栓塞化疗前后癌灶的变化,治疗后病灶明显减小。图3-4子宫动脉栓塞化疗前、后病灶强化特点,癌灶强化程度明显低于子宫肌层。图5-6栓塞化疗前后癌灶DWI横断位序列图像,呈高信号,术前ADC值为1.013×10-3mm2/s,术后ADC值1.211×10-3mm2/s,术后DWI高信号区域减小,癌灶ADC值升高。图7-12 女,53岁,绝经后阴道流血1个月并体重下降。图7-8为T2WI脂肪抑制序列矢状位宫颈癌肿块子宫动脉栓塞化疗前后癌灶的变化,治疗后病灶明显减小。图9-10子宫动脉栓塞化疗前、后病灶强化特点,灶强化程度明显低于子宫肌层。图11-12栓塞化疗前后癌灶DWI横断位序列图像,呈高信号,术前ADC值为0.989×10-3mm2/s,术后ADC值1.242×10-3mm2/s,术后DWI高信号区域几近消失,癌灶ADC值升高。
3.3 MRI对于宫颈癌术前子宫动脉化疗栓塞的疗效评价目前国内外较为统一的化疗疗效评价方法为RECIST标准,主要测量肿瘤最大径线的变化进行评估。目前影像学对于疗效评价方面也沿用这个标准。本研究将肿瘤的最大径线变化作为评价子宫动脉化疗栓塞术疗效的方法。在肿瘤的体积测量方面,MRI的准确性及反映组织变化的能力明显优于其他影像学手段,能更清晰显示癌肿的真实范围。本研究中子宫动脉化疗栓塞术前、术后MRI图像显示,宫颈癌肿块体积均缩小,CR组肿瘤完全消失3例,PR组32例,显示出了较好的治疗效果,缩小了肿瘤病灶、降低了临床分期,本组病例中没有出现治疗后肿瘤进展。杨学刚等[12]报道采用子宫动脉化疗栓塞治疗晚期宫颈癌268例有效率为87.3%。本组研究中总有效率为79.5%(35/44),稍低于文献报道,可能原因在于本组病例盆腔局限性晚期宫颈癌多于文献报道,且鳞癌所占比例(81.8%,36/44)稍低于文献报道比例(83.2%,223/268)。进一步分析不同病理类型宫颈癌对栓塞化疗的反应性,本组显示鳞癌的有效率为86.1%,高于其他病理类型宫颈癌,与文献报道基本相符[10],说明该化疗方案鳞癌效果优于其他病理类型;并且宫颈鳞癌治疗前后ADC值的变化也支持鳞癌对治疗反应更敏感,鳞癌组治疗前后ADC值有明显统计学差异,治疗后病灶ADC值有不同程度升高,而其他病理类型治疗后ADC值有升高,但未显示出明显统计学差异。
综上所述,通过分析本组宫颈癌子宫动脉化疗栓塞治疗的病例,显示了MRI作为一种无创性的影像检查技术在宫颈癌诊治中的优势。不仅能在新辅助化疗前清晰显示病灶、明确分期,并且化疗后及时MR检查能对化疗栓塞治疗的反应早期评价,预测治疗敏感性,指导调整治疗方案,为进一步的癌灶根治手术或临床治疗决策制定提供依据。将来随着MR技术的快速发展,MRI在宫颈癌及其他盆腔疾病临床诊治中的应用前景势必更加广阔。
