化学修饰对蛹虫草多糖体外生物活性的影响
2018-08-06贾俊强吴琼英桂仲争
贾俊强,陈 炼,吴琼英,3,桂仲争,3
(1.江苏科技大学 粮食学院,镇江 212004) (2.江苏科技大学 生物技术学院,镇江 212018) (3.中国农业科学院 蚕业研究所,镇江212018)
蛹虫草(Cordycepsmilitaris),又名北冬虫夏草,是一种珍贵药用真菌.蛹虫草含有多糖、虫草素、虫草酸、腺苷和超氧化物歧化酶等生物活性成分,其中多糖含量高达8.15%[1],为蛹虫草的主要活性物质之一.现代药理学研究表明,蛹虫草多糖的生物活性十分广泛,包括抗氧化作用[2]、调节免疫作用[3]和抗肿瘤作用[4]等,具有良好的开发潜力和应用前景.
多糖的构效关系表明,多糖的生物活性主要取决于其分子结构,包括单糖组成、分子量、主链和支链的结构、溶解度和溶液中构象等[5].化学修饰可以通过改变多糖分子结构特征提高多糖的生物活性,现已成为开发高活性多糖衍生物的主要方法[6].文献[7]利用乙酰化修饰提高了金耳多糖对小鼠脾淋巴细胞的免疫刺激活性;文献[8]利用羧甲基化修饰提高了灰树花胞外多糖的体外抗氧化活性和抗肿瘤活性.然而,利用化学修饰改善蛹虫草多糖生物活性的研究较少,特别是化学修饰后蛹虫草多糖清除DPPH自由基、螯合Fe2+和抗肿瘤等的研究尚未见报道.文中拟对蛹虫草多糖分别进行硫酸化、磷酸化和乙酰化修饰,探讨修饰后蛹虫草多糖的清除DPPH自由基活性、螯合Fe2+能力和抑制人胃癌SGC7901细胞增殖活性,以期为蛹虫草多糖的进一步开发利用提供理论指导.
1 实验
1.1 材料和试剂
蛹虫草由中国农业科学院蚕业研究所蚕桑资源功能利用研究室提供,将蛹虫草在60℃干燥后粉碎,过100目筛备用.
DEAE-Cellulose-52树脂(Whatman分装),购于上海奥宇生物有限公司;菲洛嗪和1,1-二硝基-2-三硝基苯肼(DPPH)购于Sigma-Aldrich公司;噻唑蓝[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT]、 二甲基亚砜(dimethyl sulfoxide,DMSO)、胎牛血清、高糖DMEM培养基和胰酶购于Gibco公司;乙醇、N-溴代琥珀酰亚胺、浓硫酸、硫酸铵、甲酰胺、正丁醇、乙酰酐、正丁胺、多聚磷酸、葡萄糖和苯酚等均为分析纯,购于国药集团化学试剂有限公司.
1.2 实验仪器
JJ-1精密定时电动搅拌器(金坛市荣华仪器制造有限公司);Sartorius电子精密天平(德国赛多利斯股份公司);RE-52D旋转蒸发仪(上海青浦沪西仪器厂); DHL-A电脑恒流泵(上海沪西分析仪器有限公司);DBS-160电脑全自动部份收集器(上海沪西分析仪器有限公司);Multifuge X1R 离心机(Thermo Fisher Scientific公司);UV-2450紫外可见光分光光度计(日本岛津公司);FDU-2100冷冻干燥机(上海爱朗仪器有限公司);2300-2型二氧化碳培养箱(美国Sheldon公司);XDS-1B型倒置式显微镜(重庆光电仪器有限公司);S4800-II场发射扫描电子显微镜(日立高新技术国际贸易有限公司).
1.3 实验方法
(1) 蛹虫草多糖的提取与纯化
将蛹虫草粉末配制成23.2 mg/mL悬浮液,利用超声波在103 W辅助提取39.8 min,在3 000 r/min离心10 min,收集上清液后用Sevag法脱蛋白[9],然后在80%乙醇浓度下沉淀多糖,收集多糖后复溶于蒸馏水,透析2~3 d,冷冻干燥得蛹虫草粗多糖;将得到的粗多糖利用DEAE-Cellulose-52阴离子交换树脂进行纯化,利用0~0.3 mol/L NaCl进行梯度洗脱,洗脱流速为1 mL/min,每10 min收集一管,然后利用苯酚-硫酸法[10]检测每管收集液的多糖含量,收集多糖含量最高的洗脱组分,透析后冷冻干燥.
(2) 蛹虫草多糖的乙酰化修饰
取2.0 g多糖溶于80 mL甲酰胺中,在80 ℃下持续搅拌30 min,加入50 mL乙酸酐和1% N-溴代琥珀酰亚胺.在80℃持续搅拌反应6 h,加入20 mL蒸馏水,冷却至室温,加入75%乙醇沉淀多糖.沉淀洗涤后溶于100 mL蒸馏水用NaOH溶液调至pH7.0,用透析袋透析72 h,经浓缩、冷冻干燥后即得到乙酰化蛹虫草多糖,按下式计算乙酰化蛹虫草多糖的取代度[11].
DS=1.62Ac/(43-0.42Ac)
式中:DS为取代度;Ac为乙酰基含量,%.
(3) 蛹虫草多糖的磷酸化修饰
取2.0 g多糖溶于100 mL甲酰胺中,加入10 mL三丁基胺,5.0 g多聚磷酸,室温搅拌24 h,乙醇沉淀.离心收集沉淀并溶于100 mL蒸馏水,用NaOH调至pH10,在37℃真空蒸发掉释放的三丁基胺,透析袋透析浓缩、过滤,滤液中加入0.2 g乙酸钠,用乙醇沉淀,沉淀用乙醇洗涤多次后冷冻干燥,按下式计算磷酸化蛹虫草多糖的取代度[12].
DS=1.62P/(31-1.24P)
式中:DS为取代度;P为乙酰基含量,%.
(4) 蛹虫草多糖的硫酸化修饰
分别取48 mL浓硫酸和12 mL正丁醇加入带干燥管和搅拌装置的三颈烧瓶中.再加入0.5 g硫酸铵,搅拌后冰浴冷却至0℃.缓慢加入2.0 g多糖粉末,反应4 h左右.反应结束后用NaOH调整溶液pH至8.0.透析袋透析72 h后,冷冻干燥,按下式计算硫酸化蛹虫草多糖的取代度[13].
DS=1.62S/(32-1.02S)
式中:DS为取代度;S为乙酰基含量,%.
(5) 扫描电子显微镜观察
多糖样品冷冻干燥后制成粉末,然后粘贴在导电双面胶上,在样品涂层上喷10 nm金,用扫描电子显微镜在15 kV电压下进行扫描.
(6) 抗氧化活性分析
清除DPPH自由基活性: 取2 mL样品溶液与2 mL 0.04 mol/L DPPH溶液(用95%乙醇配制)混合后,室温反应30 min后在517 nm处测定吸光值,DPPH自由基清除率按下式计算[14].
DPPH自由基清除率(%)=[C-(S-B)/C]×100
(1)
式中:S为样品与 DPPH反应后的吸光值;B为样品与95%乙醇混合后的吸光值;C为95%乙醇与DPPH混合后的吸光值.利用IC50值表示样品清除DPPH自由基的活性,IC50值通过样品浓度与清除率之间的回归方程确定.
螯合Fe2+能力: 取3 mL样品溶液与0.05 mL 5.0 mmol/L FeCl2溶液混合,然后迅速添加0.1 mL 5.0 mmol/L 菲咯嗪溶液开始反应,室温下反应10 min后在562 nm处测吸光值, Fe2+螯合率按下式计算[14].
Fe2+螯合率(%)=[(A0-A1)/A0]×100
(2)
式中:A0为空白组(蒸馏水代替样品)的吸光值;A1为样品组的吸光值.利用IC50值表示样品螯合Fe2+的能力,IC50值通过样品浓度与螯合率之间的回归方程确定.
(7) 抗肿瘤活性分析
肿瘤细胞的培养:将肿瘤细胞(人胃癌SGC7901细胞)接种培养于含10%胎牛血清、100U/mL青霉素和100μg/mL链霉素的高糖DMEM培养基中, 在37℃和5% CO2浓度下进行培养.
抗肿瘤活性分析:将肿瘤细胞(4×103个/孔)接种在96孔板中,在37℃和5% CO2浓度下培养12 h后,分别加入100μL质量浓度为100、200、300、400、500和600 μg/mL的多糖样品(以PBS为对照),培养48 h后,每孔加入100 μL浓度为1 mg/mL MTT,在37℃继续培养4 h,弃掉培养液,分别在各孔中加入100 μL DMSO,37℃振荡孵育10 min,在570 nm下测定吸光值,每组实验重复3次,按下式计算多糖的抗肿瘤活性[15]:
抑制率(%)=(1-A1/A0)×100
(3)
式中:A0为对照组的吸光值;A1为样品组的吸光值.利用IC50值表示样品的抗肿瘤活性,IC50值通过样品浓度与抑制率之间的回归方程确定.
2 结果与讨论
2.1 蛹虫草多糖的分离及紫外光谱分析
蛹虫草多糖经Sevag法反复脱蛋白后的紫外扫描光谱见图1.由图1可知,脱蛋白后的蛹虫草多糖在280 nm左右仍然有轻微的吸收峰,这说明蛹虫草多糖是一种多糖-蛋白质复合物.现有研究表明,多糖分子中的蛋白质含量与其抗肿瘤活性密切相关[16].因此,蛹虫草多糖的生物活性可能部分归因于含有少量蛋白质.为了对蛹虫草多糖进行化学修饰,采用DEAE-52纤维素阴离子交换树脂对脱蛋白蛹虫草多糖进行分离纯化(图2),共得到F1和F2两个组分,收集主要组分F2进行化学修饰.
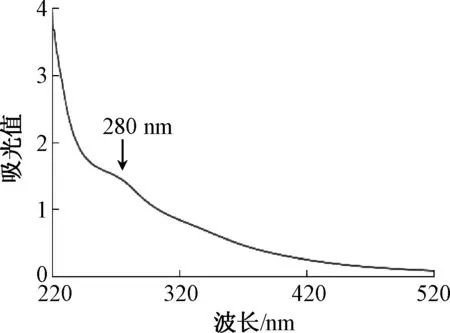
图1 蛹虫草多糖的紫外光谱Fig.1 Ultraviolet spectrum of polysaccharide from Cordyceps militaris

图2 蛹虫草多糖的DEAE-52纤维素阴离子交换色谱Fig.2 Anion-exchange chromatogram of polysaccharide from Cordyceps militaris on DEAE-52 cellulose column
2.2 蛹虫草多糖取代度分析及其晶体表面形态观察
将纯化的蛹虫草多糖分别进行乙酰化、磷酸化和硫酸化修饰,修饰后蛹虫草多糖的取代度如图3.由图3可知,蛹虫草多糖的乙酰化取代度(0.96)最高;磷酸化和硫酸化的取代度基本一致(约0.40).扫描电子显微镜观察表明(图4),蛹虫草多糖修饰前的聚集体颗粒较小,呈较规则的短棒状结构,且紧密簇拥在一起;蛹虫草多糖经乙酰化修饰后,其聚集体结构呈片状,分层紧密排列,聚集体颗粒明显增大,表面光滑;蛹虫草多糖经磷酸化修饰后,聚集体颗粒变得不规则,表面粗糙不光滑;蛹虫草多糖经硫酸化修饰后,聚集体颗粒变大,呈片状,表面略显光滑,但较乙酰化蛹虫草多糖聚集体表面粗糙.这表明蛹虫草多糖经化学修饰后聚集体表面形态发生明显变化,而这些变化可能与多糖分子修饰后空间结构发生改变有关.
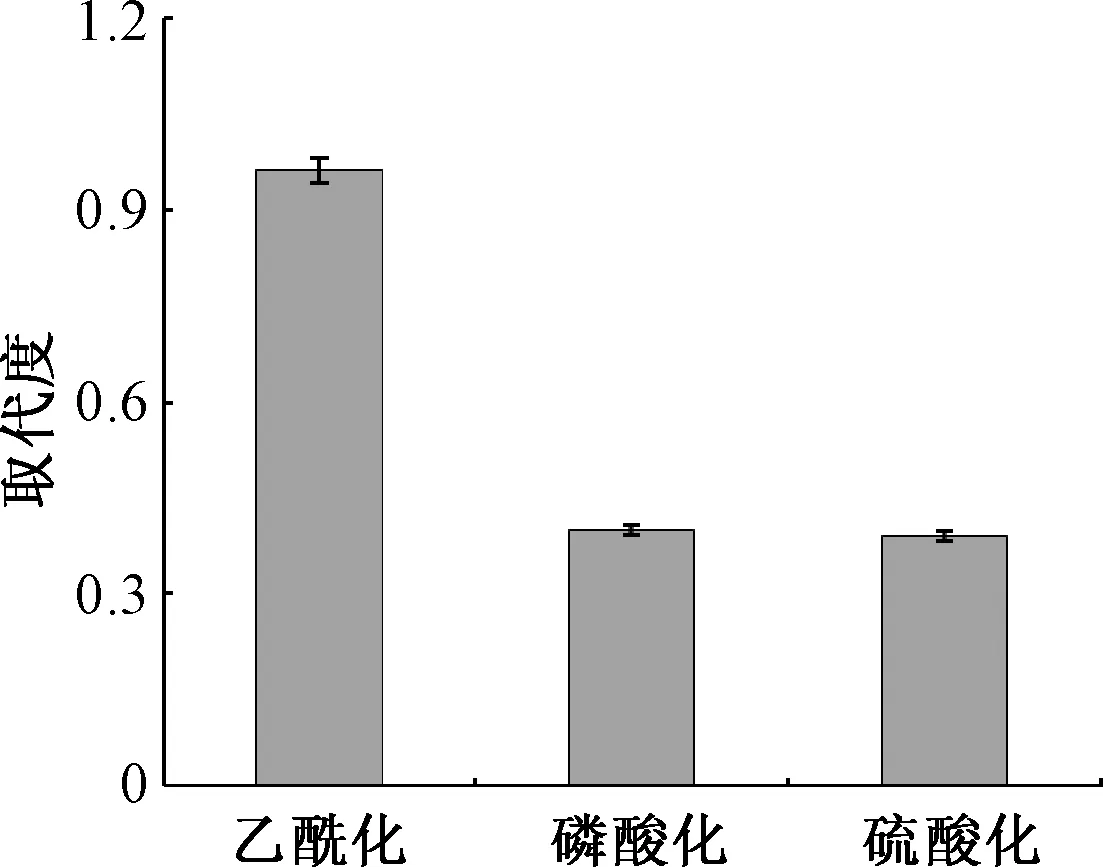
图3 不同化学修饰下蛹虫草多糖的取代度Fig.3 Degree of substitution of polysaccharide from Cordyceps militaris after different chemical modifications

图4 不同化学修饰后蛹虫草多糖的扫描电子显微镜图Fig.4 Scanning electron micrographs of polysaccharide from Cordyceps militaris after different chemical modificationss
2.3 化学修饰对蛹虫草多糖体外抗氧化活性影响
由图5可知,乙酰化和硫酸化修饰能够提高蛹虫草多糖清除DPPH自由基活性,分别使其活性提高了29.1%和11.9%,然而,磷酸化修饰导致了蛹虫草多糖清除DPPH自由基活性降低了36.4%.在这3种化学修饰多糖中,乙酰化蛹虫草多糖清除DPPH自由基活性最高.文献[17]研究乙酰化修饰灵芝多糖时认为,在多糖分子中引入乙酰基团能够有效提高其清除DPPH自由基活性,这与文中的研究结果一致.
由图6可知,蛹虫草多糖经磷酸化和硫酸化修饰后,螯合Fe2+能力显著提高,分别比修饰前提高了37.7%和47.2%.然而,乙酰化修饰对蛹虫草多糖螯合Fe2+能力基本无影响.在这3种化学修饰多糖中,硫酸化蛹虫草多糖螯合Fe2+能力最强,这主要是因为硫酸根基团使多糖端基碳的氢原子活泼,增加多糖聚合电解质和亲核性,提高了与铁离子的接触与结合能力[18].
综上所述,硫酸化修饰不仅提高了蛹虫草多糖清除DPPH自由基活性,同时也提高了蛹虫草多糖螯合Fe2+能力,是提高蛹虫草多糖抗氧化活性最理想的方法.

图5 化学修饰对蛹虫草多糖清除DPPH自由基活性影响Fig.5 Effect of chemical modification on scavenging DPPH radical activity of polysaccharide from Cordyceps militaris
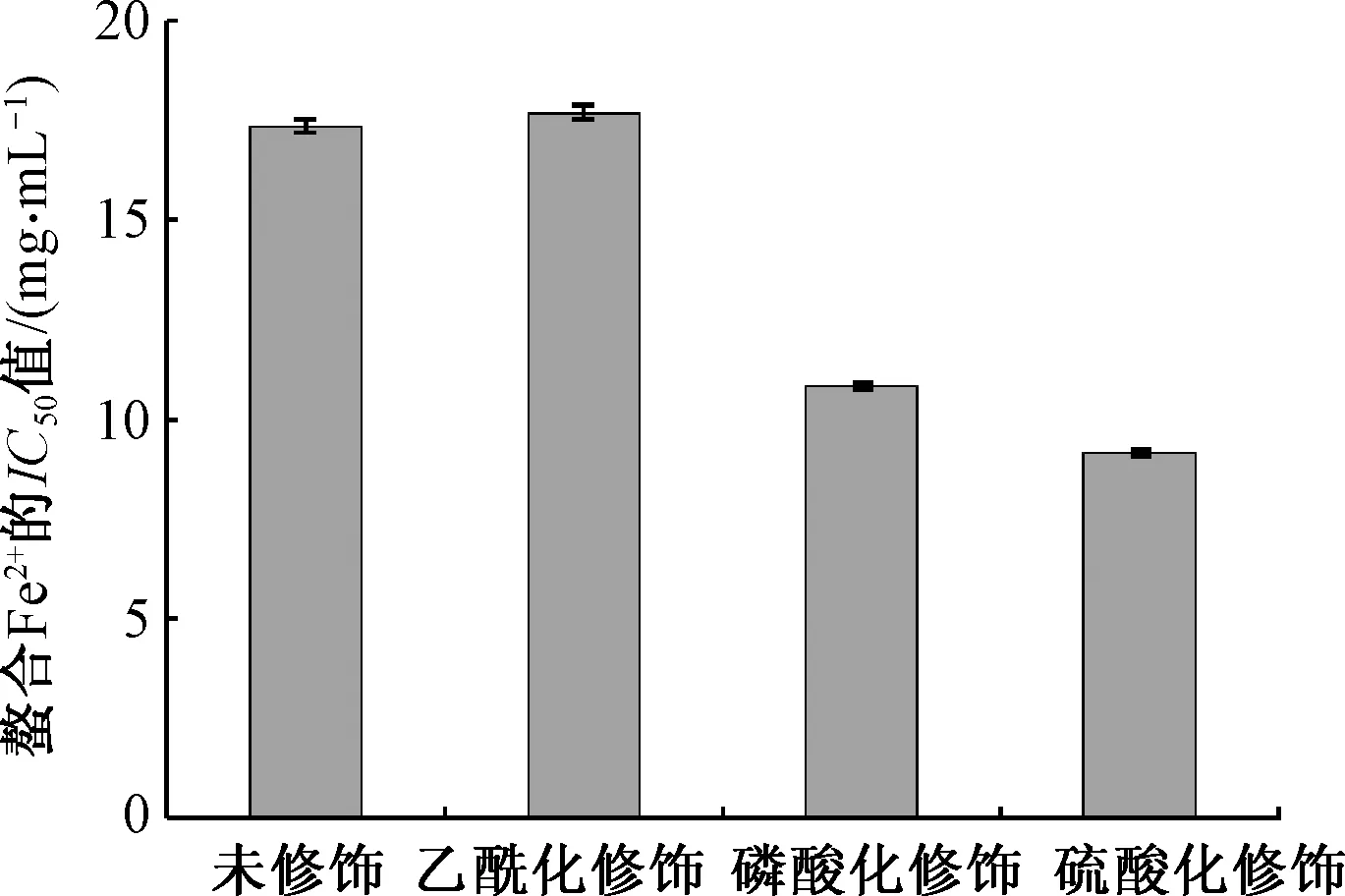
图6 化学修饰对蛹虫草多糖螯合Fe2+能力影响Fig.6 Effect of chemical modification on chelating Fe2+ capacity of polysaccharide from Cordyceps militaris
2.4 化学修饰对蛹虫草多糖体外抗肿瘤活性影响
蛹虫草多糖经化学修饰后对SGC7901细胞增殖的抑制活性见图7.由图7可知,硫酸化修饰能够显著提高蛹虫草多糖抑制SGC7901细胞的增殖,其抑制活性提高了47.0%;磷酸化修饰和乙酰化修饰并不能提高蛹虫草多糖抑制SGC7901细胞增殖活性,反而使其活性分别降低了35.5%和68.8%.硫酸化蛹虫草多糖抑制SGC7901细胞增殖活性(48 h的IC50为0.170 mg/mL)要远远高于硫酸化灰树花多糖(48 h的IC50为0.264 mg/mL)[19],具有良好的预防和治疗人胃癌疾病的潜力.大量研究表明,硫酸化修饰能够有效提高多糖的抗肿瘤活性;文献[19]用硫酸化修饰提高了灰树花多糖抑制SGC7901细胞增殖活性;文献[20]研究发现,天然茯苓菌核多糖没有抑制SGC7901细胞增殖活性,但当多糖分子中引入硫酸酯基后,其表现出良好的抑制SGC7901细胞增殖活性,在硫酸化茯苓菌核多糖5 g/L浓度时抑制SGC7901细胞增殖活性达到36.7%.硫酸化多糖的抗肿瘤活性归因其良好的自由基清除活性,能够有效阻止由氧自由基引起的细胞氧化应激反应[21-22].
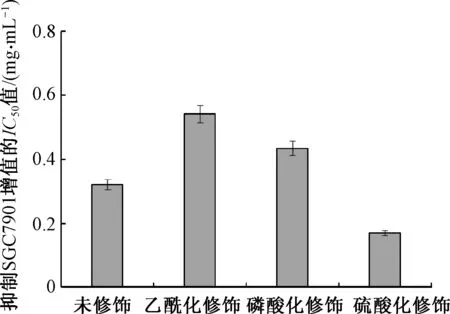
图7 化学修饰后蛹虫草多糖的SGC7901细胞抑制活性Fig.7 Inhibition activities of Cordyceps militaris polysaccharide on SGC7901 cells after chemical modification
3 结论
(1) 蛹虫草多糖是一种含有少量蛋白质的多糖,化学修饰改变了蛹虫草多糖聚集体的表面形态;蛹虫草多糖乙酰化的取代度为0.96,它的磷酸化和硫酸化取代度基本相似,约为0.40.
(2) 与乙酰化修饰和磷酸化修饰相比,硫酸化修饰不仅提高了蛹虫草多糖清除DPPH自由基活性及螯合Fe2+能力,而且提高了蛹虫草多糖抑制SGC7901细胞增殖活性,是一种改善蛹虫草多糖生物活性的有效方法.
