基于生物质谱技术解析食源性糖蛋白糖基化位点的研究进展
2018-08-04赵文竹薛思宇陈月皎张宏玲于志鹏励建荣刘静波
赵文竹,薛思宇,陈月皎,张宏玲,于志鹏,励建荣,*,刘静波
(1.渤海大学食品科学与工程学院,辽宁锦州 121013;2.吉林大学营养与功能食品研究室,吉林长春 130062)
糖蛋白是蛋白质分子和糖链通过糖苷键相连的一类复合物[1],广泛存在于动物的体细胞和植物的细胞壁、细胞膜和细胞质中。糖蛋白因具有多糖和蛋白质的部分性质,部分糖蛋白可以溶于水、酸、碱、盐溶液和有机溶剂中。随着对糖蛋白研究不断深入,糖蛋白被定义为由比较短并且一般带有分支的寡糖链和多肽在糖苷转移酶的作用下,通过糖苷键共价连接所形成的结合蛋白[2]。
糖蛋白是生物体内重要的生物大分子,可以参与细胞膜的形成,作为识别位点参与细胞间信息交流,同时还是抗体的重要组成成分[3]。糖蛋白对生长发育、细胞识别、细胞分化、信息传递和免疫调节均起着至关重要的作用[4]。随着研究的不断深入,糖蛋白的功能越来越多的被发现,糖蛋白的价值也逐渐得到肯定。研究发现食源性糖蛋白具有抗氧化活性、免疫活性和抗肿瘤活性[4]。同时,糖蛋白对人体具有极高的营养价值和保健效果,其广泛分布在中草药[5-6]、菌体[7]、藻类[8]、禽畜类[9]以及大宗作物中[10]。
糖蛋白的组成结构受糖链以及糖基化位点两方面因素影响,糖链对蛋白质的功能起到辅助和修饰作用,主要通过以下两种方式:一种是影响分子内的作用,如蛋白质的折叠方式;另一种是影响分子间的作用,如细胞的粘附作用和抗原的结合。糖链结构的微小差异可能导致糖蛋白的功能发生巨大变化。糖链结合到蛋白质氨基酸残基的过程,属于非模版驱动,且糖链具有不均一性[11],同一糖链分子式中所表示的结构较多,比如三个己糖组成的聚糖,其可能的序列会有26000多种[12]。糖链的单糖组成、数量关系、排列的方法和连接的位置都会造成糖链结构的差异,进而影响糖蛋白的功能。同时,蛋白质多肽链上发生糖基化的位点也会影响糖蛋白的性质。研究表明鸡蛋清中卵粘蛋白的高度糖基化是产生蛋白质间粘度的主要原因,发生甘露糖基化的鸡蛋清蛋白和卵白蛋白可以减轻人体对鸡蛋的过敏反应[13]。
本文对糖蛋白糖基化类型、糖基化解析方法以及生物质谱在糖基化研究中的应用进行归纳和总结,旨在为通过生物质谱技术确定糖基化位点的策略提供参考,并为深入研究食源性糖蛋白的性质和功能提供理论基础。
1 糖蛋白的糖基化类型
糖蛋白的糖基化类型分为:N-糖基化、O-糖基化以及其他类型的糖基化。
目前,对于糖蛋白糖链结构的研究主要集中在N-糖基化结构中,由于共同的生物合成途径,所有N-糖链都有一个结构为Man3GlcNAc2的五糖核心,并可根据其附着的单糖如图1所示[14]分为3类:寡糖甘露糖型糖链。其含有两个N-乙酰葡糖胺(GlcNAc)和数量不确定的甘露糖(Man),有些还会存在部分葡萄糖基(Glc)的残留;复合型糖链。其除了五糖核心外还有数量不定的GlcNAc、半乳糖(Gal)、岩藻糖(Fuc)和N-乙酰神经氨酸(Neu5Ac),有时还会有N-乙酰半乳糖胺(GalNAc)残基;混合型糖链。其结合了寡聚半乳糖苷和复合型物种的特征。N-糖基化,起始于细胞中的内质网,完成于高尔基体中,其中聚糖经由GlcNAcβ-糖苷键连接到Asn-X-Ser/Thr(有时也是Cys)基序中的天冬酰胺(Asp)基团,其中X是除脯氨酸以外的任何氨基酸[15-16]。He等[17]证明了冬虫夏草菌丝体中含有N-糖蛋白。

图1 N-糖链结构分类Fig.1 Classification of N-glycan structures
O-糖基化是在高尔基体中进行,最普遍的形式是粘蛋白型O-糖基化,其糖链通过GalNAc与丝氨酸(Ser)或苏氨酸(Thr)残基发生α-糖基化连接[18]。这些O-连接的糖链具有不同的核心结构,包含许多不同的核心区域,图2为四种最常观察到的类型[19]。粘蛋白型O-聚糖会在范围内发生变化,从单个残基到延伸的寡糖链,类似于复合型N-聚糖,可以产生大量结构变体[20]。与N-糖链的结构进行比较,O-糖链的单糖结构相对比较简单,但是结构的类型和亚型更为复杂。詹玲等[21]通过β-消除反应使糖蛋白中的糖链释放,吸光度值在240 nm出有变化,鉴定出大豆中含有O-糖蛋白。

图2 O-糖链主要核心结构分类Fig.2 Classification of the main core of O-glycan structures
其它类型的糖基化在食源性糖蛋白中出现极少,主要分为C-糖链连接糖蛋白和糖基磷脂酰肌醇化糖蛋白两种。C-糖链连接糖蛋白主要指的是糖链与蛋白残基侧链吲哚环上的碳原子通过碳碳键相连。此类糖基化很少见,仅在为数不多的天然产物中发现[22]。糖基磷脂酰肌醇化主要发生于锚定蛋白,这种糖基化主要影响细胞跨膜传导[23]。锚定蛋白上的糖链通过C-末端与细胞膜上的糖基磷脂酰肌醇化的蛋白相连,将蛋白固定于细胞膜表面,而不跨越其磷脂双分子层。
2 糖基化位点的解析技术
目前,糖基化位点解析的瓶颈在于:由于糖蛋白的微不均一性,一个糖基化位点上可能存在多个结构不同的糖链结构,难以实现糖蛋白整体的结构表征,只能分别从糖基化位点和糖链结构两个方面对糖蛋白结构进行分析。糖基化位点的解析技术主要分为核磁共振光谱技术(NMR)和生物质谱技术。
2.1 核磁共振光谱技术
核磁共振光谱方法能够对糖链的所有结构特征进行完整和明确的阐释,包括单糖组分、端基构型、单糖之间的连接类型以及它们的构象,还有非糖取代基的位置[24-26]。但NMR仍有一些局限性:NMR灵敏度低,对样品的纯度要求高,需要大量纯度较高的样品量才可以获得高分辨率光谱,在糖组学领域用到的样品都是毫克级,因此NMR技术在这一领域很少应用;糖基化位点的确定只能通过得到的糖链结构与已知糖蛋白进行比对,对于未知糖蛋白糖基化位点的解析会产生较大的误差[27]。所以此方法更多的被应用于糖链结构的解析,而在N-糖基化位点检测上则应用较少。
2.2 生物质谱技术
质谱方法能够高精度的检测出微摩尔范围内的质荷比,是糖组学中糖链分析和蛋白质组学中糖基化位点鉴定的关键技术。质谱仪的选择和差异主要表现在离子源和质量分析器。
常用离子源包括基质辅助激光解析离子源(MALDI)和电喷雾离子源(ESI)。MALDI的优点是产生单电荷离子,仪器简单,分析速度快并且对缓冲液、盐和洗涤剂等低浓度污染物具有稳定性[28-30],但是,这种类型的分析只能提供最可能存在的蛋白结构,不能完整的定义碳水化合物结构。ESI的优点是产生多电荷离子,降低了被测物的质荷比,拓宽了分子量分析的范围,灵敏度高于MALDI,缺点是检测中所使用的缓冲剂必须与电离条件相容,因为ESI对污染物的存在十分敏感[31-32]。常用的质量分析器有飞行时间(TOF)、四级杆(Q)、离子阱(IT)、傅里叶变换离子回旋共振(FTICR)和电场轨道阱回旋共振(Obritrap)等[33]。质量分析器的结构和性能不同,而每个方法都有各自的优势和劣势,IT可以进行10级分析(MSn),但灵敏度较低且存在低质量端缺失效应;FTICR和Obritrap的分辨率高,可达十万以上,但扫描时间较长;TOF和Q的分析灵敏度较高,时间短,但只能进行二级质谱分析。
在糖肽整体的检测中,为实现优势互补更全面的获得糖肽的离子谱图,通常将多个质量分析器串联,如MALDI-QIT-TOF和MALDI-TOF-TOF,以及将质谱分析器与碰撞诱导裂解(CID)、高能碰撞裂解(HCD)、电子捕获裂解(ECD)和电子转移裂解(ETD)等多种质谱碎裂方式配合使用[34-38],可以为数据的分析提供更全面的信息。
核磁共振光谱法虽然可以准确检测糖链的结构,但由于糖链部分可能存在多种异构体,对于糖基化位点的分析不准确。相比之下,生物质谱技术的谱图解析过程繁琐,与数据库进行比对的工作量较大,但可以实现对于糖基化位点和糖链结构的快速检测,结果准确。同时生物质谱技术可以从糖肽整体角度对糖蛋白的结构进行表征,可以在保证检测准确性的同时,简化实验的流程。因此,生物质谱技术更广泛的被应用在糖基化位点和肽段序列的检测中。
3 生物质谱技术解析糖蛋白糖基化位点的应用
应用生物质谱技术对于糖蛋白整体结构进行研究,主要的研究内容是N-糖基化位点以及发生糖基化的肽段序列两个方面,研究方法主要有以下两种。
3.1 基于去糖基化肽段的糖基化位点分析
目前,对于去糖基化后进行糖基化位点确定的方法有两种,二者在去糖基化的处理方法上基本一致,只是在质谱图的分析上存在差异。
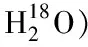
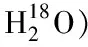
3.2 基于糖肽的糖基化位点分析
基于糖肽的糖基化位点分析相比于去糖基化的方法,可以在不丢失特异性糖基化信息的前提下,更直接地获得蛋白质和糖链之间的连接信息,并更接近于待测糖蛋白样品的真实状态[44]。此方法主要分为两种。一种为依靠已知谱库数据进行的数据扫描方式。糖蛋白在被多种蛋白酶联合切割后,用凝集素对获得的糖肽进行富集,在液相色谱中进行纯化并对所得到的各个单一组分进行质谱解析,即对质谱检测到的信号最强的母离子峰进行二级质谱分析,得到子离子峰,并对子离子峰进行三级质谱分析,以此类推,再将每级质谱图中的峰所在质荷比与谱库进行比较,从而获得肽段的序列以及糖基化位点。Franc等[45]用伴刀豆球蛋白凝集素(Con A)富集糖肽的策略,分析了豌豆幼苗铜铵氧化酶(PSAO)和小扁豆铜铵氧化酶(LSAO)的糖基化位点,得出了PSAO上有Asn334和Asn558两个糖基化位点,其中Asn558上有4条糖链;LSAO上有一个糖基化位点,上面结合了7条糖链。由于糖肽的特殊结构,在质谱检测中对所使用的串联质谱仪质量分析器有较高要求,首先,因为糖肽的分子质量比肽段的分子质量大,所以一级质谱的质量分析器要有足够宽的质量检测范围;其次,因为糖苷键和氢键会在二级质谱中碰撞破裂,所以二级质谱中,糖肽的碎片离子集中在低质量区,这就要求二级质谱的质量分析器要对低质量区全面的覆盖[46],因此,TOF和FTICR在糖肽的二级质谱分析中较为常用。傅里叶变换离子回旋共振质谱(FTICR-MS)中的CID破碎方式和ETD破碎方式相结合,就可以在不使用PNGase F酶切除糖链的情况下,对发生糖基化的肽段序列、糖基化位点和糖链结构进行分析,二者破碎方式如图3[48]。利用离子阱质量分析器进行的质谱检测,虽然由于糖蛋白的微不均一性,一个肽段所连接的糖链可能会存在异构体,导致计量水平低于非糖基化的肽段而不能得到低质量端的碎片信息,却可以实现多级质谱的分析,如Zhang等[47]利用五级串联质谱对一种标准糖蛋白进行检测,在四级谱图中得到了糖蛋白的肽段序列和糖基化位点,所以此方法可以进行已知糖蛋白高质量端的糖基化位点验证。

图3 CID和ETD碎裂规则对比Fig.3 Comparison of CID and ETD fragmentation rules
另一种方法为靶向性扫描,相比于依靠数据的扫描方式,靶向性扫描能获得更完整的糖肽序列。靶向性扫描的原理是设置前体离子扫描的质谱,根据设定的破碎后的子离子扫描母离子,从而获得糖肽的结构。Ritchie等[49]设定靶向质荷比204离子和Y1离子的前体离子扫描方式,提高了质谱检测的灵敏度,同时能鉴定出更多的糖肽异构体。目前,这种方法在食源性糖蛋白的鉴定中尚未有应用记录,未来可应用在糖蛋白低质量端的糖基化位点验证。
4 展望
近年来,随着质谱技术等方法的不断发展,N-糖基化位点及肽段序列已经可以被准确的检测出来,但是由于糖链的微不均一性,糖基化位点上所连接的糖链个数及糖链结构尚不明确。目前,对于发生N-糖基化的糖蛋白研究很多,但是由于O-糖基化的结构多变性,导致对O-糖基化糖蛋白的结构研究较少。同时,对于食源性糖蛋白结构影响功能的作用机理尚不清楚。因此,在未来研究中,研究的重点应该侧重于对O-糖基化位点与糖链结构的研究,阐述和证明食源性糖蛋白能发挥作用的机理及其构效关系等方面为食源性糖蛋白的综合利用以及新型药物和保健食品的开发奠定基础。
