基于微滴数字PCR阿胶定量检测方法的建立
2018-08-04王一村苏本玉许士明高静静周莉莉
王一村,苏本玉,李 娜,许士明,高静静,周莉莉
(山东省产品质量检验研究院/国家加工食品质量监督检验中心,山东济南 250102)
阿胶也称驴皮胶,与人参、鹿茸一起被称为“中药三宝”[1]。其补血、增强免疫力、抗疲劳、抗辐射、抑制肿瘤、保护大脑、促进骨愈合生长以及保护心血管等功效都已被证实[2-4]。阿胶产业蓬勃发展,现已融入健康中国发展战略。然而,在巨大经济利益的诱惑下,阿胶行业内制假售假现象严重[5-6]。假阿胶及其制品虽在外观、气味、质地、口感等方面与真品无明显差异,但阿胶纯度低。有些掺假阿胶甚至威胁人体健康,严重扰乱了阿胶市场秩序。当前,阿胶的真假鉴别和纯度鉴定是该行业急需解决的瓶颈难题。
大量学者已建立并应用各类方法去辨别阿胶的真伪,比如高效液相色谱及质谱法[7-8]、光谱法[9-10]、酶联免疫法[11]、电泳法[12-13]以及分子生物学方法[14-15]等,但仍然无法对阿胶纯度和品质进行评估和评价。要从根本上解决此类问题,对阿胶进行定量分析才是关键。由于技术上的难点,目前行业内阿胶定量分析研究极少,几乎处于研究空白。令人欣喜的是,微滴数字PCR的出现有望解决阿胶定量这一难题。
微滴数字PCR(ddPCR)是一种对核酸进行精确定量的全新方法[16-17],它利用有限稀释及波松分布分析对目的DNA的拷贝数进行绝对定量[18]。因此对于源性成分分析来说,ddPCR不仅能进行定性分析,更重要的是能进行精确定量。该方法不依赖标准曲线和对照、不受PCR抑制物及PCR效率的影响,通过单分子计数方式实现基因拷贝数的定量,是绝对意义上的定量[19]。目前,ddPCR技术在源性成分掺假的定量检测上已初见锋芒,而且在鉴定市售相关产品中取得了较大成绩[20-23]。因此,将该技术引用到阿胶及其制品的定量检测上是完全可行的。阿胶是以驴源性成分为唯一动物来源的产品,本研究应用ddPCR技术,通过测定阿胶中驴源性成分的绝对含量达到对阿胶进行定量分析的目的。该方法的建立有望对市场上阿胶产品进行纯度测定,从而突破现阶段无法对阿胶及其相关产品进行纯度评价的难题。
1 材料与方法
1.1 材料与仪器
阿胶纯品标准样、驴皮、马皮、猪皮及牛皮 由山东宏济堂制药集团济南阿胶制品有限公司提供;生鲜羊肉、鸡肉、鸭肉、鹅肉、鹌鹑肉以及水稻、小麦、花生、杏、玉米、大豆 济南市内农贸市场;明胶粉(分析纯) 天津市大茂化学试剂厂;貂皮和狐狸皮 由山东泰安市某养殖基地提供;8个品牌阿胶及2个阿胶速溶粉 普通消费市场;DNA提取试剂盒 德国凯杰(QIAGEN)公司;驴源性引物和探针 由宝生物工程(大连)有限公司(Takara)合成;ddPCR Master Mix 美国伯乐(Bio-Rad)公司。
Bio-Rad QX200 ddPCR微滴生成仪 美国Bio-Rad公司;梯度PCR仪 美国Applied Biosystems公司;Nanodrop 1000生物紫外可见分光光度计 美国Thermo公司;EC3Darkroom凝胶成像仪 美国UVP公司;5424R冷冻离心机 德国Eppendorf公司;DW-86L286超低温冰箱 美国T.F.S公司;BSA224S-CW电子天平 德国Sartorius公司;RCT磁力搅拌器、LAB DANCER漩涡振荡器、A11分析研磨机 德国IKA公司。
1.2 实验方法
1.2.1 阿胶样品制备 取新开封阿胶或阿胶相关产品于分析研磨机中研磨,如样品不易处理,可用液氮研磨。磨成粉后于烘箱中85 ℃烘24 h进行样品称取。将阿胶纯品作为标准品,其他8个阿胶、2个市售阿胶粉及明胶粉经上述方法研磨烘干处理后作为待测品。样品处理过程中不同样品隔离处理,严防交叉污染。
1.2.2 DNA提取 各类产品及各类组织的DNA提取步骤严格按照QIAGEN试剂盒说明书进行。利用生物紫外可见分光光度计测定DNA含量,保证目的DNA的OD260/OD280比值在1.8~2.0范围内,-20 ℃保存备用,于24 h内完成下一步实验。
1.2.3 ddPCR检测用引物探针 检测阿胶中驴源性成分的引物探针序列参考国家出入境检验检疫行业标准[24]合成。F:5′-AATAGCTCTAGCCGTACGGC TAACT-3′,R:5′-CAGGATAATGAATGTAATAAGGG CTG-3′,探针:5′-FAM-TGCCGGACATCTTCTAATCC ACCTT-ECLIPSE-3′。
1.2.4 ddPCR检测程序 ddPCR反应采用20 μL体系:上下游引物各1.8 μL(900 nmol/L),探针0.8 μL(250 nmol/L),Bio-Rad ddPCR Master Mix 10 μL,模板4 μL,无菌水补齐至20 μL。利用微滴生成器将20 μL反应液生成不低于15000个DNA模板和试剂随机分布的微滴。PCR反应程序如下:95 ℃ 10 min;94 ℃ 30 s;60 ℃ 1 min;98 ℃ 10 min;40个循环,4 ℃保存。最后用微滴分析仪对扩增产物进行分析,分析软件为QuantaSoft。
1.2.5 引物探针特异性分析 应用两种方法进行引物探针的特异性验证,一是利用NCBI数据库(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行引物探针序列的同源性比对分析。二是以试剂盒提取的驴源性DNA为阳性对照,阿胶中有可能掺假的马、猪、牛、羊、鸡、鸭、鹅、鹌鹑、貂、狐狸、水稻、小麦、花生、杏、玉米、大豆源性DNA为模板进行特异性ddPCR检测分析。
1.2.6 阿胶质量与拷贝数换算公式的建立
1.2.6.1 阿胶质量与DNA含量的关系 分别称取20、40、60、80、100、120、140、160、180、200 mg共10个质量梯度的标准品阿胶粉末进行DNA基因组的提取,实验步骤和操作保持严格一致。利用生物紫外可见分光光度计测定DNA含量,每个梯度样品设置3个重复。
1.2.6.2 阿胶DNA含量与拷贝数的关系 依据测定后的阿胶DNA浓度对样品DNA进行梯度稀释,确定10个DNA浓度进行下一步ddPCR的检测,从而确定各浓度梯度的目的DNA拷贝数,每个梯度重复3次。10个浓度梯度依次为10、20、30、40、50、60、70、80、90、100 ng/μL,每次模板选用4 μL进行ddPCR检测。
1.2.7 ddPCR准确性验证实验 为验证所建方法的准确性,分别称取10个质量分数梯度的阿胶粉与不含驴源性的明胶粉的混合品进行DNA提取。混合品总质量为100 mg,10个梯度样品中阿胶粉含量依次为10%~100%,每个梯度以10%递增。对混合样品进行DNA提取,5倍稀释后取4 μL进行ddPCR检测。
1.2.8 市售样品的检测 将从市场上搜集到的不同品牌的阿胶及阿胶速溶粉经1.2.1处理后进行DNA提取,稀释5倍后取4 μL进行ddPCR检测。用所建立方法进行阿胶定量验证实验,验证所建立方法的实际应用情况。所建方法测得阿胶含量的实际值与进行DNA提取的市售阿胶总质量的比值即为市售阿胶的纯度。
1.3 数据处理
数据采用SPSS软件进行处理和统计学分析,利用Microsoft Office Excel进行部分数据处理和图表制作。
2 结果与分析
2.1 引物和探针的特异性分析
1.2.5中引物探针的同源序列比对分析未发现同源性高的其他物种存在,而且ddPCR的特异性验证实验并未发现该引物探针在除驴源性阳性DNA外的其他所检物种DNA中出现交叉扩增,这说明所引用标准[24]中的引物探针特异性良好,符合本研究的要求。
2.2 阿胶质量与DNA含量关系确定
利用1.2.6.1的方法确定阿胶质量与DNA含量的关系。结果表明阿胶在20~200 mg质量范围内,阿胶质量与相应质量提取到的DNA含量之间呈现线性关系,相关系数R2可达0.9963(图1),说明相关性显著。
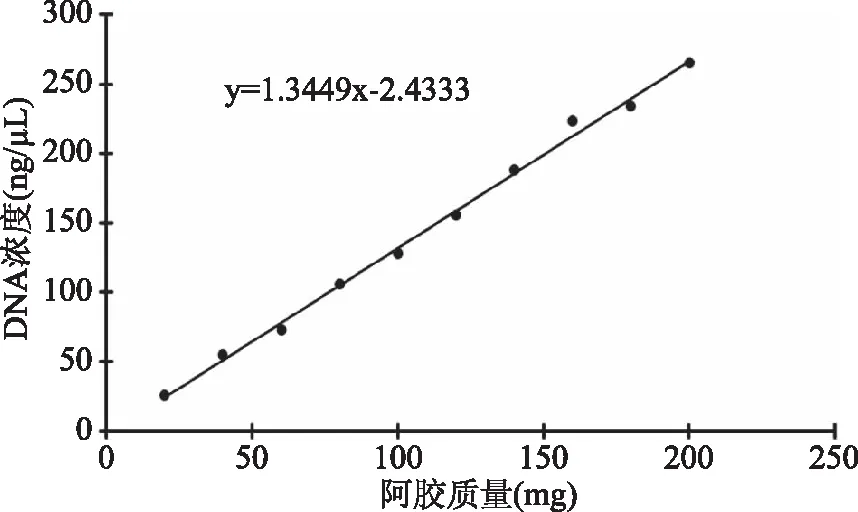
图1 阿胶质量与相应DNA含量的关系Fig.1 The linear relationship between quantity of Donkey-hide Gelatin(mg)and corresponding DNA content(ng)
2.3 DNA含量与基因拷贝数关系确定
利用1.2.6.2的方法确定阿胶DNA含量与目的基因拷贝数的关系。结果显示ddPCR在检测过程中,每个样品的微滴生成量均在15000以上,完全满足定量检测的需求。从图2中可以看出,在选用的阿胶DNA浓度范围(10~100 ng)内,即阿胶DNA质量在40~400 ng质量范围内,DNA含量与目的基因拷贝数之间呈现线性关系,相关系数R2可达0.9945(图1),说明相关性显著。

图2 阿胶DNA含量与目的基因拷贝数的关系Fig.2 The linear relationship between DNA content(ng) and the target DNA copy number
2.4 阿胶质量与目的基因拷贝数关系确定
根据2.2中确立的阿胶质量与DNA含量之间的关系,以及2.3中确立的阿胶DNA含量与目的基因拷贝数之间的关系,以阿胶DNA含量为中间过渡换算值,确定出阿胶质量与目的基因拷贝数之间的线性关系为M阿胶=0.13C+3.05。其中,M阿胶为阿胶的质量(mg),C为每微升的目的基因拷贝数(copies/μL)。
2.5 ddPCR准确性验证实验
为了验证所建立方法的准确性和实用性,分别提取已知阿胶质量的阿胶与明胶的10个梯度混合样品提取DNA,稀释5倍后进行ddPCR的检测,按2.4中建立的阿胶质量与目的基因拷贝数的关系确定混合样品中的实测阿胶质量与实际质量进行比对,每个梯度重复3次。值得注意的是,DNA的提取过程受其他因素的影响较大,比如不同样品间的差异、样品处理的差异、DNA降解、操作差异甚至污染等等,如3次样品DNA浓度检测结果差异明显,应重新进行DNA提取。
验证实验的结果如表1所示。从结果可以看出,实际测得的数值与真实值基本保持一致,最大实测偏差仅为4.0%,平行样品稳定性良好。这表明本研究所建立的利用ddPCR对阿胶进行定量检测的方法稳定可靠。

表1 已知质量的阿胶ddPCR定量验证Table 1 Quantitative verification of Donkey-hide Gelatin with given concentrations by ddPCR
2.6 市场内不同阿胶及阿胶产品的检测
使用本研究建立的ddPCR阿胶定量检测方法,对市场内销售的不同品牌的8款阿胶及2款阿胶附属产品阿胶速溶粉进行定量检测,计算每个阿胶产品的纯度。每个样品经DNA提取后,稀释5倍检测,重复3次,结果如表2所示。从结果可以看出,在阿胶产品中,1、3和4号阿胶纯度较高,纯度均在90%以上,尤其是3号样品,阿胶含量略高于本研究中的标准品。6、7、8号阿胶含量次之,2和5号产品阿胶含量相对较低,而2号仅为23.3%。对于阿胶产品阿胶速溶粉来说,阿胶含量分别为44.8%和39.8%。这说明现市场上销售的各类阿胶及其产品质量参差不齐,纯度有较大差异。以上结果再次说明本研究开发的ddPCR方法能够进行阿胶及其相关产品中阿胶含量的定量检测,可以用来进行阿胶及相关产品的掺假和纯度鉴定,有很高的实用性。
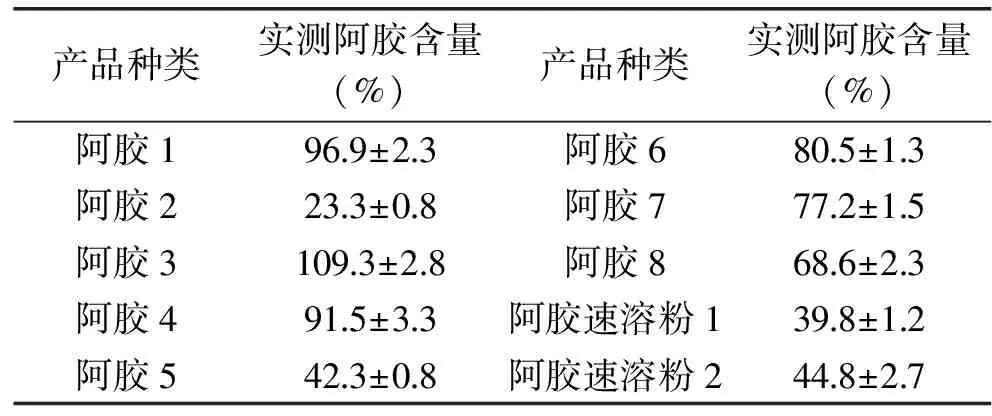
表2 市场内阿胶与阿胶相关产品的定量分析Table 2 Quantitative analysis of Donkey-hide Gelatin and its subsidiary products
3 结论
阿胶的主要原材料是驴皮,本研究通过建立阿胶质量与驴源性基因拷贝数的关系,利用ddPCR技术检测阿胶的绝对含量。研究表明,在一定质量范围内,阿胶质量与DNA含量呈线性关系。在一定DNA浓度范围内,DNA含量与DNA绝对拷贝数间亦呈线性关系。利用三者间的两两线性关系,以DNA含量为中间换算值,得到阿胶质量与DNA绝对拷贝数间公式为M阿胶=0.13C+3.05。利用此公式,通过检测未知样品中驴源性基因的DNA绝对拷贝数来得到样品中阿胶的绝对含量。准确性验证实验结果表明阿胶含量实测值与真实值基本保持一致,实测值偏差最大仅为4%,这说明本研究建立的方法准确可靠。为进一步验证该方法的应用能力,选用市场上销售的8款阿胶及2款阿胶附属产品阿胶速溶粉进行定量检测,结果发现8款阿胶中,3款阿胶纯度较高,纯度均在90%以上,2款纯度较低,最低的纯度仅为23.3%。这说明市场上销售的不同品牌阿胶间的阿胶纯度差异大,质量参差不齐。而2款阿胶速溶粉的阿胶纯度均在40%左右,这与速溶粉中添加了其他营养物质或成分有关。
以上结果表明本研究建立的ddPCR方法检测阿胶含量准确、可靠。该技术可填补阿胶行业定量检测空白,缓解市场中阿胶及相关产品造假严重的突出现状,亦可为政府监管提供依据及科技支撑,该研究具有广阔的应用前景,并可产生可观的经济效益,对阿胶行业发展将起到引领和重要的示范作用。
