添加植物乳杆菌的低脂干酪降胆固醇作用
2018-08-04王海霞曲秀伟李晓东王立娜张秀秀
王海霞,刘 璐,曲秀伟,李晓东,*,陈 萍,王立娜,张秀秀
(1.东北农业大学食品学院,黑龙江哈尔滨 150030;2.东北农业大学乳品科学教育部重点实验室,黑龙江哈尔滨 150030)
膳食营养物质摄入过量导致的血清胆固醇水平超标会引起动脉硬化、冠心病和心脑血管疾病,因此维持膳食营养物质含量在正常范围对人类健康至关重要。目前主要是靠药物降解血清胆固醇,但存在副作用且价格昂贵,故通过非药物途径降低血清胆固醇成为目前的研究热点。研究表明具有高效降胆固醇作用的益生菌能够降低血清胆固醇水平[1]。有学者以益生菌发酵的薏苡奶灌胃高脂血症小鼠,4周后喂以添加益生菌薏苡奶的实验组小鼠血清胆固醇含量下降39.10%,表明用上述菌株发酵的薏苡奶有助于降低体内胆固醇含量[2]。Xiao等[3]对年龄在28~60岁的32名成年男性进行研究,发现每天饮用300 g含8.0 lg(CFU/g)长双歧杆菌的低脂酸奶4周后,能显著降低中度高胆固醇血症患者(血清总胆固醇>240 mg/dL)的血清胆固醇水平。
益生菌发挥其降胆固醇活性的关键在于如何保持菌种活性,使其在肠道内增殖。相比与其它乳制品,干酪pH较高,能缓冲胃肠道内的高酸性环境,提高食用后益生菌的存活率,同时能为益生菌提供相对稳定的生长基质,有利于其在成熟期及储存期更好的保持活性[4];此外,干酪基质稠密和特殊的空间网络结构也可以为胃肠道消化过程中益生菌提供保护,进一步发挥其益生功能[5]。同时益生菌低脂干酪能降低消费者对脂肪的摄入量,符合膳食营养需求。Sharp等[6]对契达干酪和酸乳中干酪乳杆菌活菌数进行研究,发现冷藏条件下,成熟3个月的干酪和发酵3周的酸乳中干酪乳杆菌活菌数都能达到7.0 lg(CFU/g);酸性条件处理2 h后,干酪内的干酪乳杆菌活菌数从7.0 lg(CFU/g)下降到4.0 lg(CFU/g),而酸乳里的活菌数在酸性处理0.5 h后从7.0 lg(CFU/g)下降到1.0 lg(CFU/g),说明相对于酸乳,干酪对益生菌保护作用更强。
本研究旨在筛选高效降胆固醇的菌株,以低脂干酪为载体,建立高脂动物模型,探究含益生菌的低脂干酪对小鼠血清胆固醇的影响,以期寻找有效降胆固醇的益生菌菌种,并为开发具有降胆固醇作用的低脂干酪提供理论基础。
1 材料与方法
1.1 材料与仪器
小鼠 昆明系雄性小鼠48只,体重(20±2) g,6周龄;主发酵剂:商业发酵菌种Lactococcuslactissubsp.Cremoris和Lactococcuslactissubsp.lactis混合菌种;益生菌为分离自内蒙古传统发酵乳制品的7株乳杆菌,已经过16S rDNA测序鉴定,编号1到7分别为:干酪乳杆菌KLDS 1.0407;嗜酸乳杆菌KLDS 1.0357;植物乳杆菌KLDS 1.0320;瑞士乳杆菌KLDS 1.0612;瑞士乳杆菌KLDS 1.0618;鼠李糖乳杆菌KLDS 1.0911;鼠李糖乳杆菌KLDS 1.0205于东北农业大学乳品重点实验室保存;凝乳酶Stamix 1150 天津科汉森公司;胆固醇 上海惠世生化试剂有限公司;牛磺胆酸钠 天津市东丽区天大化学试剂厂;邻苯二甲醛 广东环凯微生物科技有限公司;MRS固体培养基 上海博维生物科技有限公司;胰蛋白酶(250 U/L)、胃蛋白酶(3000 U/L) 诺维信(中国)生物技术有限公司;巯基乙酸钠、牛胆盐 北京奥搏星生物技术责任有限公司;高胆固醇MRS-CHOL培养基 MRS培养基中添加0.2%巯基乙酸钠和0.2%(w/v)牛胆盐,121 ℃灭菌20 min后,添加2%(1.0 g/100 mL)无菌胆固醇溶液;脱脂乳粉(脂肪含量为1.0%) 雀巢公司;三磷酸腺苷二钠盐 上海凌峰化学试剂有限公司;氯化钾、氯化钠、氯化钙、磷酸二氢钾 天津市科密欧化学试剂有限公司;碳酸氢钠、氯化钠 上海惠世生化试剂有限公司。
BSA124S电子分析天平 北京赛多利斯科学仪器有限公司;pH计 北京赛多利斯科学仪器有限公司;F-4500荧光分光光度计 日本日立公司;DC150-2氮吹仪 杭州佑宁仪器有限公司;3K15离心机 德国Sigma公司;SYQ-DSX-280B手提式蒸汽灭菌锅 天津泰斯特仪器有限公司
1.2 实验方法
1.2.1 菌种的活化 MRS培养基于121 ℃灭菌15 min,接种益生菌后37 ℃培养24 h,传代至活菌数在1.0×109CFU/mL,将菌液与50%灭菌甘油1∶1混合,-20 ℃冻存备用。再将益生菌按2%(v/v)接种到60 mL 12%(w/w)复原脱脂乳和MRS培养基中,培养至活菌数为1.0×109CFU/mL[7]。
1.2.2 降胆固醇益生菌的筛选
1.2.2.1 胆固醇浓度测定及标准曲线的绘制 根据吕秀红等[8]的方法,采用邻苯二甲醛比色法进行实验。
1.2.2.2 供试菌株胆固醇降解率的测定 将1.2.1活化的菌体接种培养,经40 ℃,12000 r/min,离心10 min,收集菌体,无菌水洗涤两次,6000 r/min,离心10 min,取上清,得到菌泥。灭活菌体制备:将菌体悬浮于10 mL无菌水中,121 ℃灭菌15 min后将菌体重悬浮于MRS-CHOL胆固醇培养基。休眠菌体制备:参照Kimoto[9]的方法制备休眠细胞,将体眠细胞悬浮于10 mL含牛胆盐和胆固醇源的0.05 M,pH6.8无菌磷酸缓冲液中。
分别将热灭活细胞、体眠细胞同正常生长益生菌的MRS-CHOL液体培养基37 ℃条件下厌氧培养48 h,测定上清液胆固醇的含量;未接种益生菌的MRS-CHOL液体培养基在37 ℃条件下厌氧培养48 h,测定上清液胆固醇的含量。
胆固醇降解率测定:将各自的培养液经12000 r/min离心10 min,取上清液利用邻苯二甲醛比色法测定胆固醇浓度,并计算益生菌菌株对胆固醇的降解率。
益生菌对胆固醇的降解率(%)=[(C-C′)/C]×100
式中:C为未接种益生菌的培养液离心上清液中胆固醇浓度;C′为接种益生菌的培养液离心上清液中胆固醇浓度。
1.2.2.3 供试菌株胆盐水解酶活力定量检测 根据Chaves等[10]的方法进行实验。取0.1 mL BSH粗酶液,0.8 mL pH为6.0 的磷酸钠缓冲液、0.1 mL的7 mol/L脱氧牛磺胆酸钠溶液和浓度为2.5 mg/mL的三磷酸腺苷二钠盐,于37 ℃水浴30 min,测定酶活力。
1.2.2.4 供试菌株在模拟胃肠道消化下的耐受性 模拟胃液:氯化钾(1.12 g/L),氯化钠(2.0 g/L),氯化钙(0.11 g/L)和磷酸二氢钾(0.4 g/L),杀菌(121 ℃、15 min)。用之前,添加胃蛋白酶(0.2 g/L),用1 moL/L的盐酸调pH为3.0。
模拟肠液:胰腺液:质量分数为1.1%的碳酸氢钠、质量分数为0.2%的氯化钠、质量分数为0.1%的胰蛋白酶,用1 moL/L的碳酸氢钠调整pH为8.0,过滤除菌备用;胆液:牛黄胆酸钠含量为0.3%(w/w),1 moL/L的碳酸氢钠调整pH为8.0,过滤除菌备用。将胰腺液和胆液以2∶1的比例进行混合,制得人工肠液。
供试菌株培养液连续传代2次后,经4 ℃,10000 r/min,离心10 min,弃上清液,灭菌生理盐水洗涤,制备成5 mL的菌悬液。取1 mL菌悬液于9 mL pH为3的模拟胃液中,37 ℃厌氧培养,并分别在开始0、1、2和3 h时取样涂布,平板菌落计数法测定活菌数。测定后无菌条件下吸取含菌模拟胃液1 mL,接入pH8.0的模拟肠液中,37 ℃厌氧培养,培养1、3、5 h后测定活菌数[11]。
1.2.3 益生菌及干酪的制备 益生菌分别以2%(v/v)接种量接种到60 mL 12%(w/w)复原脱脂乳中,37 ℃培养24 h,培养两代,以1.2%(v/v)添加于干酪中。
干酪的制作[11]:原料乳→脱脂(脂肪含量约为1.0%)→巴氏灭菌(63-65 ℃,30 min)→降温至34 ℃→0.001%发酵剂及1.2%(v/v)益生菌→氯化钙(0.02%)→凝乳酶(0.003%,1 h)→切割→静置30 min→加热搅拌(每 3~5 min升温1 ℃,至升到38 ℃停止)→排乳清→沥干→拌盐(1%)→成型压榨→真空包装→成熟(6个月)→成品储藏(4 ℃)。
干酪水溶性提取物的制备:参照Bottesini等[12]的方法略作修改,将10 g干酪加入到100 mL蒸馏水中,混合匀浆1.5 min,然后在4 ℃,3000 r/min,离心30 min,取上层溶液通过 Whatman no.2滤纸过滤,得到水溶性提取物。
1.2.4 干酪理化指标分析 对成熟24周的各组干酪进行取样测定:蛋白质含量测定根据GB 5009.5-2010;总脂肪含量测定根据GB 5413.3-2010;水分含量测定根据GB 5009.3-2010;pH测定:干酪与去离子水在无菌条件下以1∶2比例均匀混合,用pH计直接测定。
1.2.5 感观分析 根据刘丽波等[13]的方法略作改进,采用100分制对成熟24周的干酪进行感官评价,感官评分标准见表1。

表1 感官评价表Table 1 Table of sensory evaluate
1.2.6 降胆固醇动物实验
1.2.6.1 动物分组及实验方案 昆明系雄性小鼠48只,体重(20±2) g,6周龄[14]。实验前小鼠适应性饲养一周。按体重随机分为4组,每组12只喂养35 d,分组情况如表1所示,喂养期间,灌胃时间为每天上午9点。
1.2.6.2 体质量、摄食量和饲料利用率的测定 喂养期间,记录小鼠摄食量及体质量,计算饲料利用率。饲料利用率(%)=体质量增量/摄食量×100。
1.2.6.3 血清中总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)含量的测定 喂养35d 后,根据WANG等[2]的方法提取小鼠血清,按照试剂盒说明书测定血清TC、TG和 HDL-C含量,计算LDL-C公式如下。
LDL-C=TC-HDL-C-1/5TG
1.2.6.4 肝脏及粪便中TC、TG的测定 根据Akalin等[15]的方法分别进行测定。
1.3 数据处理
2 结果与分析
2.1 降胆固醇益生菌的筛选
2.1.1 胆固醇标准曲线 如图1所示,将胆固醇作为标准物质,560 nm处测定吸光值,建立胆固醇标准液浓度与吸光值之间的关系,得到回归方程为:y=0.0078x+0.0325(R2=0.9975),线性良好,可用于测定胆固醇含量。
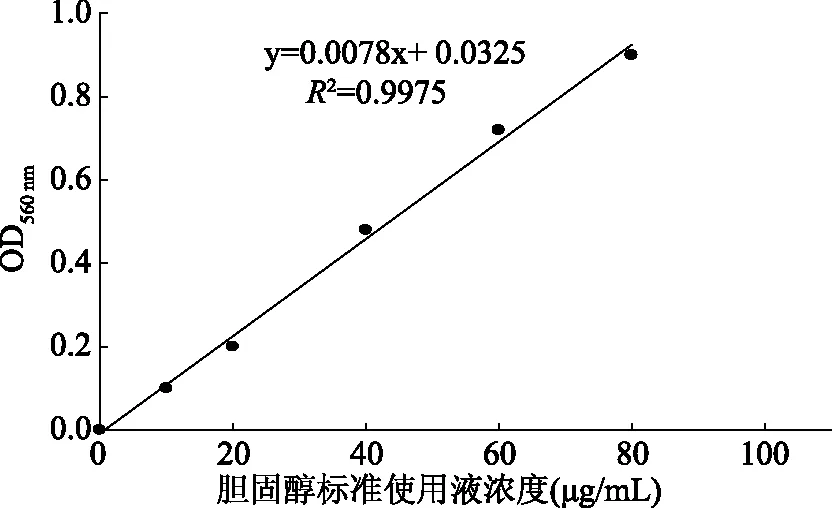
图1 胆固醇浓度标准曲线Fig.1 Standard curve of cholesterol concentration

表2 实验小鼠分组及饲养情况Table 2 Experimental grouping and feeding mode
2.1.2 供试菌株胆固醇降解率的测定 如图2所示,菌株对培养基中的胆固醇的降解能力存在显著差异(p<0.05),有3株菌的降解率均可达到50%以上。其中植物乳杆菌KLDS 1.0320菌体在3种状态下的胆固醇降解率都显著高于其他各组(p<0.05)。与正常生长状态下的菌体相比,经过热灭活及休眠菌体的降胆固醇作用显著降低(p<0.05),与植物乳杆菌KLDS 1.0320正常菌体的63.72%相比,后两者胆固醇降解率仅为20.41%和20.26%,且降胆固醇效果接近,与Kimoto等[9]的结论相一致。Liong等[16]研究干酪乳杆菌和嗜酸乳杆菌在37 ℃,20 h厌氧培养过程中胆固醇的变化,相比于正常生长状态菌体,休眠菌体及经热灭活细胞的降胆固醇活性明显降低,说明菌体生长情况直接影响胆固醇的移除率。研究表明正常菌体对胆固醇的降解主要是通过对胆固醇的同化作用及胆盐共沉淀作用,休眠细胞依靠同化作用,热灭活细胞仅依靠共沉淀作用[17]。所以维持菌体活性有利于益生菌对胆固醇的吸收同化,增强降胆固醇能力。

图2 供试菌株降胆固醇能力Fig.2 Cholesterol degrading ability of tested strains注:a~g不同菌株及A~C同一菌株的不同状态。
2.1.3 供试菌株胆盐水解酶活力定量测定 菌株的胆盐水解酶可以把结合型胆盐去结合化,使胆盐溶解度降低,加速胆酸的排泄,从而加快胆固醇向胆酸转化,起到降低血清胆固醇的含量的作用[10]。如图3所示,7株菌株都有一定的胆盐水解酶活性,总酶活均在0.25 U/mL以上,植物乳杆菌KLDS 1.0320的胆盐水解酶活性显著高于其它菌株(p<0.05),总酶活为0.71 U/mL。

图3 供试菌株胆盐水解酶活力定量测定 Fig.3 Quantitative detection of bile salt hydrolase activity注:不同小写字母表示数据差异显著(p<0.05)。
2.1.4 供试菌株在模拟胃肠道消化后的耐受性 通常情况下,摄入的益生菌必须经各级消化道,并以活细胞的状态进入大肠才能更为有效地发挥益生作用[18]。如表3所示,在pH3.0的模拟胃液环境下,随着反应时间的延长,菌株数量逐渐下降,反应3 h,植物乳杆菌KLDS 1.0320的活菌数最高,达到7.51 lg(CFU/g),表明其对胃液酸性及胃蛋白酶环境具有最强的耐受性,可以通过胃进入肠道并保持良好的活性。模拟胃液后,在pH8.0的模拟肠液中益生菌活菌数逐渐降低。反应8 h后,有两株菌株存活率在80.00%以上,其中植物乳杆菌KLDS 1.0320活菌数为6.98 lg(CFU/g),存活率为82.21%,显著高于其他菌株(p<0.05),表现出最强的模拟胃肠道耐受性。

表3 供试菌株模拟胃肠道消化后活菌数(lg(CFU/g))Table 3 Viability of the simulated gastrointestinal environment of test strain(lg(CFU/g))
综合菌株胆固醇降解率、胆盐水解酶活力及模拟胃肠道消化耐受性结果,本实验选定植物乳杆菌KLDS 1.0320应用于低脂契达干酪的研究。
2.2 干酪理化指标分析
成熟24周后各组干酪的理化指标见如表4所示。由两组空白组可知,原料乳中的脂肪含量降低会导致契达干酪中水分及蛋白质含量均显著增加(p<0.05);与低脂空白组相比,添加益生菌的干酪蛋白质和脂肪含量均有所降低,水分含量升高16.54%(p<0.05),说明植物乳杆菌KLDS 1.0320可增强低脂干酪的持水性。添加益生菌的实验组pH显著低于低脂空白组(p<0.05),与全脂干酪接近,这可能是由于干酪中水分含量较高使得在较低 pH条件下菌株还能继续产酸。

表4 干酪理化指标分析Table 4 Physicochemical index(%)of full-fat and low-fat cheeses
2.3 感官分析
如表5所示,益生菌干酪组感官评价得分高于低脂空白干酪组(p<0.05),可能是由于植物乳杆菌KLDS 1.0320作为辅助发酵剂使干酪蛋白质水解性能增强,干酪蛋白胶束结构变得更加松散、薄弱,从而使干酪硬度下降[19]。脂肪的减少会使干酪内部水分流失,导致干酪的结构变得致密而缺乏弹性,研究发现益生菌具有良好的持水能力,水分被蛋白质吸收溶胀,能使干酪网络结构的弹性增强[4],所以益生菌干酪组质构得分高于低脂空白干酪组(p<0.05)。同时促进蛋白质降解能产生更多的风味物质,部分菌株产生多糖类物质也能够改善干酪的风味,这与Agrawal等[20]报道的胞外多糖能降低干酪的苦味相符。所以植物乳杆菌作为附属发酵剂与商业契达发酵剂一起用于低脂契达干酪的制作中,能够使低脂契达干酪的品质得到改善。

表5 干酪在成熟6个月后的感官评分值Table 5 Sensory evaluation of low soft cheeses ripened for 6th month
2.4 植物乳杆菌干酪体内降胆固醇活性分析
2.4.1 体质量、摄食量、饲料利用率的测定 饲养期间,小鼠毛色光洁,食欲正常,未出现异常体征及异常行为。如表6所示,A组小鼠体质量增重、摄食量和饲料利用率明显高于饲喂高脂饲料的3组的小鼠,这可能是由于高脂饲料导致小鼠胆固醇升高等一系列的机体反应,导致大鼠食欲下降。由此也进一步说明本实验高脂模型建立成功。
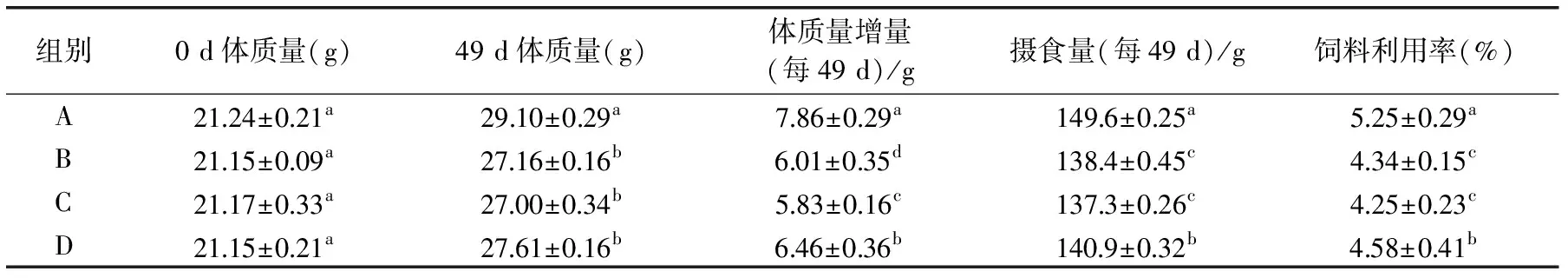
表6 小鼠的体重、摄食量和饲料利用率Table 6 Body weight,total food intake and food efficiency of rats

表6 低脂干酪对小鼠肝脏和粪便中TC和TG质量分数的影响Table 6 Effect of low-fat Cheddar cheese on the liver and fecal cholesterol levels in rats
2.4.1 血脂的测定 研究表明,TC、TG和LDL-C是导致动脉硬化的直接因素;HDL-C可以作为动脉硬化的保护因素。由表7可知,35 d灌胃实验后,与普通饲料A组相比,3组高脂饲料组的TC、TG和LDL-C水平显著升高,HDL-C水平显著降低(p<0.05)。D组的TC、TG和LDL-C含量显著低于B组(p<0.05),分别下降了21.23%、19.30%和31.73%,且显著低于空白对照C组(p<0.05),说明该组干酪能使小鼠血清中TC、TG和LDL-C含量降低;血清HDL-C虽相比B略有升高,但差异不显著(p>0.05),这与Eigawad等[21]研究发现,添加益生菌的水牛奶酸乳能降低高脂小鼠血清及肝脏中TC和LDL-C含量,但对HDL-C含量影响不显著的结论一致。动脉硬化指数AI是国际医学界制定的一个衡量动脉硬化程度的指标,指数越高,表明患病程度越高[22]。高脂饲料的B、C、D组AI显著高于A组(p<0.05),D组AI值较B组下降35.05%,说明高脂饲料能够增加小鼠动脉硬化的风险,益生菌干酪能够发挥一定的调节功效。

表7 干酪对小鼠血脂的影响Table 7 Effect of low-fat Cheddar cheese on serum TC,TG,LDL-C and HDL-C
2.4.2 小鼠肝脏和粪便中TC和TG的测定 通过测定小鼠肝脏TC、TG含量和粪便TC、TG含量,能够初步了解胆固醇在小鼠体内的积存和排除情况,从而了解高脂饮食中摄入的胆固醇在动物体内的去向。由表6可知,D组小鼠肝脏中的TC、TG相比于B组分别下降了34.22%和14.02%,且显著低于灌胃空白低脂干酪的小鼠(p<0.05),说明益生菌干酪能够降低高脂小鼠肝脏胆固醇含量,减少胆固醇在肝脏的积存,通过减少体内胆固醇的合成降低小鼠血清胆固醇的含量。Fukushima等[23]研究发现,高脂模型的大鼠饲喂嗜酸乳杆菌发酵的米糠能降低其肝脏由高脂饮食导致的血脂水平的升高,是由于嗜酸乳杆菌能降低大鼠肝脏中胆固醇合成限速酶(HMG-CoA)的活性。D组小鼠粪便中TC和TG比B组分别升高27.11%和24.22%(p<0.05),说明益生菌干酪能使饮食来源的无法被吸收利用的胆固醇排出体外,通过加速胆固醇在体内的代谢来发挥调节小鼠血清胆固醇的作用。李兰娟研究发现双歧杆菌和乳杆菌对结合型胆汁酸有脱饱和作用,通过将胆固醇还原为粪胆固醇来发挥降胆固醇作用[24];也有研究发现益生菌有助于增加粪便胆汁酸的排泄,从而有利于调节肝脏胆固醇水平的平衡[15]。
3 结论
本研究通过体外筛选得到高效降胆固醇活性的植物乳杆菌KLDS 1.0320应用于低脂干酪,实验发现与高脂模型组相比,灌胃添加植物乳杆菌干酪小鼠的TC、TG、LDL-C及AI分别下降21.23%、19.30%、31.73%和35.05%,小鼠肝脏中TG和TC下降,而粪便中TG和TC升高,说明植物乳杆菌KLDS 1.0320具有降胆固醇活性,添加到干酪中能够降低动物体内血清胆固醇含量,且对低脂干酪感官品质具有一定改善作用。目前关于如何更好的发挥益生菌体内降胆固醇活性还有待探究。
