TGF-β1诱导上皮间质转化促进口腔鳞癌侵袭转移
2018-08-02栋梁
,栋梁, ,
(重庆涪陵中心医院烧伤整形科, 重庆 408000)
口腔癌发病率位居头颈部恶性肿瘤首位,占人类恶性肿瘤发病率的3%,全球每年平均新增10万例新患者[1]。口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是具有不同程度鳞状分化的上皮侵袭性肿瘤,约占所有类型口腔癌总数的90%[2]。目前针对口腔鳞癌的治疗以手术、放化疗相结合的个体化综合疗法为主,但仍有较多患者在综合治疗后出现复发和转移,其5年生存率仅为50%[2]。因此,深入探究口腔鳞状细胞癌远处侵袭转移的机制十分有必要。恶性肿瘤在生长过程中逐渐产生全身远处侵袭转移是一个极其复杂的过程,受到多种因素在多个不同阶段的序贯调控。近年来,上皮-间质转化(epithelial mesenchymal transition, EMT)逐渐引起国内外学者的高度关注,这一过程与恶性肿瘤的远处扩散转移密切相关。EMT是指细胞在某些特殊的生理、病理生理条件下,受到内源性或外源性刺激,使得上皮细胞失去其上皮特征,并逐渐获得间质特性的过程[3-4]。上皮细胞丧失原本存在的极性、进而解除与周围细胞之间的连接并与细胞基质的接触减少、细胞骨架改变,同时伴随着细胞迁移和运动能力增强,这些都是EMT的特征性变化。EMT不仅参与胚胎早期发育和器官生成,同时也通过促进细胞侵袭转移从而参与许多恶性上皮肿瘤发展的过程[5]。
转化生长因子(transforming growth factor, TGF)是一种被证实能够被不同细胞分泌的有着广泛生物学效应的细胞因子,不仅在细胞的分裂与增殖过程中发挥重要作用,而且与新生血管形成和恶性肿瘤的发生等过程紧密相关[6-7]。此外,研究表明TGF-β信号通路的异常激活也参与了EMT 过程[8-9]。然而在具有高度侵袭性的口腔鳞癌中,EMT是否参与其远处侵袭转移过程,以及TGF-β1在这一生物学事件中的调控作用目前鲜有报道。本文旨在研究TGF-β1诱导人口腔鳞状细胞癌Tca8113细胞发生EMT及对细胞侵袭转移能力的影响。
1 资料与方法
1.1 材料
人口腔鳞状细胞癌Tca8113细胞购自中国科学院上海细胞生物学研究所;TGF-β1购自R&D公司;TGF-β1抑制剂LY2109761购自Selleck公司;TRIzol RNA 提取试剂购自Takara 公司;本研究所有PCR引物的设计与合成均委托上海擎科生物公司完成;多克隆兔抗人E-cadherin、Vimentin、GAPDH一抗购自美国Santa Cruz公司;辣根酶标记羊抗兔IgG购自美国Cell Signaling Technology公司; Protein marker 购自Thermo Fisher公司;ECL 发光试剂盒购自Millipore公司;小牛血清购自GIBCO 公司;RPMI-1640培养基购自HYCLONE公司;24孔transwell小室(孔径8 μm)购自Corning Costar公司;细胞基质胶(Matrigel)购自BD公司。
1.2 细胞培养
Tca8113细胞株在37 ℃、5%CO2、饱和湿度条件的细胞培养箱中用含10%小牛血清、100 u/mL青霉素、100 μg/mL庆大霉素、RPMI-1640 培养基中培养。用0.25%胰酶消化传代。当细胞铺满瓶底60%后,改换用无血清RPMI-1640培养基对细胞进行饥饿处理(6~8 h),再加入TGF-β1处理24 h。
1.3 细胞形态学观察
将长满的Tca8113细胞消化、传代种于6孔板,待其贴壁后用无血清RPMI-1640培养基饥饿处理6~8 h。第二日使用TGF-β1对细胞处理48 h后在普通倒置光学显微镜下观测Tca8113细胞形态变化并拍照。
1.4 RNA 提取和real-time PCR 检测
使用冰上预冷PBS洗涤将处理完成的细胞洗涤3次,随后每个孔分别加入1 mL Trizol溶液,提取细胞总RNA为后续实验做准备。PCR 所用引物由上海擎科生物科技公司上海分公司合成,引物序列如下:GAPDH 上游引物5’-ATGGGGAAGGTGAAGGTCG-3’,下游引物5’-GGGTCATTGATGGCAACAATATC-3’ ; Vimentin 上游引物5’-CCAAACTTTTCCTCCCTGAACC-3’,下游引物5’-GTGATGCTGAGAAGTTTCGTTGA-3’ ;E-cadherin 上游序列5’-GTACTTGTAATGACACATCTC-3’;下游引物5’-TGCCAGTITCTGCATCTGC-3’。反应条件均为95 ℃、3 min 预变性;94 ℃、30 s ;48 ℃、30 s,72 ℃、1 min,扩增35个循环;72 ℃延伸10 min。
1.5 Western blot检测
将已处理好的口腔鳞癌Tca8113细胞系用PBS洗涤3次随后加入RIPA裂解液并用细胞刮刀刮下来放入1.5 mL EP管中冰上裂解30 min。随后于12 000 r/min离心10 min并将蛋白上清液冻存于-20 ℃。使用 5×蛋白上样缓冲液混匀蛋白上清后于95 ℃中加热10 min,待其充分变性。上机跑电泳,随后转膜并置于5%脱脂牛奶中封闭1 h。封闭结束后使用TBST洗膜5 min×3次,随后将膜置于多克隆兔抗人的GAPDH、Vimentin、E-cadherin(浓度均为1∶1 000)中4 ℃孵育过夜。次日,洗膜5 min×3次后,置于辣根酶标记羊抗兔IgG中室温孵育2 h。TBST洗膜5 min×3次后,采用ECL化学发光法金鼎显影。应用Quantity One软件分析条带灰度值并作统计分析。
1.6 细胞迁移与侵袭实验
将Matrigel胶 (matrigel原液与无血清培养基之比为1∶3)铺在小室上面,置于37 ℃培养箱中待用。将口腔鳞癌Tca8113细胞系在无血清RMPI-1640培养基中饥饿处理6 h后,将其消化、重悬,上室加入无血清细胞悬液200 μL(细胞量4×105/mL),下室加入含20%FBS的RMPI-1640培养基,每孔600 μL,培养箱中培养48 h。处理完成后取出小室,用PBS洗涤3次,并用湿棉签轻柔擦除上室面的细胞,随后置于4%多聚甲醛中固定20 min。取出室温下风干3~5 min,随后置于结晶紫染料中染色15 min。最后用PBS洗涤3次,并置于倒置显微镜下观察穿过微孔膜的细胞数量,并进行统计分析。
1.7 统计学方法
2 结果
2.1 TGF-β1促进上皮样Tca8113细胞向间质样细胞转化
Tca8113 细胞经过10 ng/mL浓度TGF-β1刺激24 h 后,在普通倒置光学显微镜下观察拍照发现,Tca8113细胞在对照组中形态为典型的上皮样结构,而经10 ng/mL TGF-β1处理的Tca8113细胞大部分细胞形态变为细长梭形,呈现明显的间质细胞形态 (图1)。

a:空白对照组(0 ng/mL TGF-β1);b: TGF-β1处理组(10 ng/mL TGF-β1);c: TGF-β1+TGF-β1 siRNA组(10 ng/mL TGF-β1+LY2109761)
图1Tca8113细胞经10ng/mL浓度TGF-β1处理24h后的形态学变化(×400)
2.2 TGF-β1对Vimentin、E-cadherin mRNA表达的影响
经过不同浓度(0 ng/mL、1 ng/mL、5 ng/mL、10 ng/mL)TGF-β1处理24 h后,RT-PCR结果显示,与空白对照组相比,TGF-β1刺激后Tca8113细胞TGF-β1处理组的上皮标记蛋白E-cadherin mRNA表达量随药物浓度的增加而下降,而间质标记蛋白Vimentin mRNA的表达量却随药物浓度的增加而逐步增加,差异具有统计学意义(P<0.05),见图2。

a:E-cadherin mRNA相对表达量;b:Vimentin mRNA相对表达量 *:与0 ng/mL TGF-β1比较,P<0.05;**:与0 ng/mL TGF-β1比较,P<0.01
图2Tca8113细胞经不同浓度TGF-β1处理24h后E-cadherin和VimentinmRNA的表达量
2.3 TGF-β1对Vimentin、E-cadherin 蛋白表达的影响
不同浓度(0 ng/mL、1 ng/mL、5 ng/mL、10 ng/mL)TGF-β1处理Tca8113 细胞24 h后,Western blot结果显示TGF-β1刺激后,Tca8113细胞上皮标记蛋白E-cadherin表达量随TGF-β1浓度的增加而下降,而间质标记蛋白Vimentin的表达量却随TGF-β1浓度的增加相应增加, 差异有统计学意义(P<0.05),见图3。
2.4 TGF-β1抑制剂逆转上皮间质转化
使用10 ng/mL TGF-β1处理处理Tca8113 细胞24 h后,与对照组相比,上皮表型E-cadherin的mRNA和蛋白表达水平明显下降,间质表型Vimentin的mRNA和蛋白表达水平明显升高,差异有统计学意义(P<0.05)。而加用10 ng/mL浓度TGF-β1抑制剂LY2109761则显著逆转这EMT现象,差异有统计学意义(P<0.05),见图4。
2.5 TGF-β1促进Tca8113 细胞迁移
在Transwell小室迁移实验中,我们发现TGF-β1处理24 h后,与对照组相比TGF-β1处理组中Tca8113细胞的迁移能力显著增强,差异有统计学意义(P<0.05),而加用TGFβ1特异抑制剂LY2109761能够逆转这一过程,差异有统计学意义(P<0.05),见图5。
2.6 TGF-β1促进Tca8113 细胞侵袭
在Transwell小室迁移实验中,我们发现TGF-β1处理24 h后,与对照组相比TGF-β1处理组中Tca8113细胞的侵袭能力显著增强,差异有统计学意义(P<0.05),而加用TGFβ1特异抑制剂LY2109761能够逆转这一过程,差异有统计学意义(P<0.05),见图6。
3 讨论
口腔鳞状细胞癌是最常见的头颈部恶性肿瘤,具有恶性程度高、局部生长迅速、晚期易于侵袭转移及复发等生物学特点[10-12]。恶性肿瘤的扩散转移过程受到多基因、多因素互相调控,包括以下几个阶段:肿瘤细胞首先从原发病脱离,随后随着血液循环到远处定植生长成为转移灶,在这个过程中其是通过局部浸润、血行转移、细胞增殖等步骤来序贯实现的[13-15]。如何早期发现和阻断该肿瘤的发生发展以及应用有效的治疗方法是预防与治疗口腔鳞癌的关键所在。

a:Wester blot检测E-cadherin、Vimentin蛋白表达;b:E-cadherin相对表达量;c:Vimentin相对表达量 *:与0 ng/mL TGF-β1处理组比较,P<0.05;**:与0 ng/mL TGF-β1处理组比较,P<0.01
图3Tca8113细胞经不同浓度TGF-β1处理24h后E-cadherin和Vimentin蛋白的表达量

a:Wester blot检测E-cadherin、Vimentin蛋白表达;b:E-cadherin相对表达量;c:Vimentin相对表达量 *:P<0.05;**:P<0.01

a:空白对照组;b: TGF-β1处理组;c: TGF-β1+LY2109761组;d: TGF-β1+TGF-β1 siRNA组
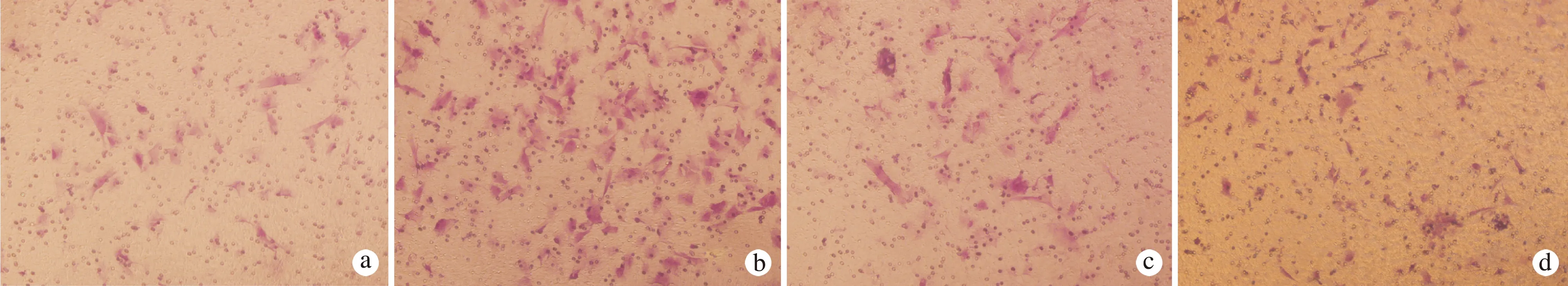
a:空白对照组;b: TGF-β1处理组;c: TGF-β1+LY2109761组;d: TGF-β1+TGF-β1 siRNA组
越来越多的研究结果表明,EMT 广泛参与多种肿瘤的侵袭和转移生物学过程,包括乳腺癌、宫颈癌、肝癌、结肠等[16-18]。Greenburg等[19]在实验中发现培养的上皮来源细胞逐渐获得间质细胞的特性,在这一基础上首次证实EMT的发生。 EMT在胚胎和器官的发育、多种纤维化疾病以及恶性肿瘤发病等过程中都发挥着重要作用。目前,口腔鳞状细胞癌中的EMT 研究报道较少。有学者使用免疫组织化学方法检测发现,在口腔鳞状细胞癌组织中EMT相关指标snail和Slug呈高表达,而上皮表型E-cadherin呈低表达,并且snail、slug与E-cadherin呈负相关,而与患者的预后成正相关[20-22]。Krisanaparkornkit等[23]采用Western blot和明胶酶谱法分别检测不同类型口腔鳞癌细胞株(HN008、HN5 和HN6、HN15)中EMT与侵袭相关指标的表达情况,在多种细胞株中检测到E-cadherin、MMP-9的表达下调和Vimentin、MMP-2的表达上调。整合素尤其是αVβ6 整合素在EMT中起重要作用,有学者发现在口腔鳞状细胞癌中完整的β6 亚基能够诱导EMT的发生,上调vimentin的表达,减少cytokeratin和E-cadherin的表达,而表达不完整β6亚基的口腔鳞癌细胞能够保持其上皮特性并不改变vimentin或E-cadherin的表达[24]。以上研究证实EMT参与了口腔鳞癌的发病过程,但是口腔鳞癌中EMT程序是如何启动的及其对肿瘤细胞的生物学功能有何影响,目前鲜有报道。
TGF-β1是TGF-β超家族的重要成员之一,是一类具有多种生物学活性的细胞因子, 对细胞侵袭、凋亡、衰老以及分化等重要的生理过程进行调节[25-26]。EMT 的发生是一个复杂的过程,涉及众多分子和信号通路, TGF-β1信号通路在EMT的启动和发展过程中作为主要诱导剂发挥关键作用[27-28]。多个系列研究证明,TGF-β信号通路的异常激活是恶性肿瘤发生侵袭转移的关键调控因子[29]。肿瘤细胞内经常可检测到活化TGF-β 的产生增加;这不仅触发EMT程序的启动、增强其侵袭转移能力,而且也与肿瘤微环境局部的新生毛细血管形成有关,后者可为发生迁移的肿瘤间质细胞提供营养支持[30-31]。由于TGF-β 引发的EMT 针对不同类型的上皮细胞具有不同的特点,因此,TGF-β 诱导EMT 发生的机制在不同的肿瘤发生过程中确实存在着差异。目前关于TGF-β1能否诱导人口腔鳞状细胞癌Tca8113 细胞发生EMT,尚未见报道。因此,基于以上研究发现,我们推测TGF-β1通过诱导人口腔鳞癌Tca8113 细胞EMT的发生,使其侵袭转移增加,导致肿瘤的远处转移。
在本项研究中,我们首先验证了TGF-β1是否能够诱导Tca8113 细胞EMT的发生。结果表明,使用10 μg/L TGF-β1处理24 h后,大部分Tca8113细胞的形态与对照组相比明显拉长呈长梭形,呈现散在生长状态。这一结果表明TGF-β1能够诱导典型的EMT的发生。在EMT发生时,E-cadherin 作为上皮间黏附的主要标记蛋白其表达下调,而间质表型蛋白vimentin的上调使细胞相互之间的黏附力下降,使细胞的运动能力明显增强,进而引起局部肿瘤细胞向外周浸润生长及转移。接下来我们在mRNA和蛋白水平分别验证受TGF-β1刺激的Tca8113细胞是否发生EMT。经过不同浓度(0 ng/mL、1 ng/mL、5 ng/mL)TGF-β1处理24 h后,RT-PCR和Western blot结果显示5 ng/mL浓度的TGF-β1处理24 h后,Tca8113细胞E-cadherin的mRNA和蛋白表达水平最低,而Vimentin的mRNA和蛋白表达水平最高,这一结果表明TGF-β1成功诱导Tca8113 细胞EMT的发生。在证实TGF-β1的确能够启动EMT程序之后,我们在此基础上采用Transwell小室实验检测Tca8113细胞迁移和侵袭能力的变化。经过5 ng/mL浓度TGF-β1处理24 h后,TGF-β1处理组Tca8113细胞体外迁移及侵袭能力显著增强,而TGF-β1抑制剂LY2109761则有效减弱这一效应。这一结果进一步证实TGF-β1通过启动EMT程序进而促进Tca8113细胞的体外迁移与侵袭能力。本研究存在以下不足之处:①验证了TGF-β1诱导的口腔临床细胞癌EMT,但TGF-β1调控口腔鳞状细胞癌EMT发生的具体调控机制目前尚不清楚。有研究表明在乳腺癌中能够促进ZEB1 和ZEB2 的表达,抑制E-cadherin 的表达。同时沉默这两种转录因子能完全抵消TGF-β1对E-cadherin的抑制作用,而间质标志蛋白,如N-cadherin和Vimentin则不受ZEB1和ZEB2沉默的影响。因此,在后续研究中我们将针对TGF-β1对EMT相关转录因子的调控作用做进一步研究;②只应用一种细胞系来进行验证,在后续的深入研究中我们将采用两种以上的细胞系来进行实验,使研究结果更有说服力。
总之,本研究发现在口腔癌Tca8113细胞系中TGF-β1能够启动EMT程序,从而显著促进细胞侵袭和迁移能力,这为口腔鳞癌的高侵袭性提供新的理论支持。因此,深入研究EMT在口腔鳞癌发病中的作用机制,通过干预以及逆转肿瘤细胞的EMT进程,削弱恶性肿瘤细胞的侵袭潜能,这将为口腔鳞癌的个体化治疗提供新的思路和依据。
